-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPorovnanie produkcie sanguinarínu suspenznými kultúrami rastlín čeľade Papaveraceae
Comparison of sanguinarine production in suspension cultures of the Papaveraceae plants
Intact plants of the Papaveraceae family are producers of a whole range of benzylisoquinoline alkaloids, which are used in pharmaceutical industry. In vitro cultures derived from plants of the Papaveraceae do not have the ability to produce such a broad spectrum of alkaloids, only the biosynthetic pathway leading to sanguinarine is active. This study deals with the preparation of in vitro cultures of Papaver somniferum, Eschscholtzia californica, Chelidonium majus and Macleaya cordata. Their sanguinarine production abilities were tested and compared. The lowest amounts of sanguinarine from all cultures tested were accumulated in suspension cultures of the opium poppy (0.45–0.55 μg in 1 g of fresh weight). Eschscholtzia californica, Chelidonium majus and Macleaya cordata cultures produced similar amounts of sanguinarine (18.0–22.7 μg; 20.5–26.3 μg; 15.4–20.3 μg in 1 g of fresh weight, resp.). The elicitation study used a biotic stressor, Botrytis cinerea hydrolysate. In all cultures treated, an increase in sanguinarine accumulation was observed. Of all cultures tested, the most intensive response was observed in the opium poppy cultures, although the amount of sanguinarine in the elicited poppy cultures was lower than in the non-elicited samples of the other cultures.
Key words:
Papaver somniferum • Eschscholtzia californica • Chelidonium majus • Macleaya cordata • suspension cultures • elicitation • sanguinarine
Received 25 October 2012 / Accepted 17 November 2012
Autoři: František Bilka; Andrea Balážová; Andrea Bilková; Ivana Holková
Vyšlo v časopise: Čes. slov. Farm., 2012; 61, 267-270
Kategorie: Původní práce
Článok venujeme našej učiteľke a kolegyni doc. RNDr. Márii Benešovej, CSc., k jej životnému jubileu.
Souhrn
Intaktné rastliny čeľade Papaveraceae sú schopné produkovať celý rad benzylizochinolínových alkaloidov, ktoré majú využitie vo farmaceutickej praxi. In vitro kultúry odvodené z rastlín tejto čeľade si nezachovávajú schopnosť produkcie širokého spektra alkaloidov – aktívna je v nich iba biosyntetická dráha, vedúca k sanguinarínu. V rámci tejto práce boli odvodené in vitro kultúry z rastlín Papaver somniferum, Eschscholtzia californica, Chelidonium majus a Macleaya cordata a porovnaná ich schopnosť produkcie sanguinarínu. Najnižšie množstvá sanguinarínu vyprodukovali kultúry maku siateho (0,45–0,55 μg . g-1 čerstvej hmoty). Kultúry Eschscholtzia californica, Chelidonium majus a Macleaya cordata produkovali navzájom porovnateľné množstvá (18,0–22,7 μg; 20,5–26,3 μg; resp. 15,4 až 20,3 μg na 1 g č. hm.). Po elicitácii kultúr hydrolyzátom z Botrytis cinerea bola vo všetkých vzorkách zaznamenaná zvýšená produkcia sanguinarínu. K relatívne najvyššiemu zvýšeniu produkcie došlo v kultúrach maku siateho, avšak tieto kultúry ani po elicitácii nedosiahli úroveň produkcie ostatných troch kultúr bez ovplyvnenia.
Kľúčové slová:
Papaver somniferum • Eschscholtzia californica • Chelidonium majus • Macleaya cordata • suspenzné kultúry • elicitácia • sanguinarínÚvod
Rastlinné in vitro kultúry sú považované za alternatívny zdroj získavania sekundárnych metabolitov, z ktorých mnohé majú uplatnenie vo farmaceutickej praxi. Využitie bunkových kultúr na ich produkciu má rad výhod: produkcia sekundárnych metabolitov prebieha riadene, bez vplyvu počasia, ročného obdobia, vylúčené sú biologické vplyvy (mikroorganizmy, hmyz, a pod.), je možné selekciou dosiahnuť vyššiu produkciu, podnietiť tvorbu žiadaného izoméru, proces možno automatizovať a dosiahnuť kontinuálnu produkciu1–3).
Očakávania, že bude možné pletivové kultúry maku siateho použiť k produkcii morfínanov, sa nenaplnili. Hodges a Rapoport4) síce publikovali výsledky, podľa ktorých v novoodvodených kalusových kultúrach detegovali nízke hladiny morfínu, avšak schopnosť biosyntézy morfínu sa po niekoľkých pasážach rýchlo strácala. Facchini a Bird5) s ohľadom na iné práce považujú tieto výsledky za nedôveryhodné. Ich presvedčenie podporuje experiment, v ktorom po externom pridaní (R)-retikulínu nedošlo k jeho vstupu do biosyntetickej dráhy morfínanov. Za primárnu príčinu neschopnosti bunkových kultúr maku produkovať morfínany sa považuje neprítomnosť 1,2-dehydroretikulínreduktázy v bunkových kultúrach, ktorá je zodpovedná za premenu (S)-retikulínu na (R)-retikulín6). Navyše sa zdá, že k tvorbe morfínanov je nutná kooperácia troch typov buniek floému: sítkovíc, sprievodných buniek a mliečnic7), čo je v neorganizovaných a dediferencovaných bunkových kultúrach nesplniteľná podmienka.
In vitro kultúry maku siateho produkujú alkaloid benzofenantridínového typu, sanguinarín. Schopnosť produkovať tento alkaloid majú aj in vitro kultúry, odvodené z iných rastlín čeľade Papaveraceae. K najznámejším účinkom sanguinarínu patria antimikróbny a protizápalový, pre ktoré sa používa v prípravkoch pre ústnu hygienu. Podrobný prehľad o biologických účinkoch sanguinarínu podáva článok Zdařilovej a spol.8). K opatrnosti s masovejším využitím sanguinarínu v terapii viedol predpoklad, že sanguinarín sa metabolizuje cez toxický benzo[c]akridín. Novšie experimenty však ukázali, že benzo[c]akridín nie je metabolitom sanguinarínu9). Preto sa dá očakávať, že prípadné riziká použitia sanguinarínu ako liečiva budú prehodnotené a postupne si sanguinarín nájde širšie uplatnenie v praxi. Požiadavku jeho prípravy vo veľkých množstvách môže splniť produkcia in vitro kultúrami rastlín.
Pokusná časť
Príprava a kultivácia suspenzných kultúr maku siateho (Papaver somniferum L., cv. Lazúr), slncovky kalifornskej (Eschscholtzia californica Cham.). lastovičníka väčšieho (Chelidonium majus L.) a makovca srdcovitého (Macleaya cordata Willd. R. Br.)
Kalusové kultúry sme odvodili zo stonkových častí vyklíčených klíčencov jednotlivých druhov čeľade Papaveraceae. Semená sme opláchli 70% etanolom a následne 15% roztokom prípravku Savo (po 20 min). Po viacnásobnom opláchnutí sterilizovanou redestilovanou vodou sme semená umiestnili na agarovú živnú pôdu podľa Murashigeho a Skooga (MS pôda)10). Po dosiahnutí primeranej veľkosti sme stonkovú časť klíčencov narezali na cca 5 mm rezky, ktoré sme použili na odvodenie kalusu. Tvorbu kalusov sme indukovali kultiváciou na MS pôde obohatenej o kinetín (0,3 mg . l-1) a kyselinu α-naftyloctovú (2,0 mg . l-1).
Suspenzné kultúry sme pripravili z kalusových kultúr, ktoré sme za aseptických podmienok preniesli do Ehrlenmayerovych baniek s 50 ml tekutej živnej MS pôdy s kinetínom a kyselinou α-naftyloctovou. Kultiváciu sme realizovali za stáleho trepania na rotačnej trepačke (150 kmitov . min-1), pri teplote 24–26 °C, relatívnej vlhkosti 75–80 % a difúznom osvetlení. Po 28-dňoch subkultivácie sme jednotlivé kultúry rozdelili do troch Ehrlenmayerovych baniek, objem doplnili do 50 ml tekutou živnou MS pôdou s kinetínom a kyselinou α-naftyloctovou a použili na elicitáciu.
Príprava fungálneho elicitora
Pri príprave elicitora sme vychádzali z metodiky McKinleya a spol.11). Mycélium Botrytis cinerea sme od živnej pôdy oddelili filtráciou na Büchnerovom lieviku. Po pridaní dvojnásobného množstva redestilovanej vody sme mycélium autoklávovali 20 min pri 100 kPa a 121 °C. Následne sme mycélium oddelili filtráciou a prepláchli redestilovanou vodou. Oddelené mycélium sme suspendovali v 1,5-násobku objemu 0,5 M roztoku NaCl a zhomogenizovali. Zmes sme prefiltrovali a tuhý podiel sme suspendovali v 3-násobnom objeme 2 M roztoku Tris/HCl (pH 7,5). Po opätovnej filtrácii sme mycélium premyli vodou, suspendovali v 5-násobnom objeme zmesi chloroform : metanol (1 : 1), znovu filtrovali a resuspendovali v 5-násonom objeme hexánu. Po prefiltrovaní sme tuhú zložku premyli 5-násobným objemom acetónu a rozotreli na jemný prášok. Ten sme suspendovali v 3-násobnom objeme redestilovanej vody a dialyzovali oproti 0,5 M kyseline octovej (16 h). Pokračovali sme dialýzou oproti redestilovanej vode. Po dialýze sme mycélium prefiltrovali a nechali vyschnúť. Vysušený materiál sme preniesli do 250 ml varnej banky a zlyofilizovali.
Na 1 g lyofilizovaného mycélia sme pridali 100 ml 2 M kyseliny trifluóroctovej a inkubovali vo vodnom kúpeli 2,5 h pri 90 °C za občasného miešania. Po hydrolýze sme mycélium prefiltrovali a filtrát sme zahustili na vákuovej odparovačke pri 40 °C na objem 10–15 ml a upravili pH pomocou 1 M KOH na 7,0. Vo vzorke sme stanovili tzv. glukózový ekvivalent metódou podľa Duboisa a spol.12).
Elicitácia suspenzných kultúr
Na elicitáciu sme použili suspenzné kultúry maku siateho v 7., 14., 21. a 28. dni subkultivácie. Kultúry ostatných rastlín sme elicitovali v 7. a 14. dni subkultivácie. Na elicitáciu sme použili 1 ml fungálneho elicitora s glukózovým ekvivalentom 24 μg . ml-1. Vzorky na stanovenie sanguinarínu sme odoberali v časoch 0, 24, 48 a 72 h od pridania elicitora.
Stanovenie obsahu sanguinarínu
Sanguinarín sme zo vzoriek suspenzných kultúr izolovali a identifikovali postupom podľa Bilkovej a spol.13). Kvantitatívne stanovenie sanguinarínu spektrofluorimetrickou metódou sme uskutočnili podľa Balažovej a spol.14). Množstvo vyprodukovaného sanguinarínu sme prepočítali na 1 g čerstvej hmoty, resp. sanguinarín uvoľnený do prostredia sme vztiahli na 1 ml živnej pôdy.
Výsledky a diskusia
Produkciu sanguinarínu v suspenzných kultúrach maku siateho (cv. Lazúr) sme sledovali v priebehu 28 - -dňovej subkultivácie. Z neovplyvnených kultúr sme najvyššie množstvá sanguinarínu vyizolovali zo 14-dňových kultúr (obr. 1). Tieto množstvá predstavujú viac ako trojnásobok v porovnaní so 7-dňovými kultúrami. Vo vzorkách z 21. dňa je už naznačený pokles produkcie sanguinarínu, ktorý je výrazný v 28. dni subkultivácie. V tomto dni sme zaznamenali aj zvýšené množstvo sanguinarínu, uvoľneného do živnej pôdy (obr. 2). Zvýšená prítomnosť sanguinarínu v živnom roztoku naznačuje zmeny v permeabilite membrán, čo znamená, že sa končí stacionárna fáza rastu kultúr a bunky začínajú odumierať. Z uvedených výsledkov vyplýva, že z hľadiska produkcie sanguinarínu sú in vitro kultúry maku v najlepšej kondícii okolo 14. dňa subkultivácie a tieto kultúry aj najlepšie zareagovali na elicitáciu. Z hľadiska dĺžky pôsobenia elicitora sme maximálnu produkciu zaznamenali po 48 h.
Obr. 1. Obsah sanguinarínu v čerstvej hmote suspenzných kultúr maku siateho v časoch 0, 24, 48 a 72 h po pridaní elicitora. Kultúry boli elicitované v 7., 14., 21. a 28. dni subkultivácie (hodnoty sú priemery ± štandardné odchýlky z piatich paralelných vzoriek). 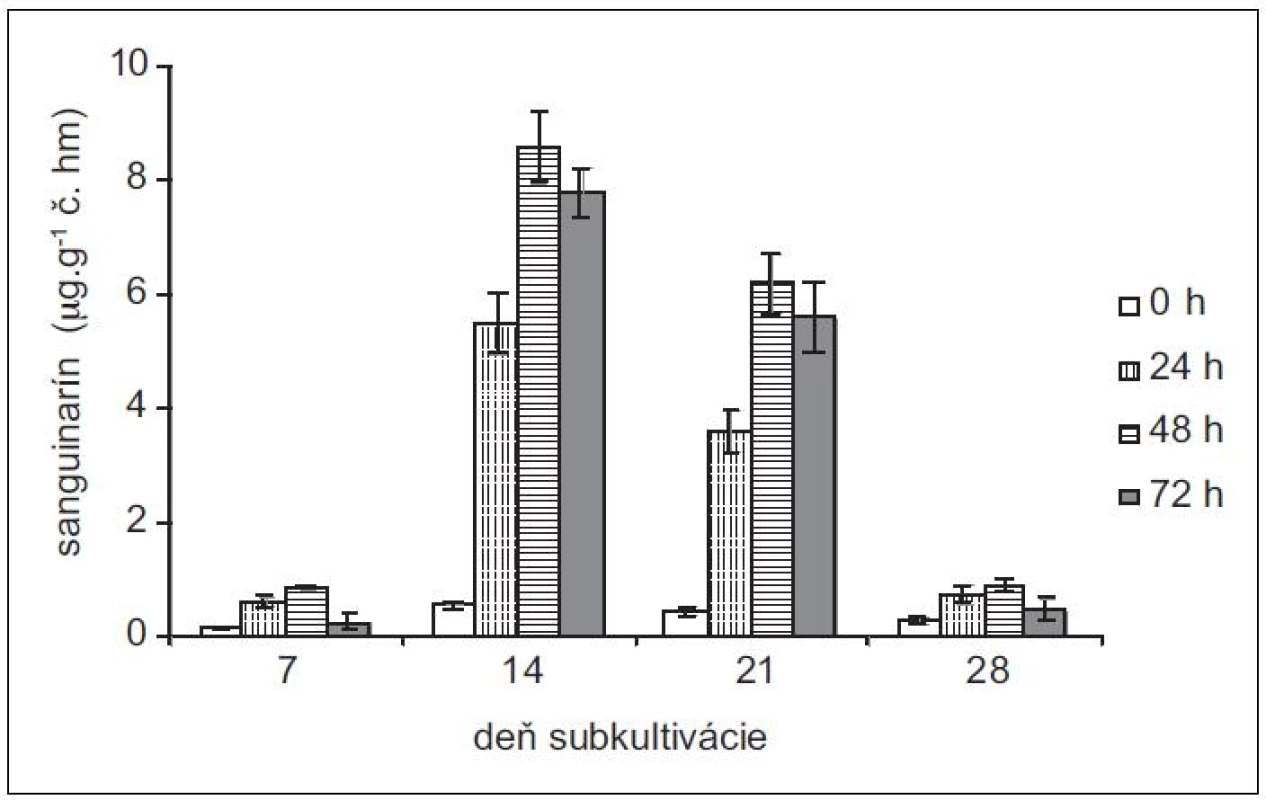
Obr. 2. Obsah sanguinarínu, uvoľneného suspenznými kultúrami maku siateho do živnej pôdy v časoch 0, 24, 48 a 72 h po pridaní elicitora. Kultúry boli elicitované v 7., 14., 21. a 28. dni subkultivácie (hodnoty sú priemery ± štandardné odchýlky z piatich paralelných vzoriek). 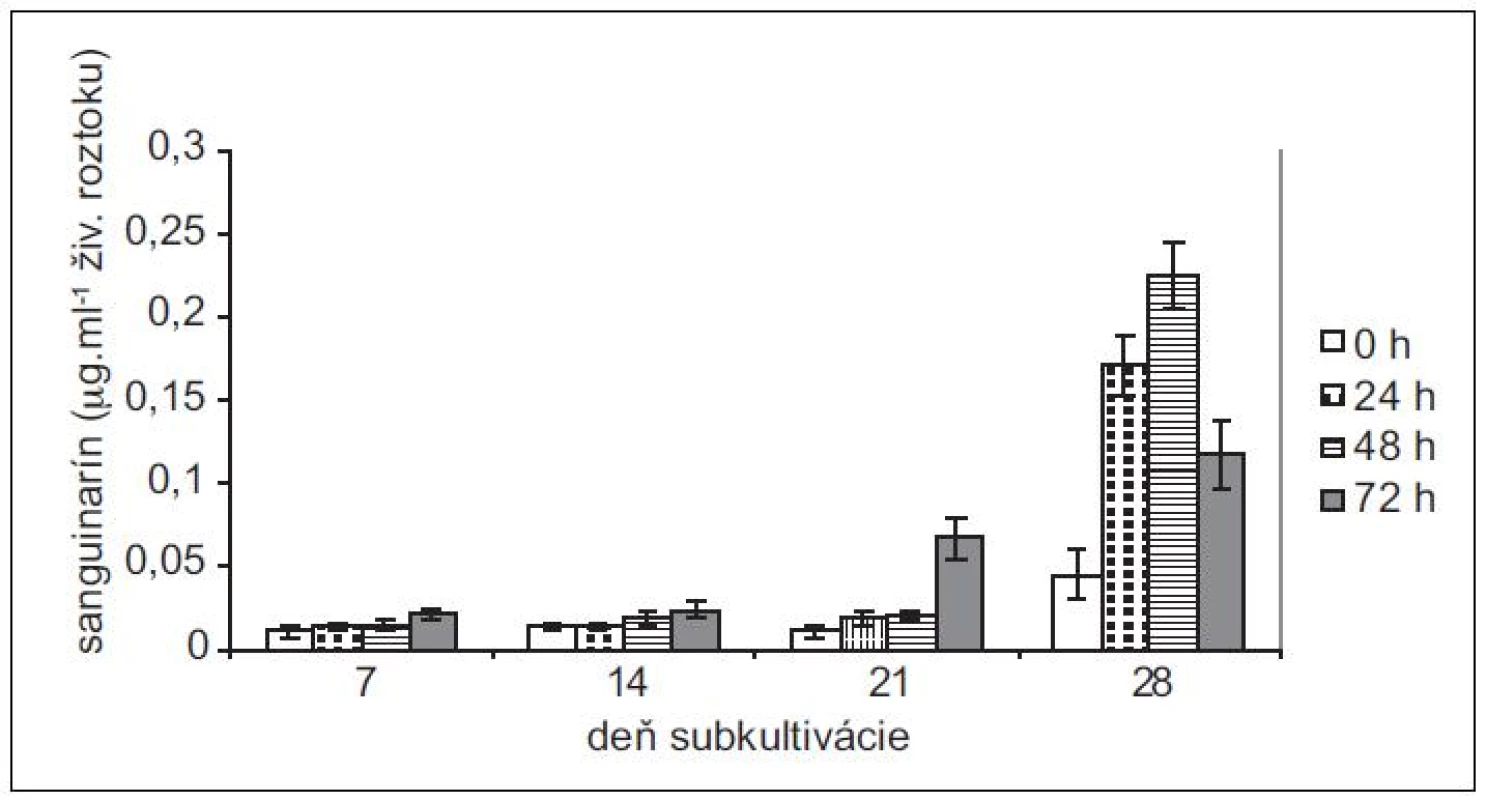
Pretože rastové charakteristiky (potreba pasážovania po cca 28 dňoch) ostatných troch použitých in vitro kultúr sú podobné kultúram maku siateho, použili sme na elicitácie iba 14 - a 21-dňové kultúry slncovky kalifornskej, lastovičníka väčšieho a makovca srdcovitého. Produkčné schopnosti kultúr lastovičníka väčšieho a slncovky kalifornskej sú navzájom podobné, podobný je u nich aj nárast v produkcii sanguinarínu po pridaní elicitora (obr. 3 a 4). Produkcia sanguinarínu kultúrou makovca srdcovitého (obr. 5) je v porovnaní s makom siatym vyššia. Naopak, kultúry slncovky a lastovičníka sú v porovnaní s makovcom lepší producenti. Rozdiel je výrazný predovšetkým pri porovnaní elicitovaných kultúr, kedy 14-dňové kultúry lastovičníka a slncovky po 48 h vyprodukovali takmer 2,5-krát viac sanguinarínu ako kultúry makovca. Všetky štyri kultúry reagujú na elicitáciu lepšie v 14. dni subkultivácie a s výnimkou lastovičníka je optimálnou dobou pôsobenia 48 h. V prípade lastovičníka sa zdá, že medzi 48. a 72. h ešte pokračuje zvýšená produkcia sanguinarínu, avšak po porovnaní hodnôt nepárovým Studentovym t-testom sa nárast ukázal ako nesignifikantný.
Obr. 3. Obsah sanguinarínu v čerstvej hmote suspenzných kultúr slncovky kalifornskej v časoch 0, 24, 48 a 72 h po pridaní elicitora. Kultúry boli elicitované v 14. a 21. dni subkultivácie (hodnoty sú priemery ± štandardné odchýlky z piatich paralelných vzoriek). 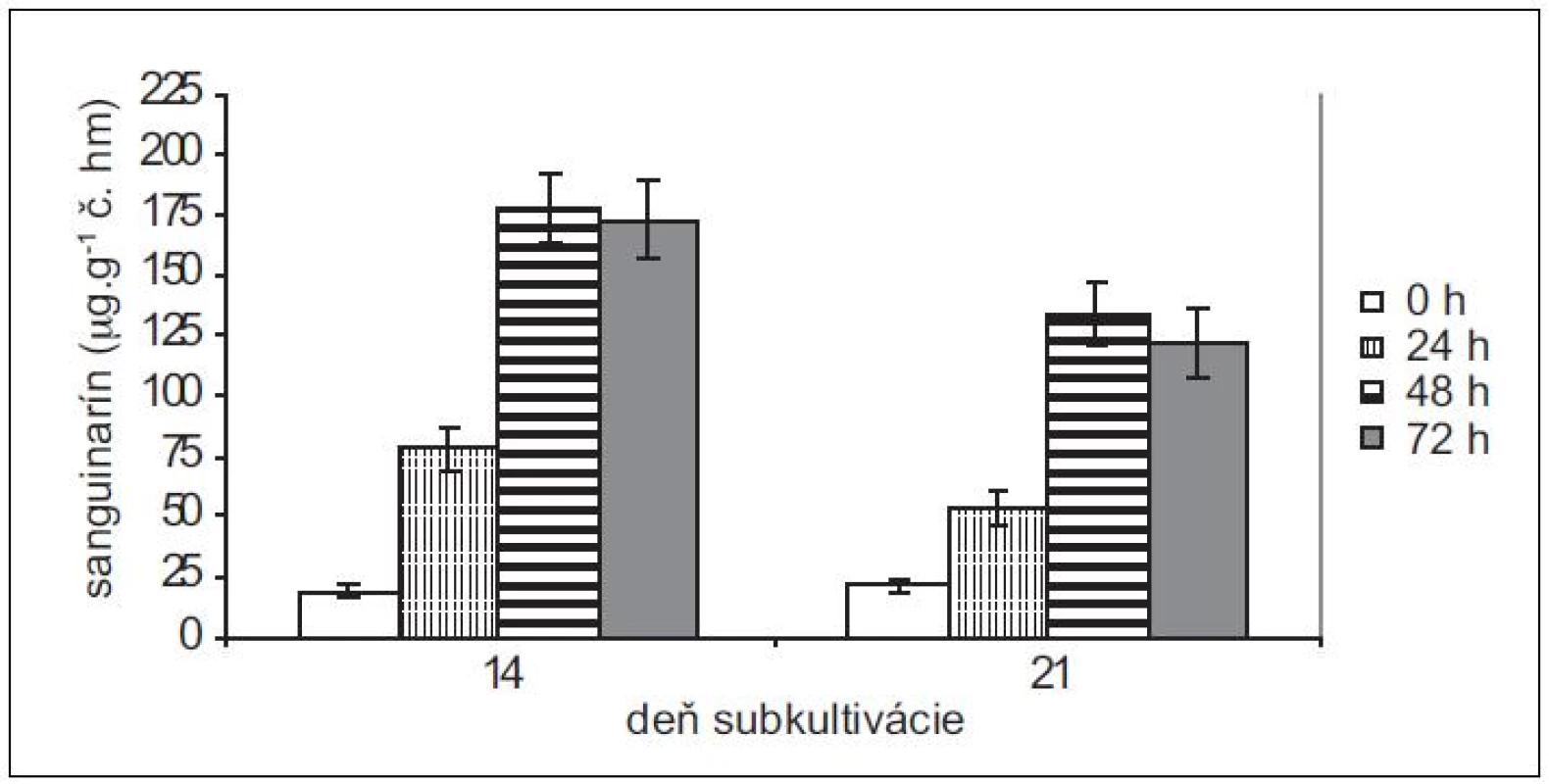
Obr. 4. Obsah sanguinarínu v čerstvej hmote suspenzných kultúr lastovičníka väčšieho v časoch 0, 24, 48 a 72 h po pridaní elicitora. Kultúry boli elicitované v 14. a 21. dni subkultivácie (hodnoty sú priemery ± štandardné odchýlky z piatich paralelných vzoriek). 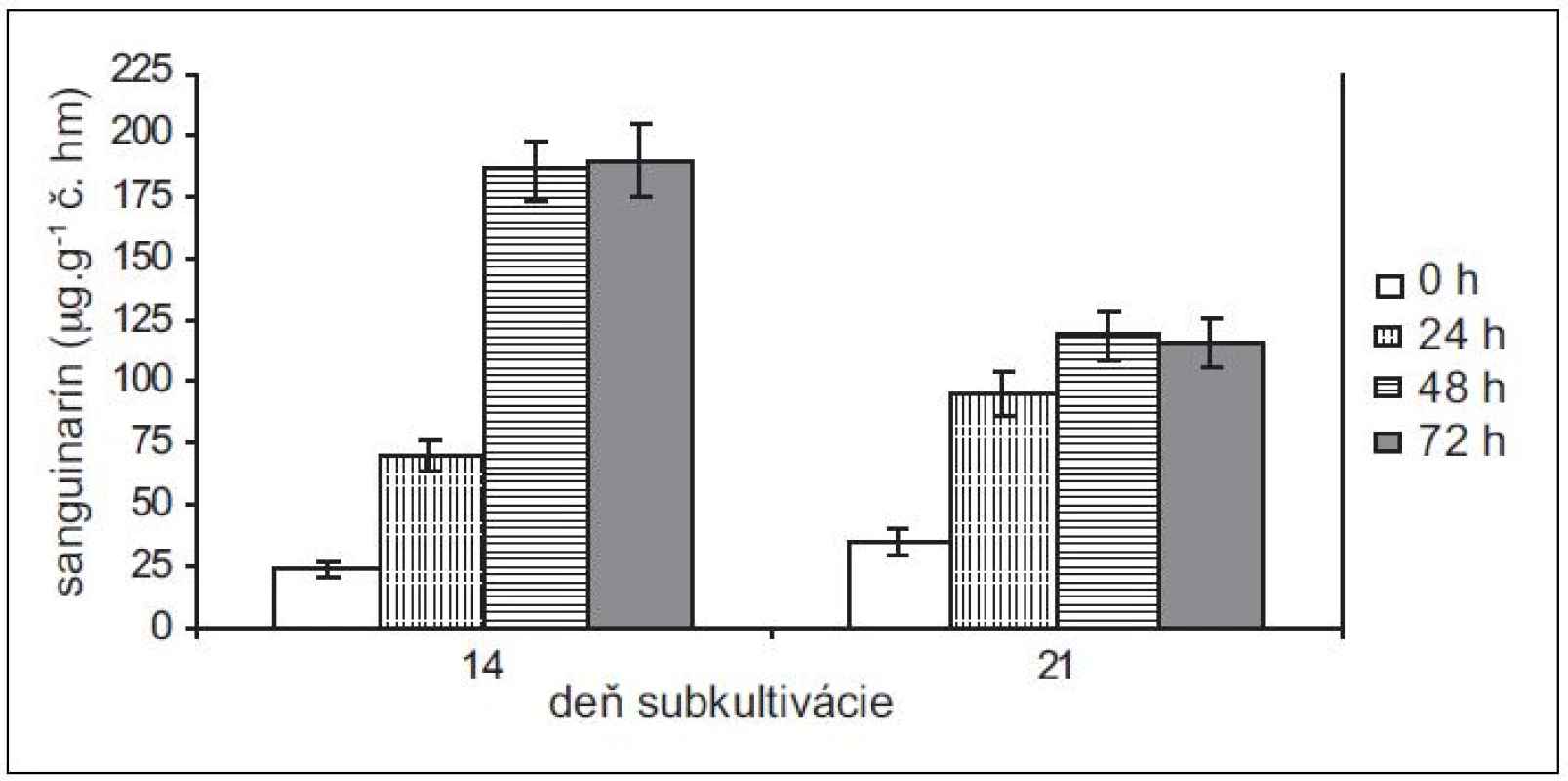
Obr. 5. Obsah sanguinarínu v čerstvej hmote suspenzných kultúr makovca srdcovitého v časoch 0, 24, 48 a 72 h po pridaní elicitora. Kultúry boli elicitované v 14. a 21. dni subkultivácie (hodnoty sú priemery ± štandardné odchýlky z piatich paralelných vzoriek). 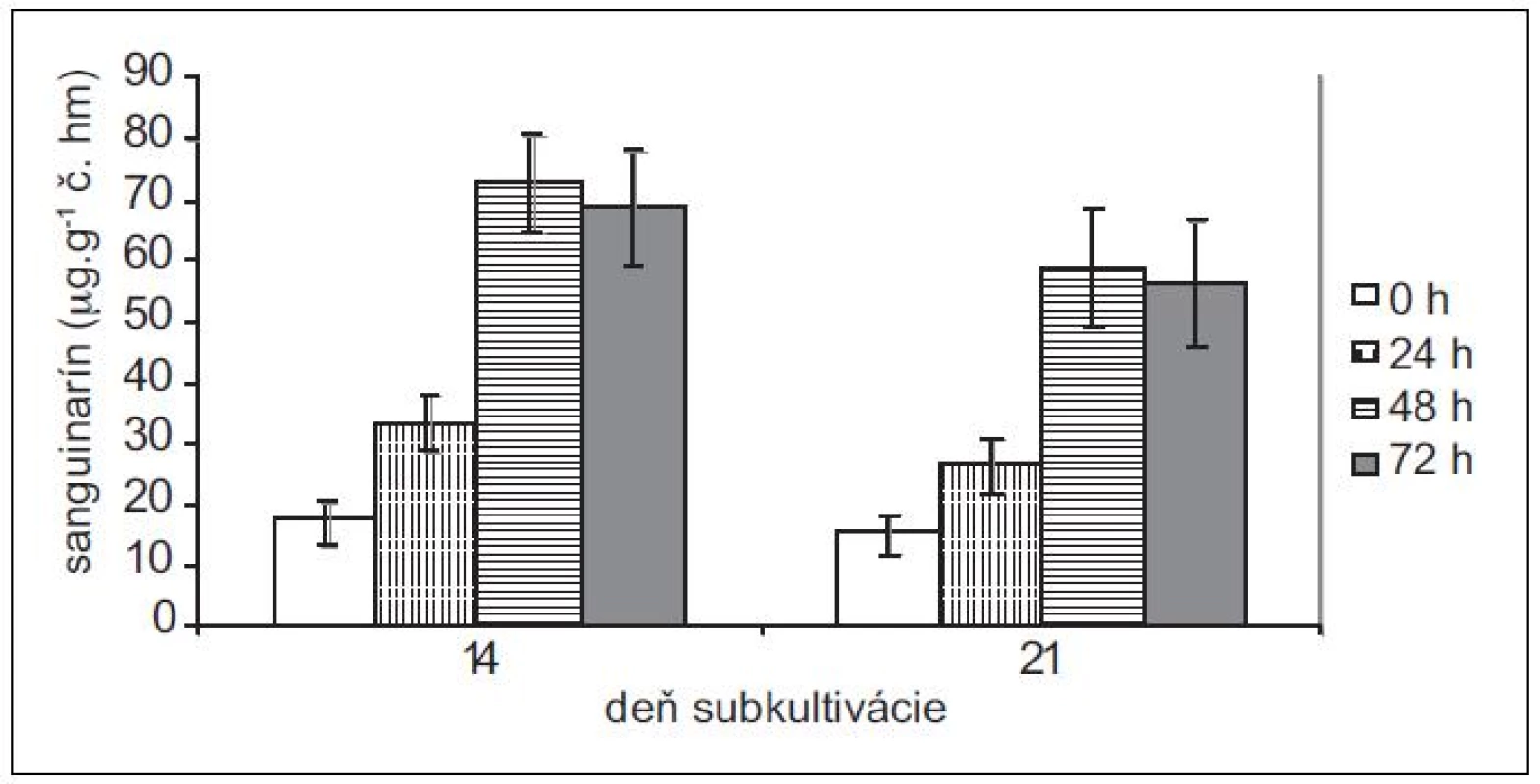
K najvýraznejšiemu nárastu v produkcii sanguinarínu po elicitácii v porovnaní s neovplyvnenými kultúrami došlo v 14-dňových kultúrach maku siateho – z priemerných 0,55 μg . g-1 čerstvej hmoty v čase 0 na 8,6 μg . g-1 v čase 48 h. Jedná sa o vyše 15-násobný nárast. V našich predošlých prácach13, 15) sme testovali vplyv abiotických stresorov na kultúry maku siateho. Pôsobením metyljazmonátu došlo k približne štvornásobnému a pôsobením síranu meďnatého sedemnásobnému zvýšeniu produkcie sanguinarínu. Z porovnania abiotických stresorov a elicitácie hydrolyzátom z Botrytis cinereae vychádza biotický elicitor ako efektívnejší stimulátor produkcie sanguinarínu. Zaujímavé je aj porovnanie produkčných schopností kultúry maku siateho cv. Lazúr s kultúrami iných kultivarov. Produkcia sanguinarínu v kultúrach odrody MS-20 je porovnateľná s odrodou Lazúr ako v kontrolných, tak aj elicitovaných vzorkách14). Avšak kultúry odrody Gerlach bez pôsobenia stresora produkujú v exponenciálnej fáze rastu sanguinarín v rozsahu 5–7 μg . g-1 č. hm. a po elicitácii sa tvorba zvyšuje na cca 38,0 ± 2,5 μg . g-1 č. hm.16). Kultivar Gerlach patrí medzi nízkomorfínové odrody maku17) a výrazne vyššia produkcia sanguinarínu v porovnaní s Lazúrom (vysokomorfínová odroda) naznačuje, že enzýmová výbava cv. Gerlach je prispôsobená vyššej tvorbe benzofenantridínov na úkor morfínanov.
Napriek tomu, že kultúry maku siateho po elicitácii produkovali výrazne vyššie množstvá sanguinarínu, produkcia nedosiahla hodnoty, ktoré ostatné testované kultúry vykazujú aj bez pôsobenia elicitora. Z hľadiska perspektívy výroby a izolácie sanguinarínu sa ukazujú ako vhodnejšie in vitro kultúry slncovky kalifornskej a lastovičníka väčšieho. Je zaujímavé, že kým mak siaty a slncovka kalifornská sú pomerne častými objektami výskumov a dá sa konštatovať, že kompletná enzymológia tvorby benzylizochinolínových alkaloidov (ako morfínanov, tak i benzofenantridínov včítane sanguinarínu) bola preštudovaná na týchto dvoch rastlinách18, 19), lastovičník väčší stojí mimo záujmu enzymológov a rastlinných biotechnológov. Lastovičník väčší bol zatiaľ použitý iba pri štúdiu polyfenoloxidázy20), aminopeptidáz21) a dipeptidylpeptidázy 22). Podobne zatiaľ nie sú dostupné žiadne údaje o odvodení in vitro kultúr makovca srdcovitého a ich využití pri štúdiu biosyntézy benzylizochinolínových alkaloidov.
Stret záujmov: žiadny.
Došlo 25. října 2012 / Přijato 17. listopadu 2012
František Bilka, Andrea Balažová, Andrea Bilková, Ivana Holková
Adresa pro korespondenci:
RNDr. František Bilka, PhD.
Univerzita Komenského v Bratislave, Farmaceutická fakulta,
Katedra bunkovej a molekulárnej biológie liečiv
Kalinčiakova 8, 832 32 Bratislava, Slovenská republika
e-mail: bilka@fpharm.uniba.sk
Zdroje
1. Sikyta B., Dušek J. Biotechnologie pro farmaceuty. 3. vyd. Praha: Univerzita Karlova – Nakladatelství Karolinum 2001; 125 s.
2. Tůmová L., Polívková D. Vliv AgNO3 na produkci flavonoidů kulturou Ononis arvensis L. in vitro. Čes. slov. Farm. 2006; 55, 186–188.
3. Siatka T., Kašparová M. Effects of aluminium chloride on cell growth and production of coumarins in cell suspension cultures of Angelica archangelica L. Čes. slov. Farm. 2010; 59, 112–116.
4. Hodges R., Rapoport H. Morphinane alkaloids in callus cultures of Papaver somniferum. J. Nat. Prod. 1982; 45, 481–485.
5. Facchini P. J., Bird D. A. Developmental regulation of benzylisoquinoline alkaloid biosynthesis in opium poppy plants and tissue cultures. In Vitro Cell. Dev. Biol. – Plant 1998; 34, 69–79.
6. De-Eknamkul W., Zenk M. H. Purification and properties of 1,2-dehydroreticuline reductase from Papaver somniferum seedlings. Phytochemistry 1992; 31, 813–821.
7. Facchini P. J., Hagel J. M., Liscombe D. K., Loukanina N., MacLeod B. P., Samanani N., Zulak K. G. Opium poppy: blueprint for an alkaloid factory. Phytochem. Rev. 2007; 6, 97–124.
8. Zdařilová A., Malíková J., Dvořák Z., Ulrichová J., Šimánek V. Kvartérní isochinolinové alkaloidy sanguinarin a chelerytrin. Účinky in vitro a in vivo. Chem. Listy 2006; 100, 30–41.
9. Dvořák Z., Šimánek V. Metabolism of sanguinarine: The facts and the myths. Current Drug Metabolism 2007; 8, 173–176.
10. Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plantarum 1962; 15, 473–497.
11. Mc Kinley T. C., Michaelis P. J., Flores H. E. Is lipoxygenase involved in polyacetylene biosynthesis in Asteraceae? Plant Physiol. Biochem. 1993; 31, 835–843.
12. Dubois M., Gilles K. A., Hamilton J. K., Rebers P. A., Smith F. Colorimetric method for determination of sugars and related substances. Anal. Chem. 1956; 28, 350–356.
13. Bilková A., Bilka F., Blanáriková V., Bezáková L. Effect of excess of cupric sulfate on sanguinarine formation and activities of amine oxidase and polyphenol oxidase in cell suspension cultures of Papaver somniferum. Biologia 2005; 60, 661–664.
14. Balažová A., Bilka F., Blanáriková V., Pšenák M. Zmeny obsahu sanguinarínu a aktivity polyfenoloxidázy vplyvom fungálneho elicitora v suspenzných kultúrach maku siateho Papaver somniferum L. Čes. slov. Farm. 2002; 51, 182–185.
15. Holková I., Bezáková L., Bilka F., Balažová A., Vanko M., Blanáriková V. Involvement of lipoxygenase in elicitor-stimulated sanguinarine accumulation in Papaver somniferum suspension cultures. Plant Physiol. Biochem. 2010; 48, 887–892.
16. Balažová A., Blanáriková V., Bilka F., Bilková A., Kiňová Sepová H. Efekt troch rôznych elicitorov na produkciu sanguinarínu suspenznými kultúrami nízko-morfínovej odrody maku siateho (Papaver somniferum L.). Čes. slov. Farm. 2011; 60, 237–240.
17. Ondrejčák F. Slovenské odrody maku siateho. http://www. makovepole.sk/index.php/mak-siaty/slovenske-odrody-maku-siateho (18. 10. 2012).
18. Desgagné-Penix I., Facchini P. J. Benzylisoquinoline alkaloid biosynthesis. In: Ashihara H., Crozier A., Komamine A. eds. Plant Metabolism and Biotechnology, 1st ed. Chichester (UK): John Wiley and Sons, Ltd., 2011.
19. Angelova S., Buchheim M., Frowitter D., Schierhorn A., Roos W. Overproduction of alkaloid phytoalexins in california poppy cells is associated with the co-expression of biosynthetic and stress-protective enzymes. Molecular Plant 2010; 3, 927–939.
20. Bilka F., Vanko M., Balažová A., Bilková A., Holková I. Charakterizácia polyfenoloxidázy z latexu lastovičníka väčšieho (Chelidonium majus L.). Čes. slov. Farm. 2007; 56, 90–94.
21. Koreňová M., Stano J., Mičieta K., Barth A., Nemec P., Blanáriková V. Štúdium imobilizovanej a extracelulárnej dipeptidylpeptidázy IV Chelidonium majus. Chem. Listy 2012; 106, 847–850.
22. Stano J., Mičieta K., Koreňová M., Blanáriková V. Štúdium vybraných extracelulárnych a imobilizovaných aminopeptidáz lastovičníka. Chem. Listy 2007; 101, 65–69.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2012 Číslo 6- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
-
Všechny články tohoto čísla
- Halloysit – zajímavý nanotubulární nosič pro léčiva
- Vliv zinečnatých a kademnatých iontů na růst a produkci kumarinů v suspenzní kultuře Angelica archangelica L.
- Porovnanie produkcie sanguinarínu suspenznými kultúrami rastlín čeľade Papaveraceae
- Hodnocení obsahové stejnoměrnosti tablet s nízkým obsahem léčivé látky s úzkým terapeutickým indexem
- Analýza farmaceutické péče při dispenzaci léčiva orlistat v režimu OTC
- Fenylsalicyláty – nová skupina potenciálních antituberkulotik
-
Štúdium lokálnych anestetík – časť 200*
Výber optimálneho typu chitosanu pre formuláciu lokálnych anestetík karbamátového typu do hydrogélov - FIP oslavila 100. výročí
-
TEACHING COMMUNICATION SKILLS IN PHARMACY PRACTISE
TO KNOW AND TO DO ARE TWO DIFFERENT THINGS -
PATIENT COUNSELING IN PHARMACY PRACTICE
OPTIMIZATION OF DRUG THERAPY - The Czech Pharmaceutical Society 1871 - 2012
- Za doc. DrPh. PhMr. Jozefom Hegerom
- Príručka vybratých pojmov v analytickej chémii
- POKYNY PRO AUTORY ČASOPISU ČESKÁ A SLOVENSKÁ FARMACIE
- AUTORSKÝ REJSTŘÍK
- Věcný rejstřík
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hodnocení obsahové stejnoměrnosti tablet s nízkým obsahem léčivé látky s úzkým terapeutickým indexem
- Analýza farmaceutické péče při dispenzaci léčiva orlistat v režimu OTC
- Za doc. DrPh. PhMr. Jozefom Hegerom
- Halloysit – zajímavý nanotubulární nosič pro léčiva
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Současné možnosti léčby obezity
nový kurzAutoři: MUDr. Martin Hrubý
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



