-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVplyv pomocných látok na permeáciu kofeínu z gélov
Influence of excipients on caffeine permeation from gels
The subject of this paper is a study of the influence of excipients on caffeine permeation from dermal semisolids drugs. Due to its advantageous properties, caffeine can be successfully used in dermal hydrogels. The choice of excipients from the group of humectants and cationic surfactants also plays an important role. The excipients should ensure long-term stability of hydrogels and the best permeation of the drug from gels. In particular, the influence of various excipients on caffeine permeation from gels and at the same time their influence on rheological properties of hydrogels were investigated. Based on the obtained results, the following optimal composition of caffeine gel was determined: 2.5 % chitosan + 0.1 % caffeine + 10 % propylenglycol + 0.1 % benzyldimethylhexadecylammonium chloride.
Keywords:
caffeine • hydrogels • permeation • rheological parameters
Autoři: Alexandra Kodadová; Zuzana Vitková; Petra Herdová; Jozef Čižmárik; Monika Zsidová
Působiště autorů: Farmaceutická fakulta UK Bratislava ; Katedra galenickej farmácie
Vyšlo v časopise: Čes. slov. Farm., 2014; 63, 267-271
Kategorie: Původní práce
Souhrn
V práci sa študuje vplyv pomocných látok na permeáciu kofeínu z dermálnych polotuhých liekov v in vitro podmienkach. Vďaka výhodným vlastnostiam nachádza kofeín využitie v dermálnych hydrogéloch. Dôležitý je tiež výber pomocných látok zo skupiny humektantov a katiónových tenzidov. Ich cieľom je zabezpečiť dlhodobú stabilitu hydrogélov a čo najlepšiu permeáciu použitého liečiva z gélov. Predmetom výskumu je štúdium vplyvov rôznych pomocných látok na permeáciu kofeínu z gélov a taktiež ich vplyv na reologické vlastnosti hydrogélov. Na základe získaných výsledkov sa určilo nasledovné optimálne zloženie pre kofeínový gél: 2,5% chitosan + 0,1% kofeín + 10% propylénglykol + 0,1% benzyldimetylhexadecylamóniumchlorid.
Kľúčové slová:
kofeín • hydrogély • permeácia • reologické parametreÚvod
Kofeín sa v kozmetickom priemysle stále častejšie využíva ako významná biologicky aktívna látka. Využitie nachádza ako anticelulitídové kozmetikum. Vďaka blokáde α-adrenergného receptoru a inhibícii fosfodiesterázy stimuluje lipolýzu, a teda bráni kumulácii nadbytočného tuku v adipocytoch1).
Je známe, že UV lúče účinkujú nepriaznivo na kožu, v extrémnych prípadoch môžu spôsobiť až rakovinu kože. UV žiarenie tiež vedie k vzniku voľných radikálov. Pridávaním kofeínu do opaľovacích prípravkov môže kofeín pôsobiť ako účinná prevencia pred UV-indukovanou rakovinou kože a ako účinný vychytávač voľných radikálov2).
Prostredníctvom lokálnej aplikácie kofeínu sa predpokladá takisto stimulačný účinok na rast vlasov. Prospešné účinky u pacientov s androgénnou alopéciou dosahuje kofeín vďaka blokáde α-reduktázy, ktorá spôsobuje degradáciu testosterónu na dihydrotestosterón (DHT). Tým bráni nadmernému hromadeniu DHT a oslabovaniu vlasových cibuliek. Inhibíciou aktivity tohto enzýmu sa umožňuje obnovenie rastu vlasov3, 4).
Vlastnosti kofeínu je vhodné uplatniť v dermálnych polotuhých liekoch – hydrogéloch. Hydrogély pozostávajú z polymérnych, navzájom zosieťovaných, reťazcov. Prírodné polyméry vykazujú lepšie vlastnosti ako syntetické polyméry – nízku alebo žiadnu toxicitu, biokompatibilitu či biodegradovateľnosť5). Chitosan je semisynetický katiónový polymér získavaný čiastočnou deacetyláciou prírodného polysacharidu chitínu6). Mnohými štúdiami boli dokázané pozitívne účinky chitosanu. Potvrdená bola antimikrobiálna aktivita7) chitosanu proti rôznym druhom grampozitívnych i negatívnych baktérií a tiež proti hubám, antinádorová aktivita8) či antioxidačná aktivita9). Chitosan ako súčasť hydrogélov pôsobí ako účinný a nedráždivý urýchlovač permeácie liečiva cez pokožku alebo sliznice. Spôsobuje reverzibilné zvýšenie priepustnosti medzibunkových kožných priestorov10). Chitosanové hydrogély sa pripravujú o rozličnej koncentrácii chitosanu11–14). Hydrogély majú stále v oblasti farmácie významné postavenie. Nenáročná aplikácia, príjemný pocit na koži, chladivý účinok vedú pacienta k dobrej kompliancii. Ľahkým zmytím gélu vodou je možné rýchlo prerušiť prívod liečiva do kože. Keďže ide o lokálne podanie, pravdepodobnosť predávkovania je takmer nulová.
Cieľom tejto štúdie bolo určiť vhodné pomocné látky v hydrogéli s obsahom kofeínu a sledovať stálosť pripravených gélov na základe ich reologických vlastností.
Pokusná časť
Použité chemikálie
Kofeín (coffeinum, SL1) – liečivo – Sanitas, Praha, Česká republika; chitosan (chitosanum) praktický stupeň získaný z kreviet – gélotvorná látka – stupeň deacetylácie ≥ 75 % – Sigma-Aldrich, pobočka Bratislava, Slovenská republika; propylénglykol (propylenglycolum, SL1) – humektant – Interpahrm Slovakia a.s., Bratislava, Slovenská republika; glycerol (glycerolum, SL1) – humektant – Interpahrm Slovakia a.s., Bratislava, Slovenská republika; benzyldimetylhexadecylamóniumchlorid – katiónový tenzid – Sigma-Aldrich, pobočka Bratislava, Slovenská republika; benzetóniumchlorid (benzethonii chloridum, SL1) – katiónový tenzid – Sigma-Aldrich, pobočka Bratislava, Slovenská republika; kyselina mliečna (acidum lacticum, SL1) – Interpharm Slovakia a.s., Bratislava, Slovenský republika; čistená voda (aqua purificata, SL1) – FaF UK, Bratislava, Slovenská republika.
Použité prístroje
Pri permeačnom experimente boli použité: analytické váhy Mettler Toledo (Greinfensee, Švajčiarsko), permeačná aparatúra zostavená na Katedre galenickej farmácie, FaF UK, Bratislava, Slovenská republika). Celofán (EKOZ, Nitra, Slovenská republika) slúžil ako permeačná membrána. Na stanovenie uvoľneného kofeínu bol použitý spektrofotometer (Phylips Pyll UNICAM 8625 Ltd., Cambridge, Veľká Británia). Reologické hodnotenia sa uskutočnili pomocou rotačného viskozimetra Viscotester VT500 (Haake Mess-Technik, Karlsruhe, Nemecko). Thermostat U10 (Prüfgeräte-Werk Medingen, Dresden, Nemecko), ktorý poskytoval konštantnú teplotu počas celého experimentu, bol použitý aj pri liberačnom aj reologickom experimente.
Zloženie a príprava vzoriek
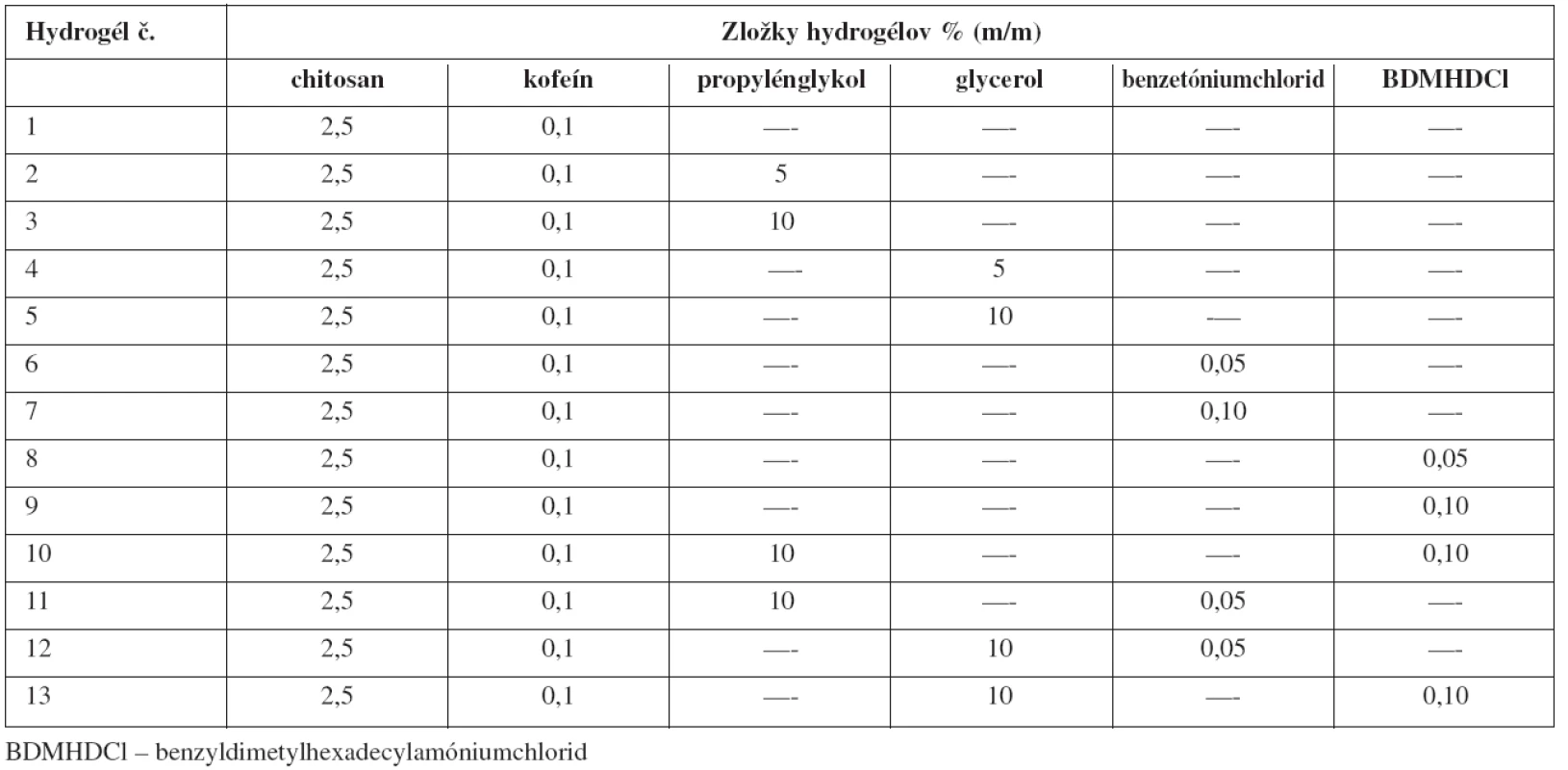
Hydrogély (100 g) boli pripravené v dvoch paralelných vzorkách zo zložením uvedeným v tabuľke 1. Ku každej vzorke sa zároveň pripravil aj blank – porovnávací gél bez obsahu liečiva (postup prípravy rovnaký). Pre vznik gélového charakteru bolo potrebné chitosan neutralizovať slabou kyselinou. Za týmto účelom sa použil 1% roztok kyseliny mliečnej.
Pri príprave základnej vzorky (bez obsahu študovaných pomocných látok) sa do vytárovanej kadičky presne navážilo požadované množstvo chitosanu a kofeínu. Následne sa pridalo také množstvo 1% roztoku kyseliny mliečnej (do 100 g), aby sa dosiahlo vhodné pH pre aplikáciu na kožu (pH 5,5–6,0). Zmes sa pomaly miešala, až dokým nedošlo k rozpusteniu a napučaniu všetkých zložiek, a nevznikol tak homogénny gél. Rovnakým postupom sa pripravilo celkom 13 rôznych vzoriek, ktoré sa navzájom líšili obsahom pomocných látok z radu humektantov a katiónových tenzidov. Vzorky boli pripravované pri laboratórnej teplote t = 25 °C ± 0,2 °C. Po príprave sa všetky hydrogély uskladnili pri teplote t = 5 °C po dobu minimálne 48 hodín.
Permeácia kofeínu z hydrogélov
Permeačnú aparatúru tvorí séria ôsmich za sebou idúcich sklenených komôrok navzájom spojených plastovými hadičkami. Komôrka pozostáva z donorovej a akceptorovej časti oddelených semipermeabilnou membránou, ktorú v in vitro podmienkach predstavuje celofán. Na akceptorovej strane je umiestnené magnetické miešadlo, ktoré sa otáča okolo vlastnej osi. Vonkajšiu čast komôrky tvorí výhrevný plášť, ku ktorému priliehajú otáčajúce sa magnety. Súčasne sa otáčajú aj magnetické miešadlá vo vnútri komôrok, a tým premiešavajú ich obsah. Počas celého experimentu sa udržovala konštantná teplota 30 °C ± 0,2 °C, ktorú zabezpečoval termostat napojený na permeačnú aparatúru.
Na membránu sa navážili 3,0 g vzorky a vložili sa do donorovej časti komôrky. Do akceptorovej sa pridávalo 20 ml fyziologického roztoku. Po stanovených časových intervaloch – 15, 30, 45, 60, 90, 120 a 180 minút sa z každej komôrky odoberali 2 ml vzorky. Odobratý objem sa vždy nahradil rovnakým množstvom fyziologického roztoku z dôvodu zachovania pôvodného objemu. Uvoľnené množstvo liečiva sa stanovilo spektrofotometricky pri λ = 274 nm. Hodnotilo sa vždy šesť paralelných vzoriek (dve komôrky boli blank).
Stanovenie reologických vlastností pripravených vzoriek
Stanovenie reologických parametrov sa realizovalo na rotačnom viskozimetri. Zaznamenávali sa hodnoty točivého momentu, z ktorého sa vypočítali základné reologické parametre. Merania sa uskutočnili na 3. deň od prípravy, po 2 týždňoch a 1. a 2. mesiaci od prípravy vzoriek.
Výsledky a diskusia
Prvou etapou experimentu bolo študovanie vplyvu pomocných látok zo skupiny humektantov a katiónových tenzidov na permeáciu kofeínu z pripravených hydrogélov. Humektanty sú pomocné látky s hygroskopickými vlastnosťami, preto sú nevyhnutnou zložkou hydrogélov. Zabraňujú nadmerným stratám vody zo systému, a tým zabraňujú aj znehodnoteniu gélu. V experimente boli použité dve koncentrácie (5 % a 10 %) dvoch humektantov (glycerol a propylénglykol), ktoré sa osvedčili v predchádzajúcich štúdiách15–17).
Graf 1 porovnáva množstvo permeovaného kofeínu zo základnej vzorky (vzorka 1) cez semipermeabilnú membránu do fyziologického roztoku so vzorkami s obsahom študovaných humektantov (vzorky 2 až 5). Ide o závislosť množstva permeovaného množstva liečiva za jednotku času. Z grafu vyplýva, že pomocné látky pozitívne ovplyvnili permeáciu kofeínu, keďže zo všetkých vzoriek sa uvoľnilo viac kofeínu ako zo základnej vzorky. Z hydrogélu 1 sa po 180 minútach uvoľnilo 70,55 % kofeínu. Signifikantné zvýšenie uvoľňovania kofeínu spôsobil hlavne 10 % glycerol (87,21 %).
Graf 1. Vplyv humektantov na permeáciu kofeínu 
PGLY – propylénglykol, GLY – glycerol Koncentrácia kofeínu 0,1 % sa zvolila na základe prechádzajúcich štúdii18, 19). V ďalších štúdiách sa však predpokladá zvyšovanie koncentrácie kofeínu.
Pre vysoký obsah vody v hydrogéloch je potrebné ich stabilizovať antimikrobiálnou látkou. Za týmto účelom sa vybrali dva katiónové tenzidy (benzetóniumchlorid a benzyldimetylhexadecylamóniumchlorid) o dvoch rôznych koncentráciách (0,05 % a 0,1%), osvedčené v predchádzajúcich štúdiách12, 14, 15). Okrem antimikrobiálnej aktivity sa osvedčili v týchto koncentráciách aj ako enhancery liečiv. Ich výber bol podmienený katiónovým charakterom chitosanu.
Graf 2 zobrazuje vplyv týchto tenzidov (vzorky 6 až 9) na permeáciu kofeínu z hydrogélov. Tenzidy pozitívne ovplyvnili permeáciu liečiva. Zvýšením koncentrácie benzyldimetylhexadecylamóniumchloridu sa vo významnej miere zvýšilo aj množstvo permeovaného kofeínu, zatiaľ čo pri zvýšení koncentrácie benzetóniumchloridu nastal pokles uvoľnenia kofeínu. Štatisticky významný rozdiel (p < 0,05) kofeínu sa zistil hlavne zo vzorky 9 s obsahom 0,1 % benzyldimetylhexadecylamóniumchloridu (87,9 %) oproti základnej vzorke.
Graf 2. Vplyv katiónových tenzidov na permeáciu kofeínu 
BCI – benzetóniumchlorid, BDMHDCl – benzyldimetylhexadecylamóniumchlorid V hydrogéloch je nevyhnutná prítomnosť humektantov aj konzervantov, preto sa pripravili štyry vzorky s ich vzájomnou kombináciou (vzorky 10 až 13).
V grafe 3 sú spracované liberačné profily základnej vzorky a štyroch vzoriek s kombináciou pomocných látok (zloženie v tab. 1). Z grafu sa dá usúdiť, že kombinácie pomocných látok spôsobili zvýšenie uvoľňovania kofeínu oproti základnej vzorke, a teda sa dá aj skonštatovať, že kombinácia nevyhnutných pomocných látok v hydrogéli kladne ovplyvnila permeáciu kofeínu z hydrogélu do fyziologického roztoku. Ako optimálna kombinácia pomocných látok sa ukázala 10 % propylénglykol a 0,1 % benzyldimetylhexadecylamóniumchlorid (81,92 %). Avšak, liberačné krivky vzoriek 10–13 nevykazujú štatisticky významné rozdiely.
Graf 3. Vplyv kombinácie pomocných látok na permeáciu kofeínu 
PGLY – propylénglykol, GLY – glycerol, BCI – benzetóniumchlorid, BDMHDCl – benzyldimetylhexadecylamóniumchlorid Druhým krokom výskumu bolo sledovanie stability pripravených gélov stanovením reologických vlastností jednotlivých hydrogélov. Na tento experiment bola zvolená koncentrácia chitosanu 2,5 % vďaka výhodným reologickým vlastnostiam, ktoré boli dokázané v predchádzajúcich štúdiách11–14).
U jednotlivých pripravených vzoriek sa stanovili základné reologické parametre: rýchlostný spád D, tangenciálne napätie τ a štruktúrna viskozita ηQ. Z priebehu tokových kriviek vyplýva, že všetky pripravené vzorky patrili medzi nenewtonovské sústavy. Základná vzorka nadobudla tixotropný charakter. Charakteristické sú dve tokové krivky (stúpajúca a klesajúca) líšiace sa tvarom i polohou. Spoločný majú iba bod pri najvyššom rýchlostnom gradiente. Z hľadiska dermálnej aplikácie je tixotropný charakter výhodný20). Z porovnania vzoriek s obsahom humektantov vyplýva, že tixotropné vlastnosti vykazoval iba hydrogél s obsahom 10% propylénglykolu. Vzorky obsahujúce 5% propylénglykol a glycerol v oboch koncentráciách vykazovali pseudoplastické vlastnosti – menej vhodné pri dermálnej aplikácii. Z porovnania reogramov vzoriek s obsahom katiónových tenzidov sa dá usúdiť, že tixotropný charakter nadobudla len vzorka s obsahom 0,05% benzetóniumchloridu. Gély s kombináciami vybraných pomocných látok vykazovali tixotropný charakter, okrem kombinácie 10% glycerol a 0,1% benzyldimetylhexadecylamóniumchlorid. Najvýraznejší tixotropný charakter vykazovala vzorka s kombináciou 10% propylénglykol + 0,1% benzyldimetylhexadecylamóniumchlorid.
Počas doby skladovania sa merania tokových vlastností uskutočnili na 3. deň od prípravy vzoriek, po 2 týždňoch a 1. a 2. mesiaci od prípravy vzoriek. Cieľom opakovaných meraní bolo zistiť, či nedochádza k zmene viskozity jednotlivých gélov. Zistilo sa, že doba skladovania ani teplota, pri ktorej boli skladované, nemenili výrazne tokové vlastnosti hydrogélov. Nedošlo k zmene časovo závislého tixotropného charakteru na časovo nezávislý charakter. Hydrogély si tiež zachovali pôvodnú viskozitu.
Na základe dosiahnutých výsledkov môžeme konštatovať, že optimálne zloženie hydrogélu pre kofeín z hľadiska liberácie aj reologických vlastností vykazuje hydrogél nasledovného zloženia: 2,5% chitosan + 0,1% kofeín + 10% propylénglykol + 0,1% benzyldimetylhexadecylamóniumchlorid.
Stret záujmov: žiadny.
Došlo 15. září 2014 / Přijato 13. listopadu 2014
PharmDr. Alexandra Kodadová • Z. Vitková • P. Herdová • M. Zsidová
Katedra galenickej farmácie
Farmaceutická fakulta UK
Odbojárov 10, 832 32 Bratislava, SR
e-mail: kodadova@fpharm.uniba.sk
J. Čižmárik
Katedra farmaceutickej chémie, Farmaceutická fakulta Univerzity Komenského v Bratislave, SR
Zdroje
1. Herman A., Herman A. P. Caffeine’s mechanism of action and its cosmetics use. Skin. Pharmacol. Physiol. 2013; 26, 8–14.
2. León-Carmona J. R., Galano A. Is caffeine a good scavenger of oxygenated free radicals? J. Phys. Chem. B, 2011; 115, 4538–4546.
3. Otberg N., Patzelt A., Rasulev U., Hagemeister T., Linscheid M., Sinkgraven R., Sterry W., Lademann J. The role of hair follicles in the percutaneous absorption of caffeine. Br. J. Clin. Pharmacol. 2007; 65, 488–492.
4. Bansal M., Machanda K., Pandey S. S. Role of caffeine in the management of androgenetic alopecia. Int. J. Trichology, 2012; 4, 185–186.
5. Mohamed N. A., Fahmy M. M. Synthesis and antimicrobial activity of some novel cross-linked chitosan hydrogels. Int. J. Mol. Sci. 2012; 13, 11194–209.
6. Basu K. S, Kavitha K., Rupeshkumar M. Evaluation of ionotropic cross-linked chitosan/gelatin b microspheres of tramadol hydrochloride. AAPS Pharm. Sci. Tech. 2011; 12, 28–34.
7. Yajun X., Xiaofei L., Qiang, CH. Synthesis and characterization of water soluble chitosan derivate and its antibacterial activity. Carbohydr. Polym. 2007; 69, 142–142.
8. Uragami T., Tokura S. Material science of chitin and chitosan. 1. vyd. Japan: Kodansha Scientific Ltd. 2010; 284–284.
9. Vavříková E., Vinšová J. Chitosan a jeho farmaceutická aplikace. Chem. Listy 2009; 103, 56–57.
10. Herdová P., Vitková, Z. Štúdium liberácie liečiv z chitosanových hydrogélov. Derma 2010; 10, 2–20.
11. Kodadová A., Vitková Z., Herdová P. Hodnotenie liberácie kofeínu z dermálnych polotuhých liekov. Čes. slov. Farm. 2013; 62, 220–222.
12. Vitková Z., Oremusová J., Herdová P., Kodadová A. Release and Rheological Properties of Topical Drugs. Tenside Surfact. Det. 2013; 50, 39–44.
13. Senel S., Ikinci G., Kaş S., Yousefi-Rad A., Sargon M.F., Hincal A.A. Chitosan films and hydrogels of chlorhexidine gluconate for oral mucosal delivery. Int. J. Pharm. 2000; 193, 197–203.
14. Herdová P., Kodadová A., Vitková Z. Vplyv enhanceru na tokové vlastnosti hydrogélov. In : Zborník Preveda – IV. interaktívna konferencia mladých vedcov. Bratislava 2012; 70.
15. Čižmárik J., Vitková Z., Herdová P., Kodadová A., Vími D. Fomulácia benzetóniumchloridu do gélov. Čes. slov. Farm. 2014; 63, 123–126.
16. Vitková Z., Herdová P., Kodadová A., Šeligová J., Grančai D., Poláková D. Formulácia gélov s obsahom šalvie lekárskej. Čes. slov. Farm. 2012; 61, 169–171.
17. Capková Z., Vitková Z., Uhrovská S. Vplyv humektantov na farmaceutickú dostupnosť a reologické vlastnosti hydrogélov s cetirizínom. Čes. slov. Farm., 2005; 54, 226–230.
18. Kodadová A., Vitková Z., Herdová P., Šeligová J. Vplyv teploty a tenzidu na reologické vlastnosti chitosanových hydrogélov. In: Zborník Preveda – V. interaktívna konferencia mladých vedcov. Bratislava 2013; 53.
19. Kodadová A., Vitková Z., Herdová P., Oremusová J., Fořtová M. Vplyv teploty na liberáciu kofeínu z hydrogélov s obsahom kvartérnej amóniovej soli. In: Zborník abstraktov zo VI. vedeckej konferencie „Mladí vedci – bezpečnosť potravinového reťazca“. Bratislava 2013.
20. Kopecký F., Kopecká B. Fyzikální a fyzikálně-chemická teorie léků jejich forem. In Technologie léků. 3. vydání. Praha: Galén 2006; kap. 2, 14–15.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2014 Číslo 6- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
-
Všechny články tohoto čísla
- Nanočásticové systémy uvolňující léčivo při změně teploty
- Ureasa a její vztah k ureolytickým bakteriím a hledání nových inhibitorů ureasy
- Klinické skúšania liečiv v Európskej únii a Českej republike v rokoch 2006, 2009 a 2012
- Příklady off-label použití humánních léčivých přípravků ve veterinární medicíně
- Vplyv pomocných látok na permeáciu kofeínu z gélov
- Výsledky voleb do výboru a sekcí České farmaceutické společnosti ČLS JEP pro období 2015–2018
-
Doc. RNDr. Milan Řehula, CSc.
*4. ledna 1950 – †27. listopadu 2014 - Autorský rejstřík
- Věcný rejstřík
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Příklady off-label použití humánních léčivých přípravků ve veterinární medicíně
- Ureasa a její vztah k ureolytickým bakteriím a hledání nových inhibitorů ureasy
- Nanočásticové systémy uvolňující léčivo při změně teploty
- Klinické skúšania liečiv v Európskej únii a Českej republike v rokoch 2006, 2009 a 2012
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Současné možnosti léčby obezity
nový kurzAutoři: MUDr. Martin Hrubý
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání