-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVybrané polyfenolické látky a jejich použití jako podpůrná terapie metabolického syndromu
Selected polyphenolic compounds and their use as a supportive therapy in metabolic syndrome
Metabolic syndrome is diagnosed mainly in people of economically developed parts of the world and it affects 20–25% of the adult population worldwide. Nowadays, it is also more frequently diagnosed in children and adolescents. In addition to standard treatment that often involves polypharmacotherapy, and thus increases risk of side effects caused by drugdrug interactions, it is appropriate to look for alternative tools to support the treatment of metabolic syndrome components. Natural polyphenolic compounds, usually present in the so-called functional foods, are suitable candidates for that matter, due to the bioactivity and beneficial effects on the human body. Quercetin, troxerutin, diosmin, hesperidin or silybin are among the currently studied and used natural polyphenolic compounds with a positive effect on aspects of the metabolic syndrome. In addition to their antioxidant and anti-inflammatory effects, these compounds have other positive properties that very often outweigh their side effects whilst their usage in the pharmacotherapy.
Keywords:
diosmin – metabolic syndrome – quercetin – polyphenolic compounds – troxerutin – silymarin
Autoři: Jan Soukop; Rostislav Večeřa
Vyšlo v časopise: Čes. slov. Farm., 2022; 71, 135-139
Kategorie: Přehledy a odborná sdělení
doi: https://doi.org/https://doi.org/10.5817/CSF2022-4-135Souhrn
Metabolický syndrom je rozšířen zejména v ekonomicky vyspělých částech světa. Celosvětově je jím postiženo 20–25 % dospělé populace, ale v současnosti je pozorován častěji i u dětí a dospívajících. Standardní léčba často zahrnuje polyfarmakoterapii, která zvyšuje riziko vedlejších účinků způsobených mezilékovými (drug-drug) interakcemi. Proto je vhodné hledat alternativní zdroje pro podporu léčby komponent metabolického syndromu. Přírodní polyfenolické sloučeniny, zpravidla obsažené v tzv. funkčních potravinách, jsou vzhledem k jejich biologické aktivitě a příznivému vlivu na lidský organismus pro tuto problematiku vhodným kandidátem. Mezi aktuálně studované a užívané přírodní polyfenolické sloučeniny s pozitivním vlivem na složky metabolického syndromu patří quercetin, troxerutin, diosmin, hesperidin nebo silybin. Tyto polyfenoly, kromě antioxidačních a protizánětlivých účinků mají i další pozitivní vlastnosti, které velmi často násobně převyšují jejich vedlejší nežádoucí účinky během jejich užití ve farmakoterapii.
Klíčová slova:
diosmin – metabolický syndrom – polyfenolické sloučeniny – quercetin – troxerutin – silymarin
Úvod
Metabolický syndrom (MetS) je souborem rizikových faktorů a onemocnění vyskytujících se společně, který může přispět k rozvoji kardiovaskulárních, onkologických i psychiatrických onemocnění. Mezi symptomy MetS patří zejména zvýšené ukládání tuku v abdominální oblasti, arteriální hypertenze, dyslipidemie, poruchy glukoregulace aj. Úzce spjaté s rozvojem MetS jsou i imbalance v antioxidačním systému, jejímž následkem mohou být mitochondriální dysfunkce spjaté s oxidativním stresem a následné prohloubení systémového zánětu1). Neméně důležitým je také vzájemný vztah mezi metabolickým syndromem a systémovým zánětem, který je poměrně komplexní a tyto dva fenomény se navzájem ovlivňují. Při metabolickém syndromu dochází k řadě patofyziologických změn v tkáních, které mohou v důsledku produkovat zvýšené množství prozánětlivých cytokinů, volných mastných kyselin či dalších markerů chronického zánětu, které vedou ke zvýšení množství C-reaktivního proteinu2). Systémový zánět potom může zvyšovat riziko vzniku kardiovaskulárních onemocnění. Již zmíněné cytokiny jsou rovněž schopné iniciovat progresi inzulinové rezistence, která vede k hyperglykemii a k rozvoji diabetu1, 2).
Metabolický syndrom je komplexem mnoha faktorů, které se vzájemně ovlivňují a jeho léčba je založena zejména na změně životního stylu a striktním dodržování vyvážené diety. V mnohých případech je indikována farmakoterapie3).
Metabolický syndrom
Metabolický syndrom je označením pro rizikové metabolické faktory, které se vyskytují v organismu současně (tab. 1).
Tab. 1. Faktory definující metabolický syndrom podle National Cholesterol Education Program Adult Treatment Panel III (NCEP ATP III)4) 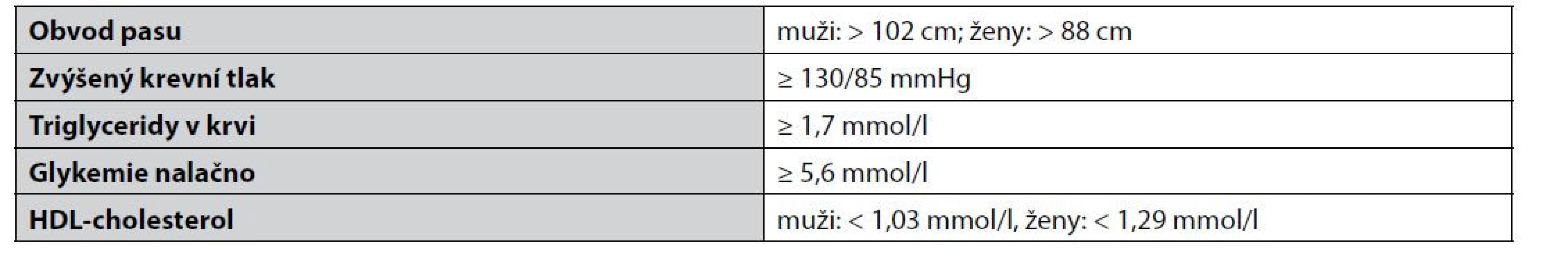
V současnosti je podle NCEP ATP III MetS diagnostikován pacientům disponujícím alespoň třemi výše zmíněnými faktory. MetS zvyšuje riziko vývoje diabetu druhého typu a kardiovaskulárních onemocnění, které jsou nejčastější příčinou úmrtí po celém světě5). Mezi hlavní strategie léčby patří změna životního stylu, změna stravovacích a pohybových návyků. Pokud však tato opatření nepomáhají, přistupuje se k farmakoterapii, která je zaměřena na každý faktor zvlášť. Vzhledem k tomu, že je MetS multifaktorové onemocnění, lze tuto farmakologickou intervenci označovat jako polyfarmakoterapii, jejímž hlavním problémem jsou tzv. drug-drug interakce, které mohou zvýšit riziko výskytu nežádoucích účinků. V současné době se zvyšuje snaha o vývoj tzv. multifunkčních léčiv, která jsou schopna v rámci jedné molekuly schopna ovlivnit více faktorů zároveň3). Pozornost je také upírána směrem k přírodním sloučeninám, které vykazují biologickou aktivitu a nesou s sebou nižší riziko nežádoucích účinků1).
Využití nutraceutik v léčbě metabolického syndromu
V rámci změny stravovacích návyků je vhodné zařadit do stravy tzv. funkční potraviny a nutraceutika obsahující bioaktivní látky, které mají zpravidla pozitivní vliv na procesy probíhající v organismu. V rámci léčby MetS se jedná zejména o sloučeniny s antioxidačními a protizánětlivými vlastnostmi, rostlinné bílkoviny, polynenasycené mastné kyseliny a hydrofilní vláknina6). Tento článek je zaměřen na polyfenolické sloučeniny, které disponují antioxidačními, protizánětlivými a dalšími pozitivními vlastnostmi, které často násobně převažují nad jejich vedlejšími účinky na organismus.
Polyfenoly
Polyfenoly jsou chemické sloučeniny, jejichž molekula sestává z více než jedné fenolové jednotky. Jsou to produkty sekundárního metabolismu rostlin a mnohé z nich disponují příznivými účinky, mezi které patří zejména antioxidační, protizánětlivé, a protinádorové působení7).
Quercetin
Quercetin patří do skupiny flavonoidů a vzhledem k jeho antioxidačním vlastnostem patří k jedněm z nejvíce studovaných rostlinných biologicky aktivních sloučenin. Quercetin v rostlinách slouží jako pigment a je obsažen v různých druzích rostlin, zejména však v cibuli kuchyňské (Allium cepa), citrusovém ovoci, lesních plodech a listové zelenině8).
Molekula quercetinu sestává ze dvou fenylových skupin spojených heterocyklickým kruhem obsahujícím atom kyslíku. Izolovaná forma quercetinu má formu žlutého prášku, který je dobře rozpustný v nepolárních rozpouštědlech, ačkoliv molekula obsahuje pět hydroxylových skupin, konkrétně na pozicích 3,3´,4´,5 a 79). Izolovaný quercetin má nízkou biologickou dostupnost, v přírodních zdrojích se však jeho molekula připojuje k molekule cukru za tvorby různých glykosidů, jejichž biologická dostupnost se liší právě podle molekuly cukru, na kterou je quercetin navázán. Ve studii stanovení množství quercetinových cukerných derivátů v ileostomickém odpadu byla pozorována nejvyšší, průměrně 52 %, absorpce u glykosidu quercetinu. Samotný quercetin bez cukerné složky, tzv. quercetinový aglykon, byl absorbován z 24 % a rutinosid quercetinu byl absorbován ze 17 %10).
Metabolismus quercetinu probíhá zejména v játrech a tenkém střevě, ale může k němu docházet i v tlustém střevě a ledvinách11). Metabolity quercetinu se v lidské plazmě nacházejí ve formě sulfátu a glukuronidu, z nichž nejčastějším je quercetin-3-O-β-D-glukuronid12).
Bioaktivita quercetinu byla studována zejména u formy aglykonu, která nedisponuje cukernou složkou. Benefit quercetinu spočívá v jeho antioxidačních vlastnostech. Je schopný vychytávat volné kyslíkové radikály, jejichž nadměrné množství v organismu může poškozovat tkáně na buněčné úrovni13). Neméně prospěšnou vlastností quercetinu je schopnost regulovat zánět v organismu, která je založená na inhibici enzymů cyklooxygenáz, a tím snížení produkce zánětlivých mediátorů, jako jsou například prostaglandiny14). Se zánětem organismu je spojený i C-reaktivní protein (CRP), jehož zvýšené množství v organismu je spojeno s různými onemocněními, jako je obezita či kardiovaskulární onemocnění. Quercetin disponuje schopností regulovat množství CRP v těle, což bylo pozorováno například při studii dvouměsíční suplementace quercetinu u neprofesionálních sportovců15). Quercetin má navíc schopnost inhibovat enzym xantinoxidázu a tím modulovat produkci kyseliny močové v těle a ovlivňovat urikemii16).
Troxerutin
Troxerutin, označovaný také jako vitamin P4, je derivát quercetin-3-O-rutinosidu (rutinu) disponující antioxidačními, antidiabetickými, protizánětlivými a protinádorovými vlastnostmi17). Vysoká hydrofilita a dobrá absorpce v gastrointestinálním traktu (GIT) jej činí potenciální možností podpůrné léčby a prevence řady onemocnění. Troxerutin byl nalezen v pupenech jerlínu japonského (Sophora japonica), čaji, kávě a různých druzích zeleniny a ovoce17).
Molekulová hmotnost troxerutinu činí 742,7 g/mol. Izolovaný troxerutin má formu žlutého prášku, je vysoce rozpustný ve vodě a oproti rutinu je lépe absorbován v GIT18).
Ve studiích prováděných v in vitro i in vivo podmínkách byly pozorovány, kromě již zmíněných, další farmakologické vlastnosti troxerutinu. Dle studie na potkaních samcích Wistar, troxerutin indukuje normalizaci glukózového transportéru typu 4 (GLUT4), čímž dochází ke zlepšení utilizace glukózy v kosterním svalstvu a ke zlepšenému metabolismu glykogenu19). V další studii provedené na samcích Albino myší, krmených laboratorní dietou s vysokým podílem tuků a fruktózy, byl pozorován pozitivní vliv troxerutinu na citlivost k inzulinu a snížení poškození srdeční tkáně vyvolaného oxidativním stresem. Podáváním troxerutinu došlo ke zvýšení exprese genů pro PPAR-α, PGC-1α a CPT-1b podílejících se na odbourávání mastných kyselin. Exprese genů zapojených do syntézy mastných kyselin byla naopak troxerutinem snížena20). V experimentu na potkaním modelu HHTg, který disponuje mnohými aspekty metabolického syndromu, bylo pozorováno zlepšení metabolismu jaterních lipidů a zlepšení inzulinové rezistence v periferních tkáních po podání troxerutinu21).
Diosmin
Diosmin je přírodní flavonoid, který je získáván z rostlin čeledi Rutaceae či konverzí flavonoidu hesperidinu. Rovněž se vyskytuje ve slupkách některých citrusových plodů, jako jsou citrony a pomeranče. Stejně jako ostatní zmíněné polyfenolické sloučeniny disponuje antioxidačními a protizánětlivými vlastnostmi. Diosmin je součástí léčiv i doplňků stravy užívaných k podpoře léčby chronických žilních onemocnění22, 23).
Molekula diosminu má molekulovou hmotnost 608,5 g/mol a jeho izolovaná forma má podobu šedožlutého prášku. Na rozdíl od troxerutinu, diosmin je prakticky nerozpustný ve vodě, a proto je jeho biologická dostupnost velmi nízká24). Při perorálním užití však dochází pomocí střevních bakterií k jeho rychlé hydrolýze na jeho aglykon diosmetin, který je posléze absorbován v GIT. Diosmetin podléhá v druhé fázi biotransformace glukuronidaci na 3-O-glukuronid25).
Diosmin disponuje podobnými efekty, jako již zmíněné flavonoidy. Ve spojení s metabolickým syndromem je zmiňován zejména jeho protizánětlivý efekt, ale za zmínku stojí i další pozitivní účinky. V nedávném experimentu na potkaním modelu pro nealkoholickou steatohepatitidu bylo pozorováno snížení inzulinové rezistence a zlepšení jaterní fibrózy podáním diosminu26). S působením diosminu je spojený zvýšený výskyt nežádoucích účinků, z nichž mezi nejběžnější patří nevolnost a závratě. Mezi závažnější pozorované nežádoucí účinky patří tachykardie, ve vzácných případech pak byla pozorována periferní vazokonstrikce a ischemické poškození srdce27).
Hesperidin
Hesperidin je rutinosid hesperetinu obsažený v citronech, pomerančích a některých dalších druzích ovoce a zeleniny. Hesperidin je komerčně dostupný jako doplněk stravy, většinou ve směsi s diosminem v různých poměrech a rovněž je obsažen i v některých léčivých přípravcích určených pro terapii cévních onemocnění28).
Hesperidin má molekulární hmotnost 610,6 g/mol a v izolované formě má podobu světle hnědého prášku, který je nerozpustný ve vodě29). V tlustém střevě dochází pomocí střevních bakterií k enzymatickému odštěpení jeho cukerné složky a k absorpci jeho aglykonu hesperetinu, který dále podléhá biotransformaci. V krvi jsou pak přítomny konjugáty hesperetinu, zejména jeho glukuronidy a sulfáty30).
Výzkum působení hesperidinu probíhá v in vitro i in vivo experimentech, včetně jeho vlivu na lidský organismus. V in vitro podmínkách bylo pozorováno zvýšené vychytávání glukózy z krve a snížení oxidativního stresu v buněčné linii L631). V různých studiích je demonstrován vliv hesperidinu a hesperetinu na snížení inzulinové rezistence v obou typech diabetu u modelů hlodavců. Hesperidin podle těchto studií funguje jako protizánětlivá látka snižující oxidativní stres spojený s diabetem32). Hesperidin je spojen s léčbou faktorů metabolického syndromu i kvůli jeho schopnosti regulace lipidového metabolismu. Studie na myších demonstrovala schopnost hesperidinu snížit množství volných mastných kyselin a triglyceridů v plazmě a játrech33).
Podobně jako diosmin, hesperidin může zapříčinit řadu nežádoucích účinků. Mezi nejběžnější patří nevolnost, průjem, bolest v oblasti břicha nebo hlavy34).
Silybin
Ostropestřec mariánský (Silybum marianum) je léčivá rostlina, jejíž plody jsou zdrojem silymarinu. Jedná se o standardizovaný extrakt tvořený směsí flavonolignanů, užívaný tradičně při léčbě onemocnění jater. Tento extrakt je tvořen celkem šesti flavonolignany, z nichž silybin (tvořící 60–70 % silymarinu) je jeho nejvíce aktivní komponentou35). Silybin má popsánu celou řadu prospěšných účinků, mezi které patří jeho antioxidační působení, hypocholesterolemické působení, inhibiční efekt na rozvoj virových infekcí nebo protinádorové účinky35–37). Silybin se tradičně používá k léčbě otravy muchomůrkou zelenou (Amanita phalloides), kde jeho injekční (infuzní) forma přispívá ke zmírnění toxického poškození jater amatoxiny. Mechanismy prospěšného působení silybinu a silymarinu nejsou zatím zcela objasněny. Na potkaním modelu bylo zjištěno, že silymarin svoje hypolipidemické působení může pravděpodobně vést cestou inhibice resorpce cholesterolu ze střeva nebo cestou up-regulace ABC transportérů zapojených do regulace lipidového metabolismu38). Jeho hlavní součást – silybin – může v tomto působení hrát důležitou roli. Tento flavonolignan se ve velké míře používá v nepřeberném množství nutraceutik, funkčních potravin a dietních doplňků.
Silybin existuje v přírodě jako přibližně ekvimolární směs dvou diastereoizomerů. Všechny vlastnosti standardizovaného silymarinu, resp. silybinu, jsou dobře známé, bohužel špatná biologická dostupnost (cca 2 % podané dávky) a rychlá eliminace do určité míry limituje jeho terapeutický potenciál39). Z tohoto důvodu je projevena snaha o vytvoření takových forem silybinu, které budou mít vyšší biologickou dostupnost. V porovnání se standardní formou silybinu poskytuje mikronizovaný silybin přibližně 85% zvýšení biologické dostupnosti a silybin ve formě fytosomů vykazuje ještě lepší biologickou dostupnost, dosahující 6–10násobného zvýšení oproti standardní formě40). Užívání těchto biodostupnějších forem silybinu tak může přispět k lepším terapeutickým výsledkům, přispívajícím ke komplexnosti terapie pacientů s metabolickým syndromem.
Závěr
Polyfenoly jsou potenciálním kandidátem pro léčbu a prevenci metabolického syndromu. Současné studie potvrzují pozitivní vliv přírodních polyfenolických sloučenin na jeho faktory, avšak mechanismus jejich účinku na molekulární úrovni ještě není dostatečně zcela prostudován, a proto je třeba provádět jejich další výzkum.
Autoři děkují za podporu projektu IGA UPOL LF_2022_006.
Střet zájmů: žádný.
Došlo 19. dubna 2022 / Přijato 9. června 2022
Mgr. Jan Soukop
R. Večeřa
Lékařská fakulta Univerzity Palackého
Ústav farmakologie
Hněvotínská 3, 775 15 Olomouc
e-mail: jan.soukop01@upol.cz
Zdroje
1. Zhang S., Xu M., Zhang W., Liu C., Chen S. Natural Polyphenols in Metabolic Syndrome: Protective Mechanisms and Clinical Applications. Int. J. Mol. Sci. 2021; 22, 6110.
2. van den Brink W., van Bilsen J., Salic K., Hoevenaars F. P. M., Verschuren L., Kleemann R., Bouwman J., Ronnett G. V., van Ommen B., Wopereis S. Current and Future Nutritional Strategies to Modulate Inflammatory Dynamics in Metabolic Disorders. Front. Nutr. 2019; 6, 129.
3. Lillich F. F., Imig J. D., Proschak E. Multi-Target Approaches in Metabolic Syndrome. Front. Pharmacol. 2021; 11, 1996.
4. Saif-Ali R., Kamaruddin N. A., Al-Habori M., Al-Dubai S. A., Wan Ngah W. Z. Relationship of metabolic syndrome defined by IDF or revised NCEP ATP III with glycemic control among Malaysians with Type 2 Diabetes. Diabetol Metab Syndr. 2020; 12, 1–7.
5. Cardiovascular diseases (CVDs). https://www.who.int/ newsroom/factsheets/detail/cardiovascular-diseases-( - cvds) (17. 1. 2022).
6. Nasri H., Baradaran A., Shirzad H., Rafieian-Kopaei M. New Concepts in Nutraceuticals as Alternative for Pharmaceuticals. Int. J. Prev. Med. 2014; 5, 1487.
7. Ohta T., Masutomi N., Tsutsui N., Sakairi T., Mitchell M., Milburn M. V., Ryals J. A., Beebe K. D., Guo L. Untargeted metabolomic profiling as an evaluative tool of fenofibrate-Induced toxicology in fischer 344 male rats. Toxicol. Pathol. 2009; 37, 521–535.
8. David A. V. A., Arulmoli R., Parasuraman S. Overviews of biological importance of quercetin: A bioactive flavonoid. Pharmacogn Rev. 2016; 10, 84–89.
9. Quercetin | C15H10O7 – PubChem. https://pubchem. ncbi.nlm.nih.gov/compound/Quercetin (17. 1. 2022).
10. Hollman P. C., de Vries J. H., van Leeuwen S. D., Mengelers M. J., Katan M. B. Absorption of dietary quercetin glycosides and quercetin in healthy ileostomy volunteers. Am. J. Clin. Nutr.1995; 62, 1276–1282.
11. Boots A. W., Haenen G. R. M. M., Bast A. Health effects of quercetin: From antioxidant to nutraceutical. Eur. J. Pharmacol. 2008; 585, 325–337.
12. Murota K., Hotta A., Ido H., Kawai Y., Moon J. H., Sekido K., Hayashi H., Inakuma T., Terao J. Antioxidant capacity of albumin-bound quercetin metabolites after onion consumption in humans. J. Med. Invest. 2007; 54, 370–374.
13. Lakhanpal P., Rai D. K. Quercetin: A Versatile Flavonoid. IJMU 2007; 2, 20–35.
14. Xiao X., Shi D., Liu L., Wang J., Xie X., Kang T., Deng W. Quercetin Suppresses Cyclooxygenase-2 Expression and Angiogenesis through Inactivation of P300 Signaling. PLoS One. 2011; 6, e22934.
15. Askari G., Ghiasvand R., Feizi A., Ghanadian S. M., Karimian J. The effect of quercetin supplementation on selected markers of inflammation and oxidative stress. J Res Med Sci., 2012; 17, 637–641.
16. Ahmad N. S., Farman M., Najmi M. H., Mian K. B., Hasan A. Pharmacological basis for use of Pistacia integerrima leaves in hyperuricemia and gout. J. Ethnopharmacol. Elsevier 2008; 117, 478–482.
17. Ahmadi Z., Mohammadinejad R., Roomiani S., Afshar E. G., Ashrafizadeh M. Biological and Therapeutic Effects of Troxerutin: Molecular Signaling Pathways Come into View. J. Pharmacopunct. 2021; 24, 1–13.
18. Badalzadeh R., Layeghzadeh N., Alihemmati A., Mohammadi M. Beneficial effect of troxerutin on diabetes - induced vascular damages in rat aorta: histopathological alterations and antioxidation mechanism. Int. J. Endocrinol. Metab. 2015; 13.
19. Sampath S., Karundevi B. Effect of troxerutin on insulin signaling molecules in the gastrocnemius muscle of high fat and sucrose-induced type-2 diabetic adult male rat. Mol. Cell. Biochem. 2014; 395, 11–27.
20. Geetha R., Yogalakshmi B., Sreeja S., Bhavani K., Anuradha C. V. Troxerutin suppresses lipid abnormalities in the heart of high-fat-high-fructose diet-fed mice. Mol. Cell. Biochem. 2014; 387, 123–134.
21. Malinska H., Hüttl M., Oliyarnyk O., Markova I., Poruba M., Racova Z., Kazdova L., Vecera R. Beneficial effects of troxerutin on metabolic disorders in non-obese model of metabolic syndrome. PLoS One 2019; 14, e0220377.
22. Karetova D., Suchopar J., Bultas J. Diosmin/hesperidin: A cooperating tandem, or is diosmin crucial and hesperidin an inactive ingredient only? Vnitř. Lék. 2020; 66, 97–103.
23. Diosmin | C28H32O15 – PubChem. https://pubchem. ncbi.nlm.nih.gov/compound/Diosmin (17. 1. 2022).
24. Diosmin | 520-27-4. https://www.chemicalbook.com/ ChemicalProductProperty_EN_CB6443258.htm (17. 1. 2022).
25. Silvestro L., Tarcomnicu I., Dulea C., Attili N. R. B. N., Ciuca V. Peru D., Savu S. R. Confirmation of diosmetin 3-O-glucuronide as major metabolite of diosmin in humans, using micro-liquid-chromatography-mass spectrometry and ion mobility mass spectrometry. Anal. Bioanal. Chem. 2013; 405, 8295–8310.
26. Gerges S. H., Wahdan S. A., Elsherbiny D. A., El-Demerdash E. Diosmin ameliorates inflammation, insulin resistance, and fibrosis in an experimental model of non - -alcoholic steatohepatitis in rats. oxicol. Appl. Pharmacol. 2020; 401, 115101.
27. Diosmin Uses, Benefits & Dosage – Drugs.com Herbal Database. https://www.drugs.com/npp/diosmin. html (17. 1. 2022).
28. Detralex | C56H66O30 – PubChem. https://pubchem. ncbi.nlm.nih.gov/compound/Detralex (17. 1. 2022).
29. Hesperidin | C28H34O15 – PubChem. https://pubchem. ncbi.nlm.nih.gov/compound/Hesperidin (17. 1. 2022).
30. Pereira-Caro G., Polyviou T., Ludwig I. A., Nastase A. M., Moreno-Rojas J. M., Garcia A. L., Malkova D., Crozier A. Bioavailability of orange juice (poly)phenols: the impact of short-term cessation of training by male endurance athletes. Am. J. Clin. Nutr. 2017; 106, 791 – 800.
31. Dhanya R., Jayamurthy P. In vitro evaluation of antidiabetic potential of hesperidin and its aglycone hesperetin under oxidative stress in skeletal muscle cell line. Cell Biochem. Funct. 2020; 38, 419–427.
32. Mas-Capdevila A., Teichenne J., Domenech-Coca C., Caimari A., Del Bas J. M., Escoté X., Crescenti A. Effect of Hesperidin on Cardiovascular Disease Risk Factors: The Role of Intestinal Microbiota on Hesperidin Bioavailability. Nutrients 2020; 12, 1488.
33. Jung U. J., Lee M. K., Park Y. B., Kang M. A., Choi M. S. Effect of citrus flavonoids on lipid metabolism and glucose - regulating enzyme mRNA levels in type-2 diabetic mice. Int. J. Biochem. Cell Biol. 2006; 38, 1134–1145.
34. HESPERIDIN METHYLCHALCONE. https://drugs.ncats.io/ drug/4T2GVA922X (17. 1. 2022).
35. Koltai T., Fliegel L. Role of Silymarin in Cancer Treatment: Facts, Hypotheses, and Questions. J. Evid. Based Integr. Med. 2022; 27, 2515690X2110688.
36. Skottova N., Krecman V. Silymarin as a potential hypocholesterolaemic drug. Physiol. Res. 1998; 47, 1–7.
37. Camini F. C., da Silva T. F., da Silva Caetano C. C., Almeida L. T., Ferraz A. C., Alves Vitoreti V. M., de Mello Silva B., de Queiroz Silva S., de Magalhães J. C., de Brito Magalhães C. L. Antiviral activity of silymarin against Mayaro virus and protective effect in virus-induced oxidative stress. Antivir. Res. 2018; 158, 8–12.
38. Vecera R., Zacharova A., Orolin J., Skottova N., Anzenbacher P. The effect of silymarin on expression of selected ABC transporters in the rat. Vet. Med. 2011; 56, 59–62.
39. Calani L., Brighenti F., Bruni R., Del Rio D. Absorption and metabolism of milk thistle flavanolignans in humans. Phytomedicine. 2012; 20, 40–46.
40. Kidd P., Head K. A Review of the Bioavailability and Clinical Efficacy of Milk Thistle Phytosome: A Silybin-Phosphatidylcholine Complex (Siliphos®). Altern Med Rev. 2005; 10, 193–203.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2022 Číslo 4- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
-
Všechny články tohoto čísla
- Barevnost a obsah některých biologicky aktivních látek v medu
- Vybrané polyfenolické látky a jejich použití jako podpůrná terapie metabolického syndromu
- Neuroaktívne steroidy – nové možnosti v liečbe popôrodnej depresie
- Studium antimikrobiální a antimykotické aktivity některých derivátů 1,2,4-triazolu
- Vášeň pro krásu lékárníka Mojmíra Helceleta
- XLIII. pracovní dny Radiofarmaceutické sekce ČSNM Hotel Strážnice, 18. až 20. května 2022
- Prof. RNDr. Jan Šubert, CSc. – osemdesiaťročný
- Výstava Zahrada vůní aneb Rostliny v parfémech
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Neuroaktívne steroidy – nové možnosti v liečbe popôrodnej depresie
- Vybrané polyfenolické látky a jejich použití jako podpůrná terapie metabolického syndromu
- XLIII. pracovní dny Radiofarmaceutické sekce ČSNM Hotel Strážnice, 18. až 20. května 2022
- Barevnost a obsah některých biologicky aktivních látek v medu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Současné možnosti léčby obezity
nový kurzAutoři: MUDr. Martin Hrubý
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



