-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaTakrin a jeho deriváty v terapii Alzheimerovy choroby
Tacrine and its derivatives in the therapy of Alzheimer’s disease
Cholinesterase inhibitors have beneficial effects on the cognitive, functional, and behavioural symptoms of Alzheimer’s disease (AD). Up to date, they represent almost the only drugs approved by the U.S. Food and Drug Administration agency for AD treatment. The group involves donepezil, rivastigmine and galantamine. Apart from the above mentioned cholinesterase inhibitors, memantine is used for AD treatment as well acting as N‑methyl-D-aspartate (NMDA) non-competitive antagonist. Tacrine (9-amino-1,2,3,4-tetrahydroacridine) was the first cholinesterase inhibitor approved for symptomatic AD treatment. However, its several side effects (hepatotoxicity and gastrointestinal discomfort) limited tacrine further use. Recently, novel tacrine analogues are extensively investigated in endeavour to find less toxic compounds with the “multi-target directed ligand” profile affecting more AD pathological mechanisms. The following study summarizes the knowledge of up to date published tacrine analogues, their structural aspects and biological properties. According to structural aspects, tacrine derivatives are divided into three groups, where they are discussed.
Keywords:
Alzheimer’s disease • tacrine and its derivatives • acetylcholinesterase • inhibitor
Autoři: Jan Korábečný 1; Katarína Špilovská 2; Ondřej Benek 1; Kamil Musílek 3; Ondřej Soukup 1; Kamil Kuča 4
Působiště autorů: Univerzita Obrany Hradec Králové, Fakulta vojenského zdravotnictví a Fakultní nemocnice Hradec Králové 1; Univerzita Obrany Hradec Králové, Fakulta vojenského zdravotnictví 2; Univerzita Hradec Králové, Přírodovědecká fakulta a Fakultní nemocnice Hradec Králové 3; Univerzita obrany, Fakulta vojenského zdravotnictví, Centrum pokročilých studií a Fakultní nemocnice Hradec Králové 4
Vyšlo v časopise: Čes. slov. Farm., 2012; 61, 210-221
Kategorie: Přehledy a odborná sdělení
Došlo 13. srpna 2012 / Přijato 19. září 2012
Souhrn
Inhibitory cholinesteras mají příznivý vliv na kognitivní, funkční i behaviorální projevy Alzheimerovy choroby (AD) a v současné době představují téměř výhradně jedinou skupinu léčiv používaných pro terapii tohoto onemocnění. Tři z nich jsou schváleny k užívání americkou agenturou Food and Drug Administration – donepezil, rivastigmin a galantamin. Kromě inhibitorů cholinesteras se dále používá memantin, který je představitelem N-methyl-D-aspartátových (NMDA) nekompetitivních antagonistů. Takrin (9-amino-1,2,3,4-tetrahydroakridin) se stal prvním schváleným inhibitorem cholinesteras pro léčbu AD. Jeho nežádoucí účinky, zejména hepatotoxicita a gastrointestinální potíže, však limitují jeho další využití. Nové deriváty takrinu jsou intenzivně zkoumány ve snaze najít látky s nižší toxicitou a postihující více patologických mechanismů účastnících se AD. Předkládaná práce sumarizuje dosud publikované strukturní aspekty takrinových derivátů a zaměřuje se na jejich vybrané biologické vlastnosti. Jednotlivé sloučeniny jsou rozčleněny dle strukturních aspektů do tří základních skupin, které jsou diskutovány.
Klíčová slova:
Alzheimerova choroba • takrin a jeho deriváty • acetylcholinesterasa • inhibitorAlzheimerova choroba
Alzheimerova choroba (AD) patří mezi nejčastější formy demence. Její nepředvídatelnost a dosud neznámá etiologie ji činí stále větším problémem, nejen po stránce zdravotní, ale i po stránce sociální či ekonomické. AD většinou končí po 3–10 letech od stanovení diagnózy letálně1, 2).
Celosvětově zaujímá AD pátou nejrozšířenější příčinu úmrtí u lidí starších 65 let. Případy úmrtí zapříčiněné AD dramaticky narůstají. Mezi roky 2000 a 2008 bylo zaznamenáno 66 % případů úmrtí způsobených AD. Pro srovnání, případů úmrtí z důvodů srdečního selhání bylo okolo 13 %, mozkové příhody 20 % a úmrtí v důsledku rakoviny prostaty okolo 8 %1, 2).
V Americe je odhadováno 5,4 milionů pacientů s AD, přičemž 200 000 z nich je mladších 65 let (AD s časným začátkem), celkový počet demencí ve světě je v současné době odhadován ke 35,6 milionu lidí. Do roku 2050 se předpokládá nárůst až na 115,4 milionů pacientů1). Nejrizikovější populací jsou osoby starší 85 let (více než 50 % případů AD). V České republice je odhadováno, že touto chorobou trpí přibližně 125 000 obyvatel, v rámci Evropské unie je to pak 6 milionů a toto číslo se s největší pravděpodobností do roku 2050 zdvojnásobí3–6). Všechna výše zmíněná data podtrhují závažnost AD, přičemž dosud nebyla vyvinuta efektivní terapie AD. Hlavním důvodem jsou omezené znalosti základní patofyziologie AD. Ačkoliv v posledních 30 letech bylo dosaženo velkého pokroku na úrovni biologické, biochemické, toxikologické, tak i v oblasti farmaceutického výzkumu, zvažované terapeutické postupy selhávají nebo intervenují až příliš pozdě v průběhu nemoci1, 4).
Cholinergní teorie
Cholinergní hypotéza představuje první a dodnes přijímanou teorii vysvětlující podstatu vzniku AD. Téměř všechna současně používaná léčiva k mírnění symptomatických projevů všech forem AD se o ni opírají7, 8). Tato teorie vychází z poznatků ztráty cholinergní aktivity pozorované u pacientů s AD a z experimentálních studií na lidech i primátech. Tyto studie našly úzkou souvislost mezi rolí neuromediátoru acetylcholinu (ACh) a schopností učení a pamatování si9). Z blokády centrálního cholinergního systému skopolaminem u mladých jedinců lze vypozorovat podobné příznaky demence jako v populaci jedinců postižených AD. Tento paměťový deficit může být navrácen do normálního stavu použitím inhibitorů cholinesteras, např. fysostigminem10). Tato experimentální studie vedla ke klinickým studiím jiného typu sloučenin, reverzibilních inhibitorů cholinesteras, které zaznamenaly největší příslib pro léčbu deficitních paměťových funkcí u pacientů s AD.
Při detailnějším pohledu na deficitní cholinergní systém při AD byla pozorována narušená signalizace z populace neuronů vycházející z bazální části předního mozku a Meynertova jádra do mozkové kůry a hipokampu. Rovněž koncentrace a aktivita cholinacetyltransferasy (ChAT) zodpovědné za tvorbu ACh se v průběhu AD významně snižuje v oblastech mozkové kůry a hipokampu11–13). Ve stejných částech mozku pak bylo také potlačeno uvolňování ACh navozené depolarizací a dále byl snížen uptake cholinu do nervových zakončení, který je potřebný k doplnění zásob pro resyntézu nového ACh. Pokud vezmeme v úvahu, že prvotním ukazatelem AD jsou narušené paměťové funkce, pak výše zmíněná role ACh při cholinergní transmisi a jeho důležitost pro kognitivní funkce podporuje tyto závěry14). Všechna tato pozorování položila základ cholinergní teorii, kterou poprvé shrnul v roce 1982 ve své práci Bartus et al.15). Tato práce dodnes plně reflektuje vztah mezi cholinergní hypotézou, věkově závislou cholinergní dysfunkcí a demencí typu AD.
Takrin a jeho deriváty
Od první syntézy takrinu (1945) bylo připraveno velké množství takrinových analogů, které byly testovány nejen pro svůj potenciál v léčbě AD16). Takrin samotný disponuje skvělými biologickými vlastnostmi, mezi které patří inhibice acetylcholiensterasy (AChE, EC 3.1.1.7) v nM koncentraci a snadný prostup přes hematoencefalickou bariéru, který je pravděpodobně spojený s acetyl-L-karnitinovým transportním systémem17, 18). Současně připravované deriváty s ohledem na AD lze rozdělit do tří skupin. První je zastoupena monotakrinovými deriváty, ve kterých je různě modifikován základní skelet. Druhou skupinu prezentují homodimery takrinu. Tyto sloučeniny působí převážně pouze inhibičně na cholinesterasy (ChE) a jsou zpravidla symetrickými molekulami. Třetí skupina, která v posledních letech zaznamenala největší nárůst, je představována heterodimery takrinu. Zejména poslední jmenovaná skupina sdružuje sloučeniny s různým farmakologickým účinkem, zpravidla výhodným pro léčbu AD. Homodimery i heterodimery jsou shodně připravovány na podkladě poznatků o duální inhibici acetylcholinesterasy (AChE). Ta je výhodná zejména díky zesílenému účinku na AChE (efektivní koncentrace v řádu nM) a zpravidla i dlouhodobějšímu působení. Další výhodou přímo související s duální inhibicí těchto sloučenin je schopnost zamezit formování fibril proteinu β-amyloidu (Aβ) indukovaného prostřednictvím periferní anionické (aromatické) části AChE19). Spojení dvou sloučenin s rozdílným farmakologickým profilem má však i další nesporné výhody. Předně vzniká nová entita schopná působit na další cíle, které ovlivňují patologii dané nemoci, což je výhodné u multifaktoriálních onemocnění, tedy i u AD.
Monotakrinové inhibitory
Velká srovnávací studie monotakrinových inhibitorů (1) byla provedena Recanatini et al. Deriváty se lišily substitucí v poloze 6, 7 a 9 takrinového skeletu. Nejvyšší afinitu k AChE ukázala analoga substituovaná v poloze 6 CH3-, NO2 - nebo Cl skupinami (nejvyšší 6-Cl: IC50 = 9,9 nM). Zavedení Cl do obou poloh základního skeletu (6 i 7) vedlo ke sloučeninám s nízkou účinností. Objemné substituenty v poloze 9, jako je např. benzyl, rovněž snižují afinitu k AChE, naopak n-heptyl v této poloze zvyšuje účinnost20). Pro polohy 6 a 7, elektronakceptorové (např. NO2–) substituenty zvyšovaly účinnost, zatímco elektrondonorové (např. benzyl) substituenty snižují inhibiční potenciál (obr. 1).
Obr. 1. Monotakrinové deriváty podrobené SAR studii 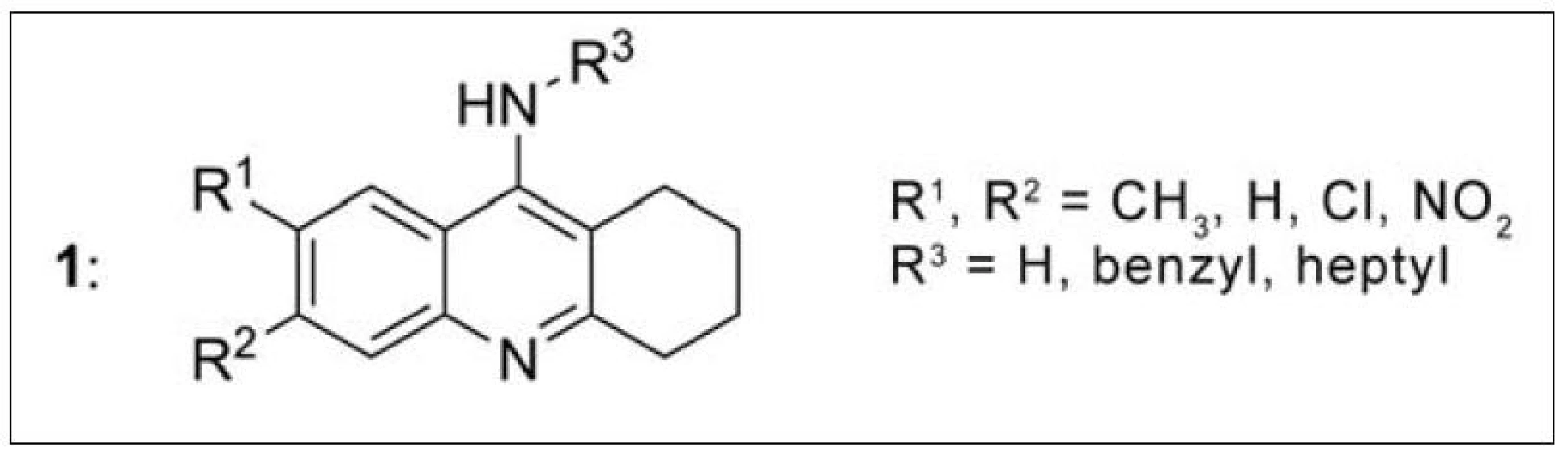
Chirálními terpenickými monotakriny (2) a jejich aktivitou se zabývali Pisoni et al. (obr. 2)21). Výchozí sloučeninou pro syntézu byl keton v opticky aktivní formě. Objemnější substituenty v poloze 1 vyústily v méně účinné inhibitory AChE. Zajímavý inhibiční potenciál vykázal sedmičlenný derivát s karbonylovou funkcí 2e (derivát 2e: IC50 = 288 nM), molekula 2d dokonce převýšila inhibiční schopnost takrinu (IC50 = 61 nM).
Obr. 2. Monotakriny připravené z chirálních terpenických cyklanonů 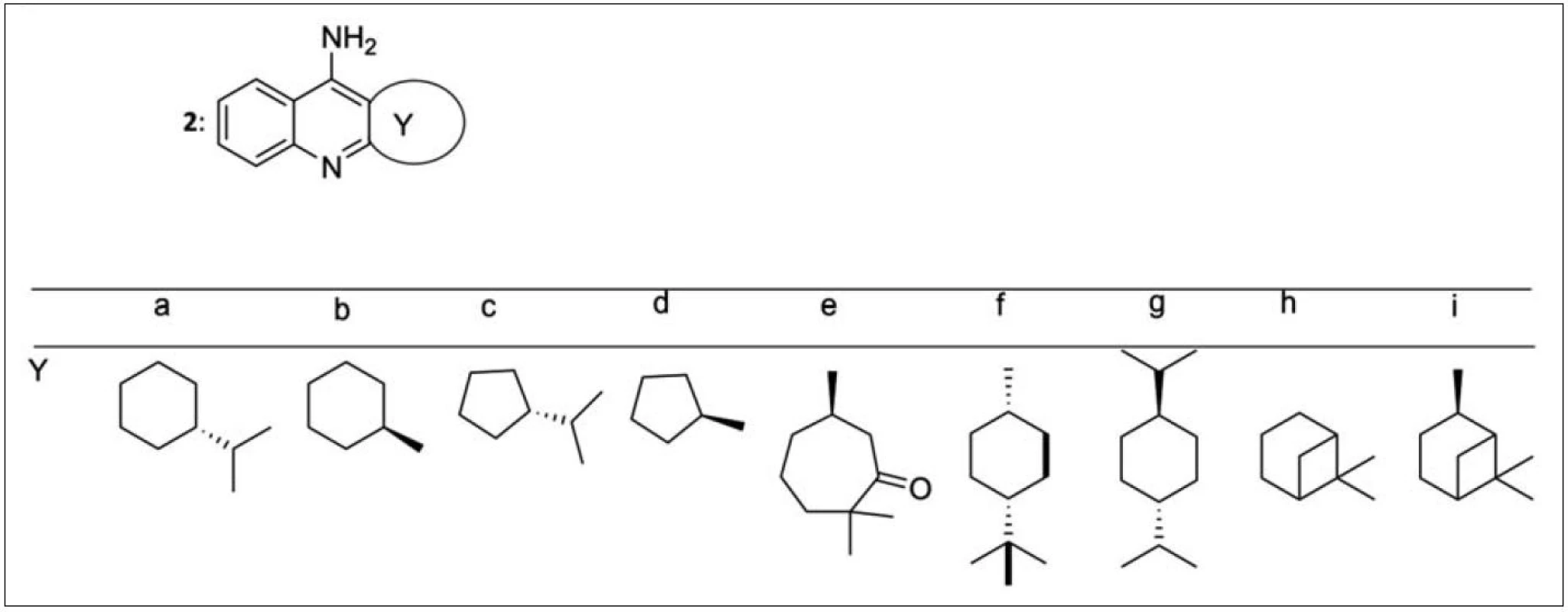
Další sérií sloučenin připravených slovenským pracovištěm v Košicích jsou monotakrinové deriváty lišící se substitucí v poloze 922). Porovnávány byly thiomočovinové nebo močovinové deriváty (3) vázané na základní skelet takrinu nebo analoga bez těchto funkcí (4). Sledován byl také vliv připojeného heterocyklického systému nebo dimethylaminoskupiny (obr. 3). Nejvyšší afinitu k AChE prokázal morfolinový derivát navázaný přes močovinovou funkční skupinu (IC50 = 972 nM) k takrinovému základu. Furanový derivát vázaný přes methylenový můstek k amino skupině takrinu vykázal nejlepší hodnotu IC50 k BChE (20, μμM).
Obr. 3. Takrinová analoga připravená substitucí v poloze 9 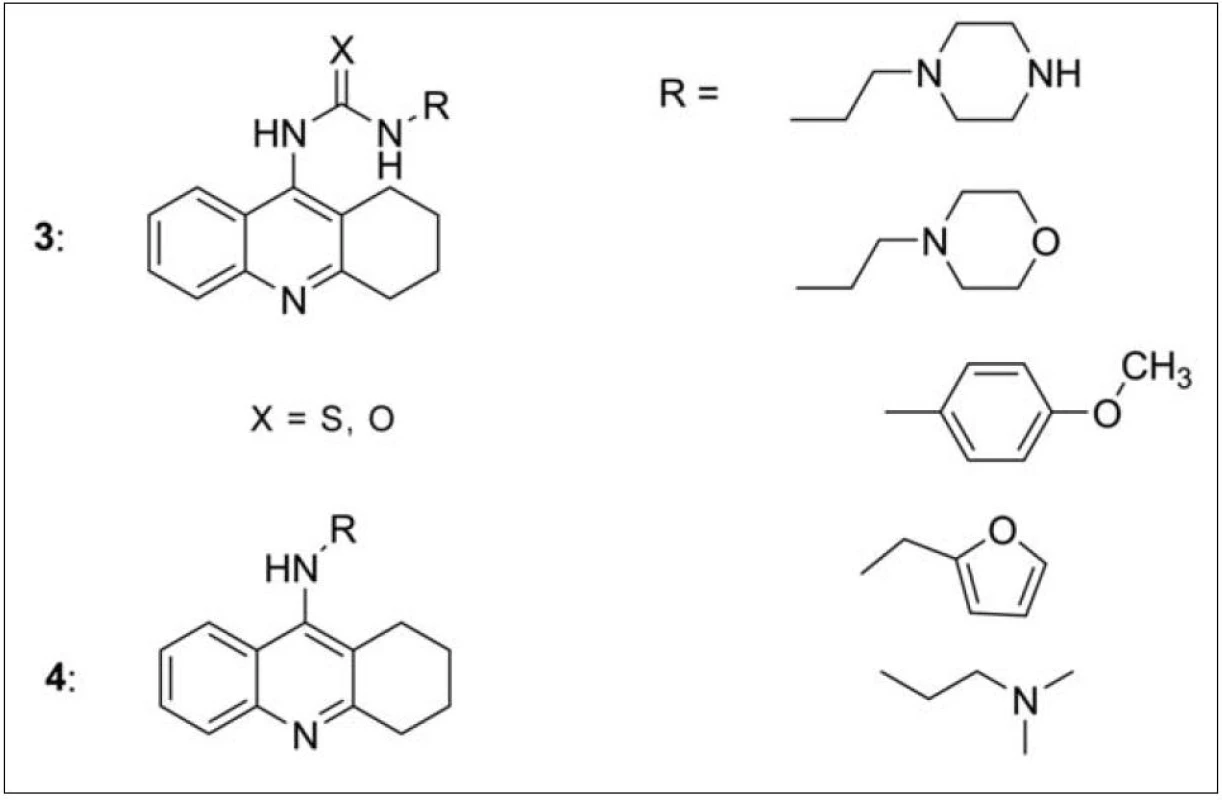
Takrindihydropyridinovou řadu (zkráceně takripyriny, 5) lze považovat za přechod od monotakrinů k duálně působícím inhibitorům AChE. Jak již název těchto sloučenin napovídá, jedná se o sérii látek sdružující jak inhibičně působící část molekuly vůči ChE (takrin), tak i dihydropyridinové uskupení antagonisticky působící na kalciovém kanálu (obr. 4). Blokátory kalciových kanálů mají silný neuroprotektivní účinek, který zůstává zachován i v molekule takripyrinů23, 24).
Obr. 4. Takrindihydropyridiny – látky připravené spojením takrinu a 1,4-dihydropyridinu 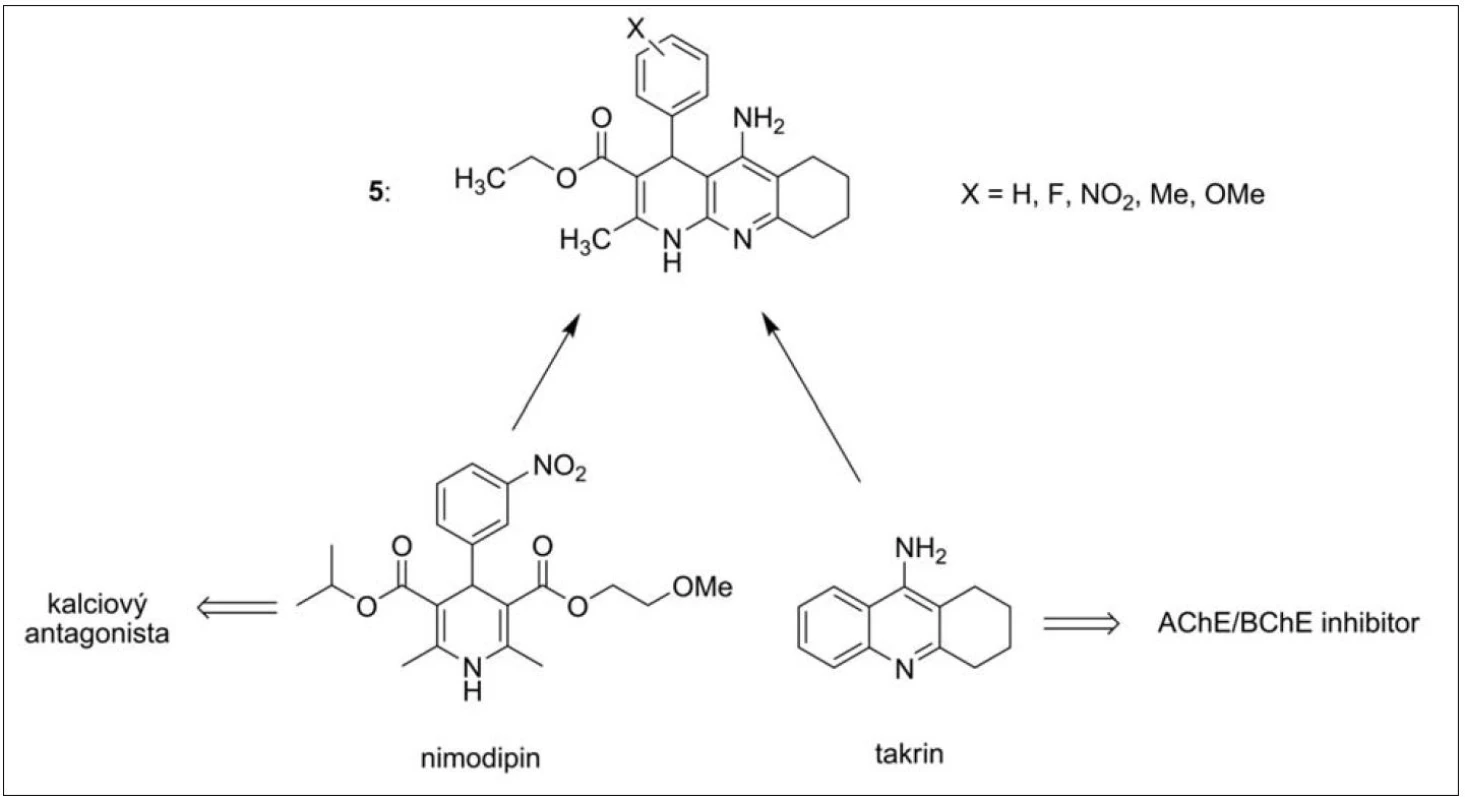
Takripyriny mající na benzenovém jádře v poloze 3 methoxy skupinu prokázaly nejvyšší účinnost vůči AChE (IC50 = 58 nM). Všechny inhibitory v této sérii shodně vykazovaly vysokou selektivitu k AChE23, 24).
Další početnou skupinu takrinových sloučenin představují inhibitory AChE s nitrilovou skupinou v poloze 7 (obr. 5) (6). Vysokou účinnost i selektivitu k AChE měl derivát s dimethylaminovým uskupením v poloze 6 (IC50 = 14 nM). Podobně jako předchozí série takripyrinů i tyto sloučeniny působí neuroprotektivně25).
Obr. 5. Monotakriny s nitrilovou skupinou v poloze 7 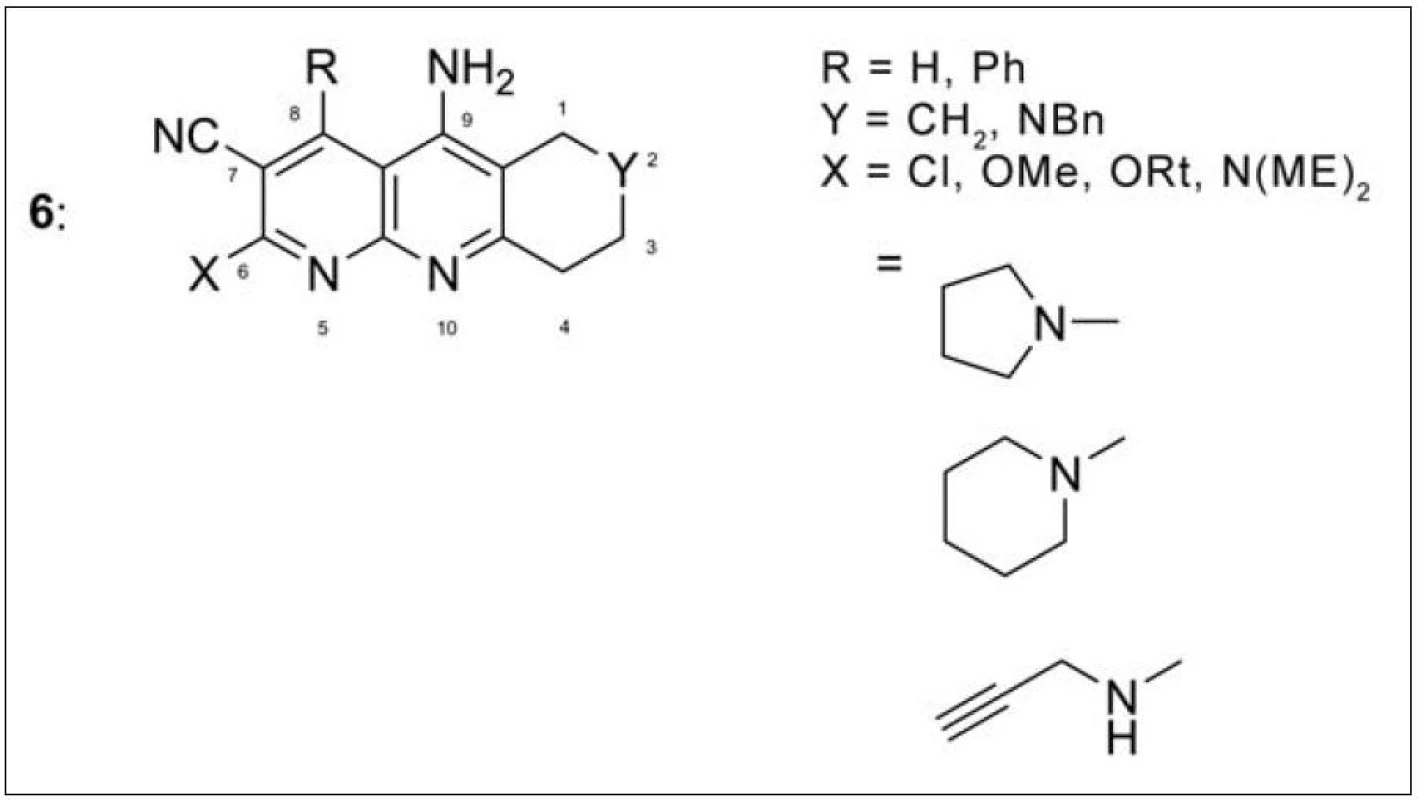
7-methoxytakrin (7-MEOTA) (obr. 6) byl vyvinut v České republice jako méně toxický derivát takrinu při zachování farmakologického profilu26). Nižší toxicita 7-MEOTA je vysvětlována pomocí hlavního metabolitu, 7-hydroxytakrinu, rovněž farmakologicky účinného analoga, který vzniká v organismu demetylací. 7-hydroxytakrin je následně konjugován s kyselinou glukuronovou a exkretován močí27). V rámci pokračování výzkumu se 7-MEOTA byly připraveny jeho nové deriváty, které se liší substitucí v poloze 9. Některé z nich převýšily účinnost 7-MEOTA i takrinu (obr. 6) (7)28–31).
Obr. 6. 7-MEOTA a nově připravené deriváty substitucí v poloze 9 základního skeletu 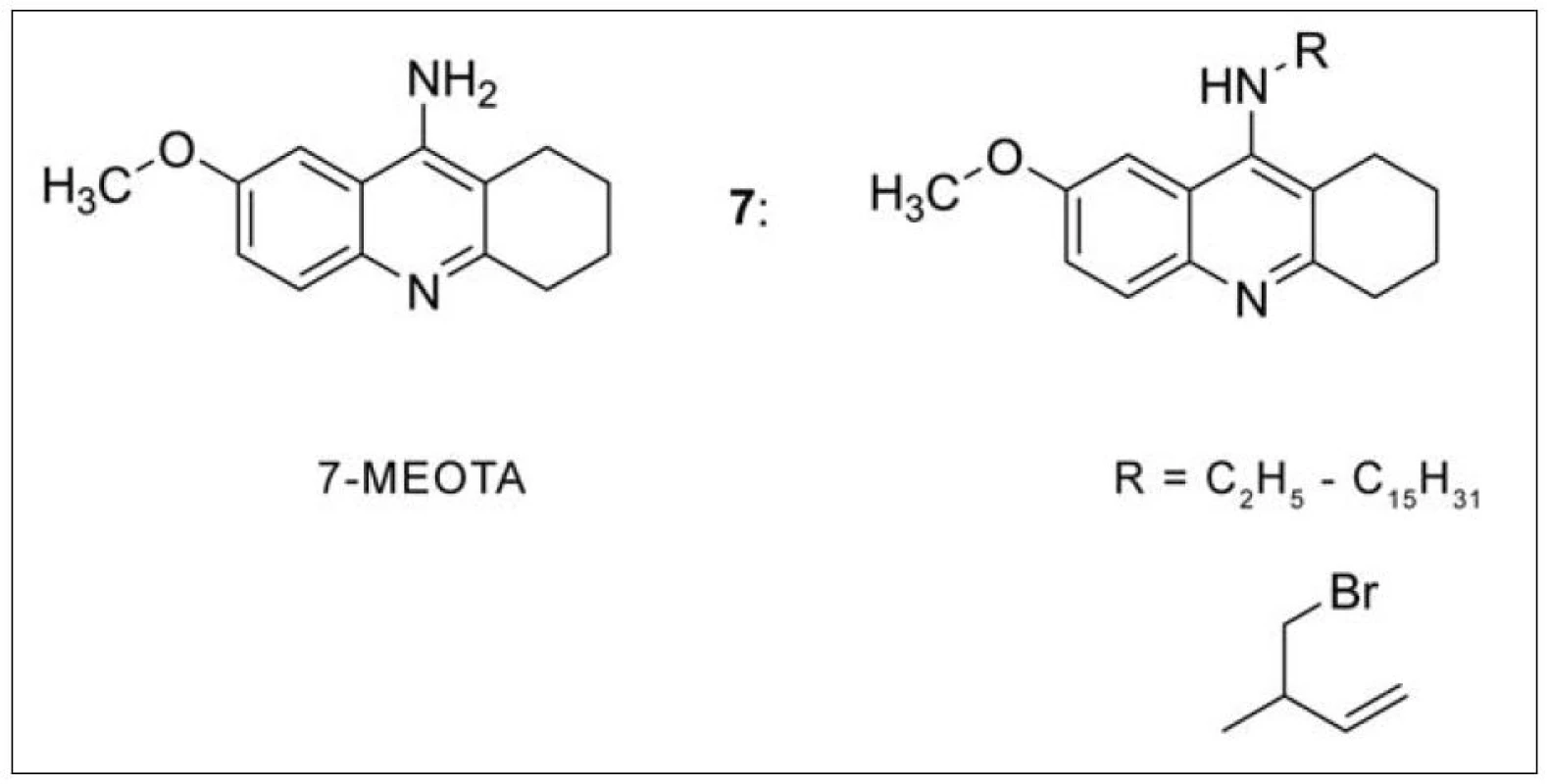
Bezesporu nejzajímavější sérií v oblasti monotakrinových látek jsou hupriny (obr. 11, 11). V jejich struktuře můžeme nalézt jak takrinový, tak i huperzinový fragment. V rámci studie vztahů mezi strukturou a účinkem byla připravena velká řada derivátů lišící se substitucí v takrinové i huperzinové části molekuly. Tato analoga předčila referenční látky (huperzin A, takrin) nejen v inhibičních vlastnostech vůči AChE a BChE, ale i v dalších biologických vlastnostech (inhibice agregace Aβ, antioxidační vlastnosti, chelatace těžkých kovů aj.)32–36).
Takrinové homodimery
První homodimery takrinu byly nejprve navrženy a následně i připraveny Pangem et al. v roce 199637). Předlohovou strukturou se stal bis-7-takrin (8: IC50/AChE = 0.81 nM, IC50/BChE = 5,66 nM) (obr. 7). Metodou molekulového modelování byla vypočítána jeho prostorová orientace v AChE z Torpedo californica (obr. 8)38). Preklinické studie odhalily nízkou perorální dostupnost bis-7-takrinu kvůli špatnému přechodu přes intestinální bariéru a vysokou míru hepatální transformace. Po i. m. aplikaci na myších dosáhl maxima plazmatické koncentrace za 15 minut a snadno prostoupil hematoencefalickou bariérou39). Bis-7-takrin splňuje předpoklad duální inhibice – váže se v periferním anionickém místě i katalytickém místě AChE (obr. 8)38). Z dalších účinků lze zmínit i slabé neuroprotektivní vlastnosti docílené inhibicí NMDA receptorů a neuronální NO synthasy. Mezi jeho pozitivní účinky lze zařadit i inhibici β-sekretasy (BACE-1) a antagonismus na GABA-ergních receptorech typu A40–42).
Obr. 7. Bis-7-takrin – první duální inhibitor AChE připravený v roce 1996 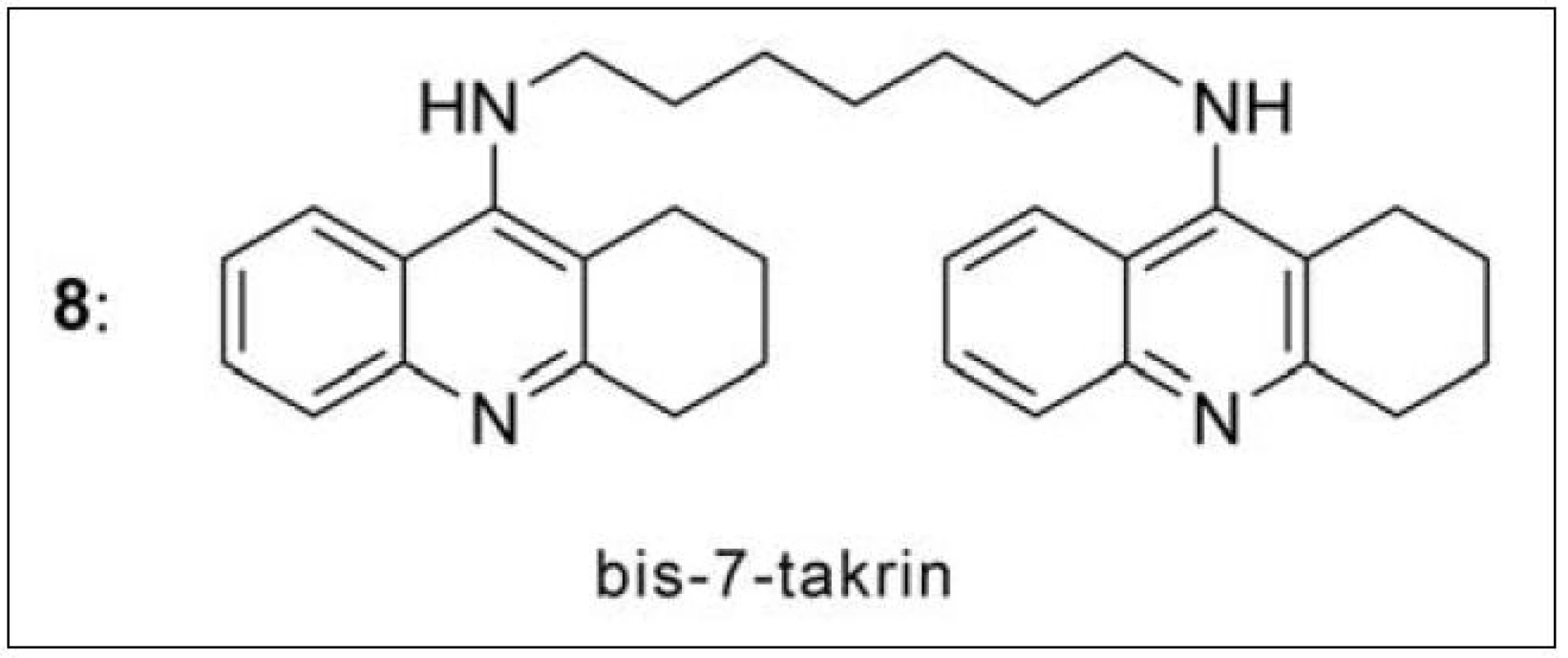
Obr. 8. Prostorová orientace bis-7-takrinu v AChE z Torpedo californica (PDB code: 2ckm) a významné interakce s aminokyselinovými rezidui. Látka působí v periferním anionickém místě (Trp279, Tyr70) i katalytické části enzymu (Trp84,Trp432) a svou délkou mezi oběma takrinovými částmi dává látce charakter duálního inhibitoru. Vzdálenost je udávána v angstromech (Å). Obrázek byl vytvořen pomocí PyMol viewer (v. 1.3.)<sup>38)</sup>. 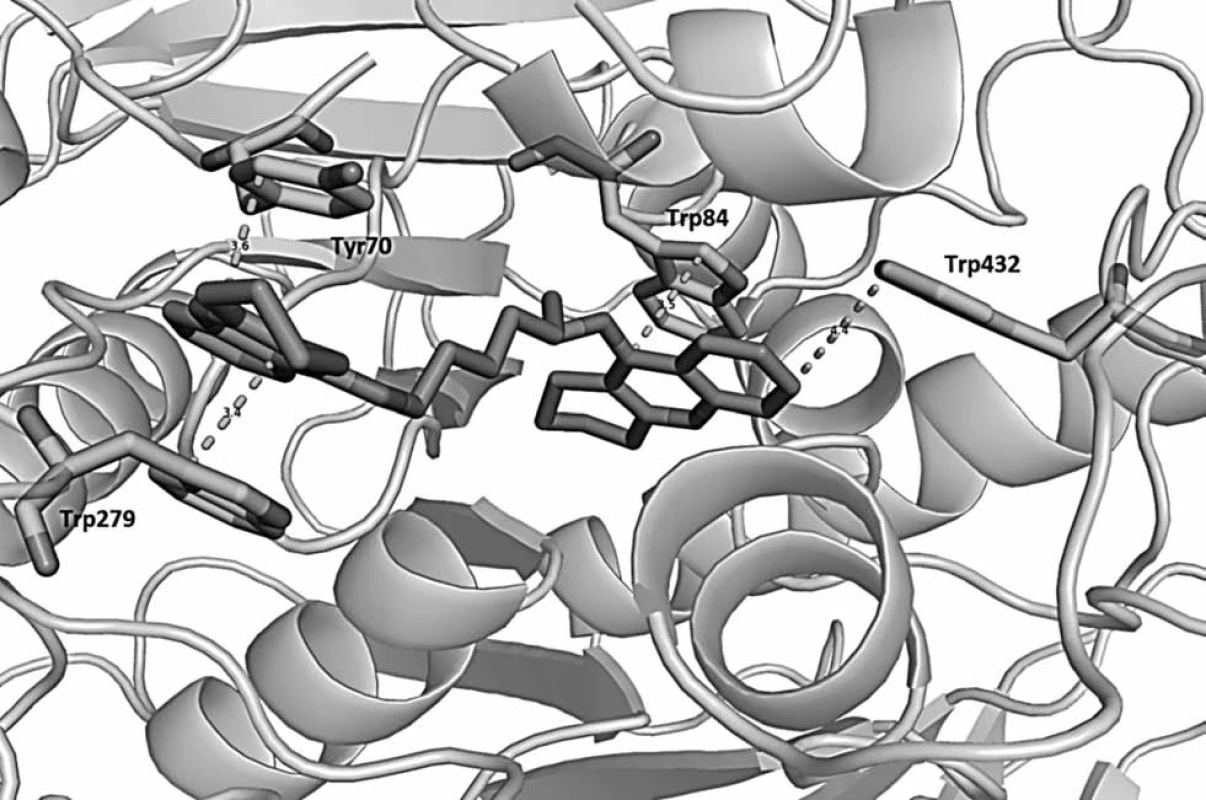
V souvislosti s připraveným bis-7-takrinem a jeho dobrými biologickými vlastnostmi byly nasyntetizovány a in vitro testovány zdvojené deriváty 7-MEOTA (9). Žádný z nich však nepřekonal aktivitu samotného takrinu ani bis-7-takrinu, což je pravděpodobně dáno nemožností volné rotace díky přemostění základního skeletu přes dva methylenové můstky (obr. 9)43).
Obr. 9. Zdvojené deriváty 7-MEOTA přemostěné dvěma alkylovými řetězci 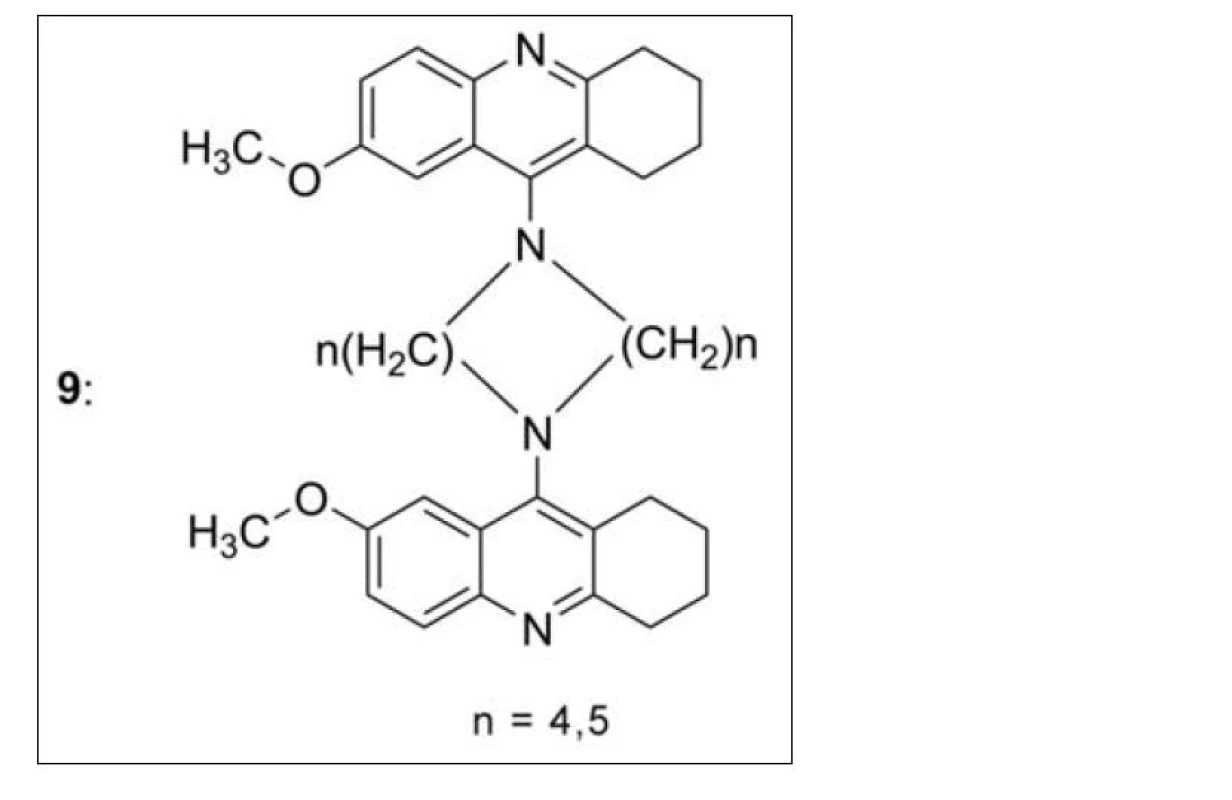
Takrinové heterodimery
Takrinové heterodimery představují nejširší a v současnosti nejvíce studovanou skupinu sloučenin. Podnět k jejich výzkumu přinesla syntéza a následně zjištěné biologické vlastnosti bis‑7‑takrinu. Základní skelet takrinu bývá u některých derivátů v této skupině nahrazen 6‑chlortakrinem, který více inhibuje AChE (IC50 = 8,32 nM)44, 45).
Na průkopnickou studii s bis-7-takrinem navázaly další práce, ve kterých dochází k pozvolnému přechodu k takrinovým heterodimerům46–51). Donepezil-takriny (10) byly publikovány D. Alonsem v roce 200546). Tyto hybridy se liší délkou spojovacího řetězce, nasyceností takrinového kruhu i charakterem spojovací funkční skupiny (obr. 10). Nejlepší výsledek v této sérii vykázala sloučenina s akridinovým základem připojená k donepezilové části (prezentované ftalimidem) přes osm methylenových skupin.
Obr. 10. Nejúčinnější sloučenina ze série takrin-donepezilových hybridů 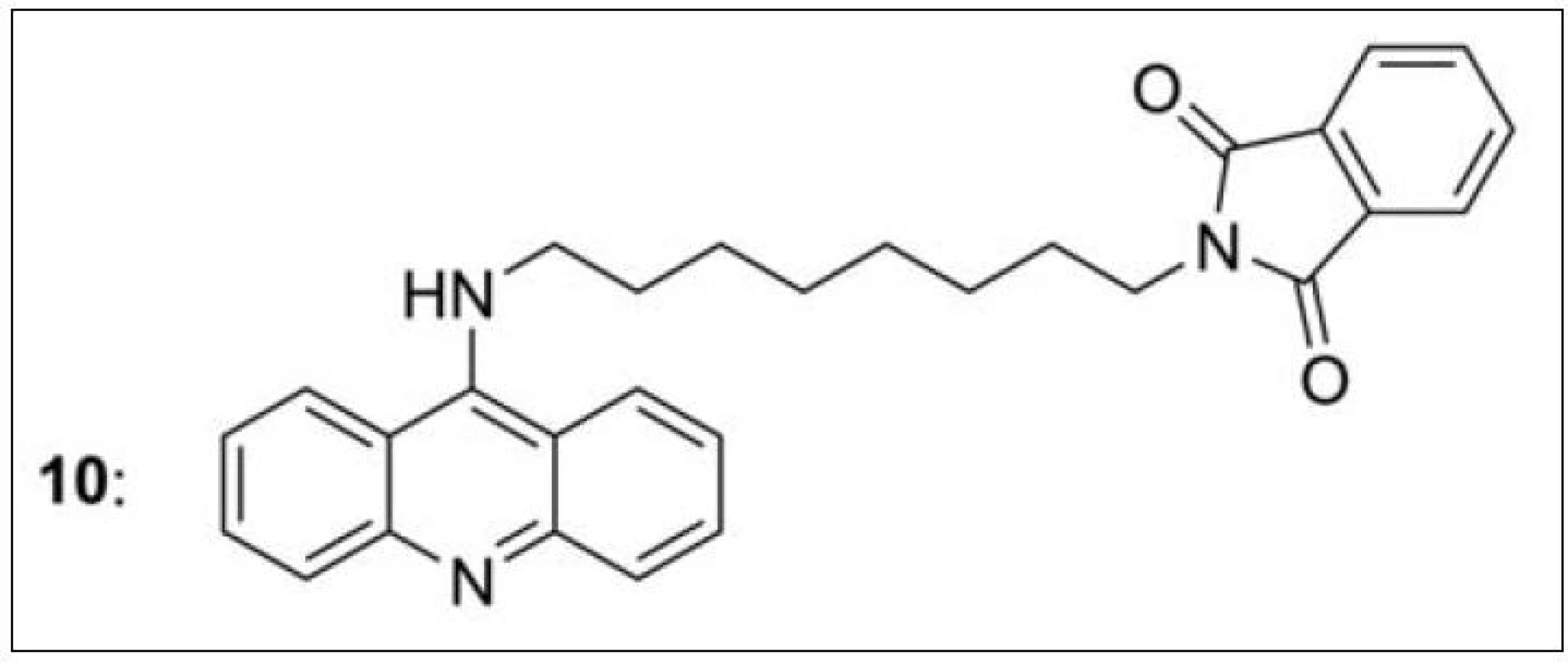
Další skupinou jsou heterodimery takrinu s huperzinem, které byly připraveny již v roce 1999, a navázaly tak na úspěšnou sérii huprinů (11, hybridní sloučeniny takrinu s huperzinem). Huperzin (obr. 11) je přírodní látka izolovaná z plavuně Huperzia serrata, která se odedávna využívá v čínském lidovém léčitelství. V některých oblastech světa dosáhla již klinické praxe (zejména v asijských státech), ve zbytku světa se nachází ve druhé fázi klinického testování. Svou pozornost přitahuje díky mnohočetným příznivým vlivům na organismus – působí protizánětlivě, antioxidačně, Aβ‑antiagregačně apod. V sérii takrin‑huperzinů (12) všechna nová analoga předčila ve své aktivitě předlohovou strukturu huperzinu A na AChE a dosáhla inhibičních koncentrací v řádu nM. Nejúčinnější sloučenina měla ve spojovacím řetězci 10 methylenových skupin52).
Obr. 11. Takrin-huperzinové deriváty a hupriny 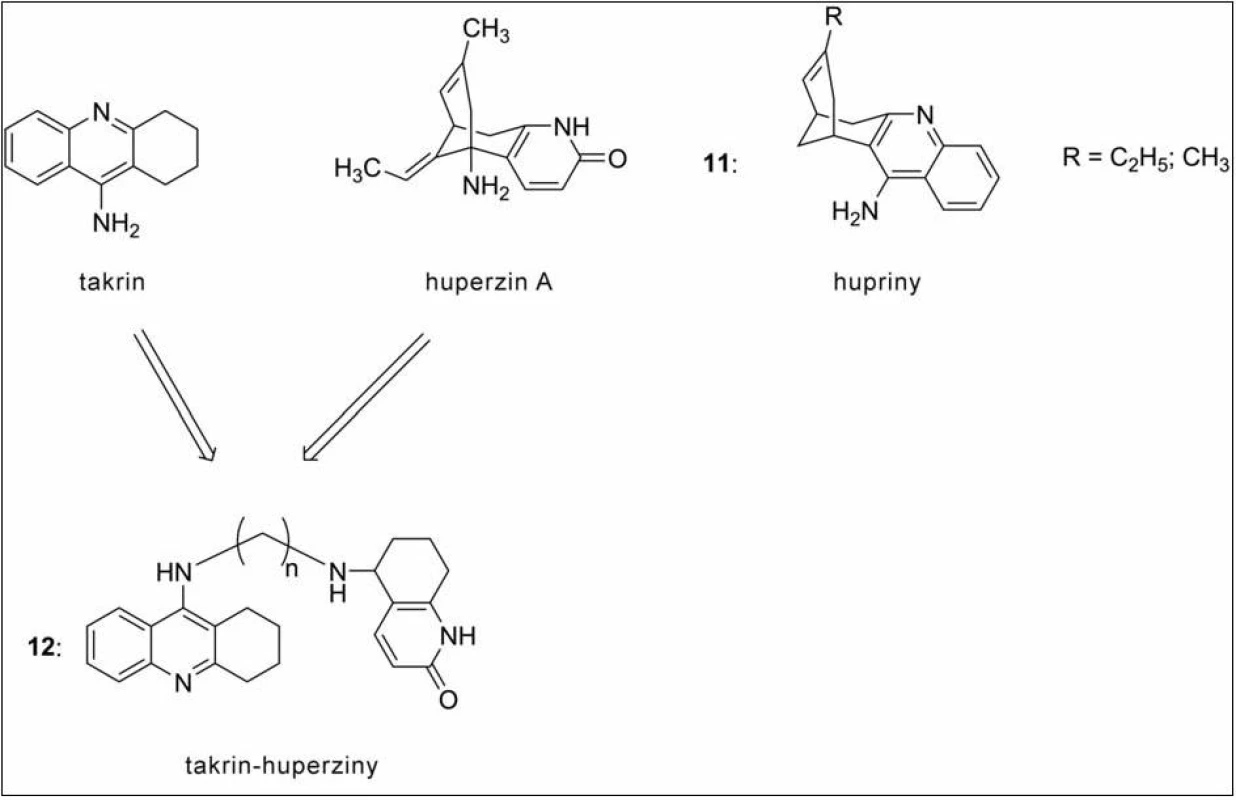
Jiná série sloučenin je představována heterodimery na bázi takrin-ferulové kyseliny (obr. 12) (13). Spojení takrinu v tomto případě přineslo nejen očekávané zvýšení inhibičního potenciálu vůči ChE, ale i zavedení výrazných antioxidačních schopností (dáno vlastnostmi kyseliny ferulové) a Aβ antiagregační schopnosti vyplývající z duální inhibice AChE53–56). Nejvyšší anti-AChE aktivitu projevila molekula s pěti uhlíky ve spojovacím řetězci, která více než desetkrát překonala takrin v jeho účinnosti na AChE (IC50 = 4,4 nM). O jednu methylenovou skupinu vyšší homolog byl dále studován z hlediska přechodu přes hematoencefalickou bariéru (HEB). Tento derivát zmírňuje skopolaminem navozenou paměťovou dysfunkci, z čehož lze předpokládat prostup látek této série přes HEB57).
Obr. 12. Heterodimery takrin-ferulové kyseliny jako silné antioxidanty a duální inhibitory v terapii AD 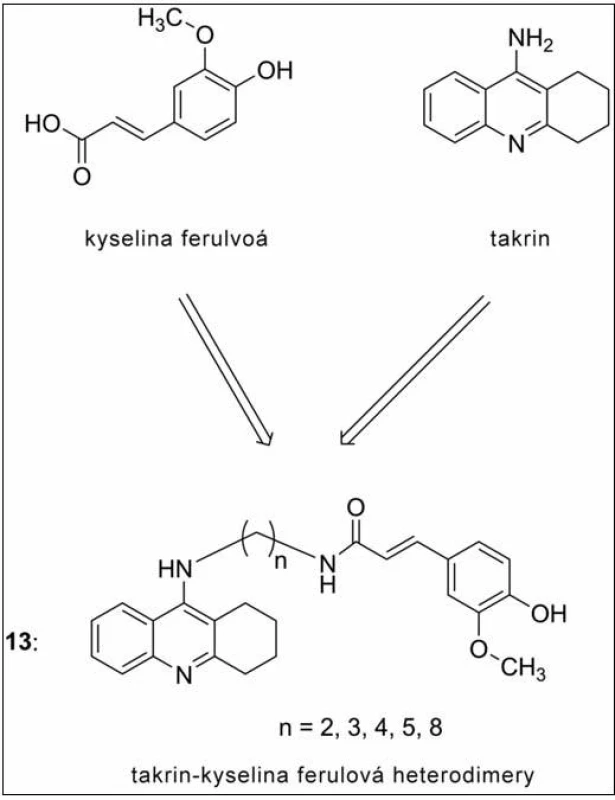
Další zajímavou skupinou jsou takrin-melatoninové heterodimery (obr. 13) (14)58). V průběhu AD ubývají antioxidační schopnosti celého organismu, a nervový systém je tak náchylný k neurodegeneraci59). Současný výzkum odhalil důležitou účast hormonu melatoninu v antioxidačních pochodech v průběhu AD. Jedná se o epifyzární hormon, jehož hladina s progresí onemocnění klesá60). Melatonin rovněž stimuluje endogenní antioxidativní enzymy, zlepšuje energetickou bilanci mitochondrií, snižuje míru hyperfosforylace a má neuroprotektivní vlastnosti anti-agregačním působením proti Aβ61). V připravené sérii je řada molekul s duálním mechanismem účinku na AChE (efektivní sub-nM koncentrace), všechny shodně vykázaly silné antioxidační vlastnosti a Aβ antiagregační schopnosti. Na základě testů umělé semipermeabilní membrány prochází převážná většina takrin-melaninových analog přes HEB62).
Obr. 13. Obecná struktura takrin-melatoninových inhibitorů (14, vlevo) a nejúčinnější látky z této série (vpravo) 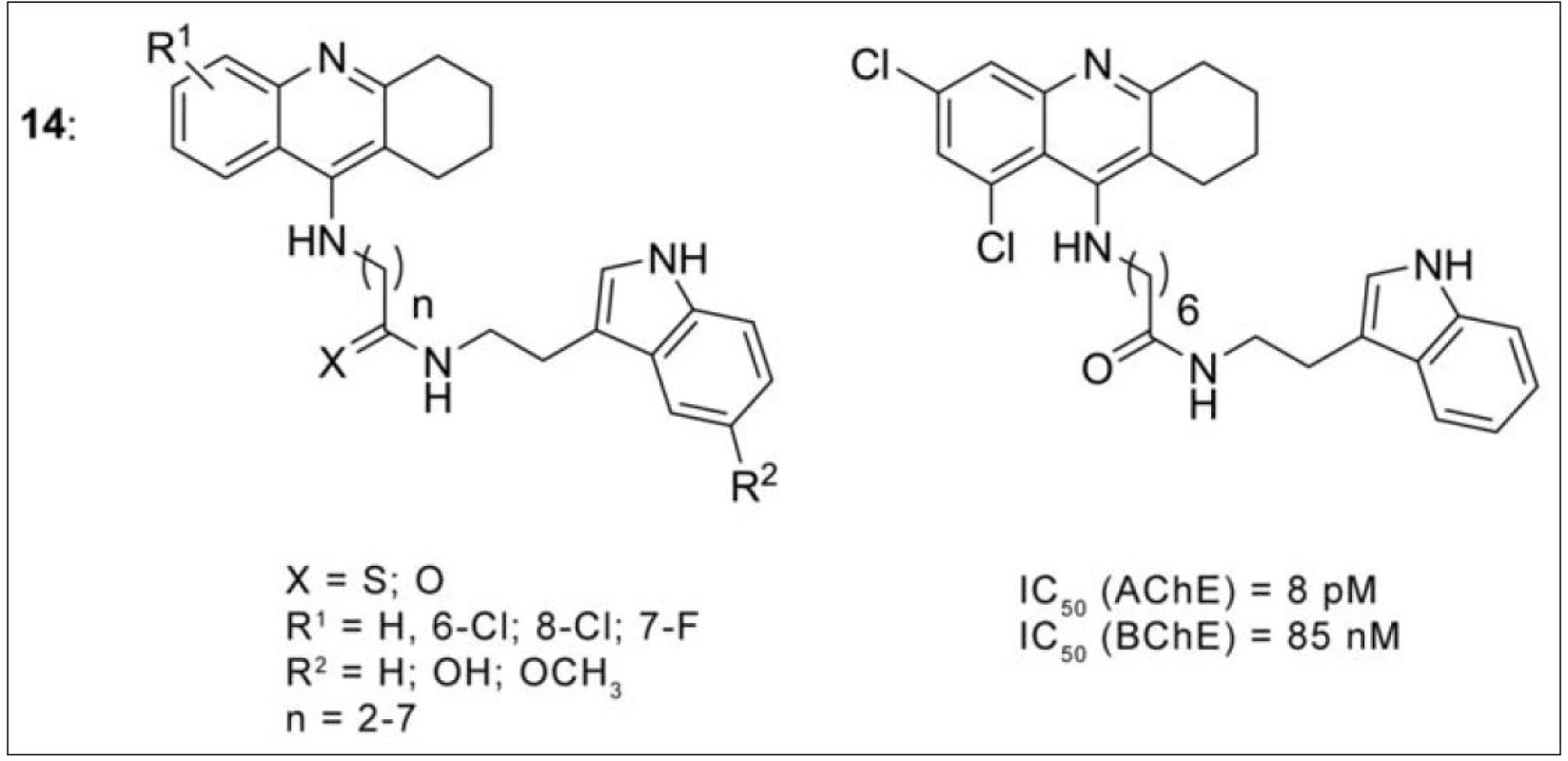
Karvedilol je látkou používanou k hypertenzní léčbě. Kromě toho disponuje i neuroprotektivními vlastnostmi dané slabou afinitou k NMDA receptorům63). Kombinace karbazolové části karvedilolu s 6-chlortakrinem dala vznik tzv. karvedilol-takrinové (15) skupině sloučenin (obr. 14). Všechny připravené látky z této série inhibují selektivně AChE, největší potenciál demonstrovala molekula s pěti methylenovými můstky ve spojovacím řetězci (IC50 = 1,54 nM). Tyto sloučeniny rovněž inhibují agregaci Aβ, a to jak indukovanou AChE, tak i autoagregačními pochody tohoto proteinu. Za zmínku stojí i antioxidační působení a již výše uvedené antagonistické působení na NMDA receptory64).
Obr. 14. Designová strategie takrin-karvedilol heterodimerů 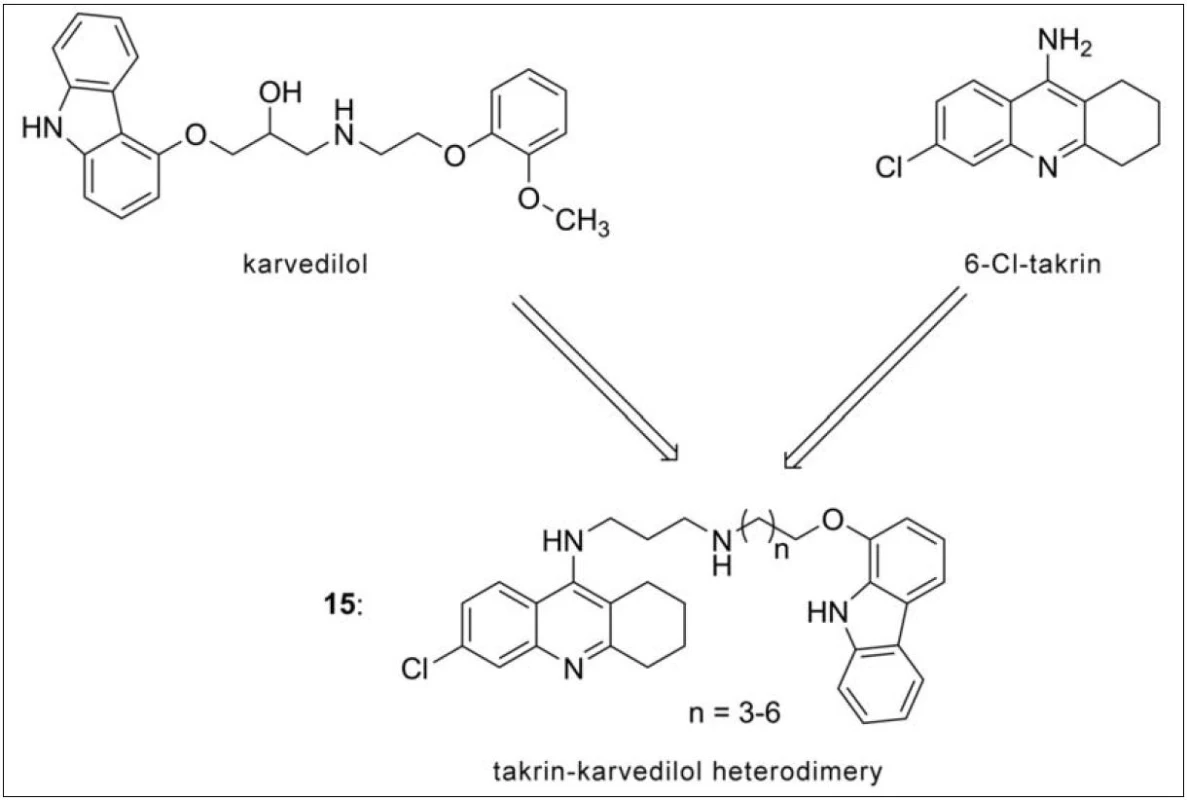
Oxid dusnatý (NO) má důležitou fyziologickou funkci v CNS, kde působí jako mediátor v imunitním systému, vazomotorice i neurotransmisi65). Při narušení jeho rovnováhy v organismu v průběhu AD hovoříme o tzv. nitrooxidativním stresu. V roce 2008 byla připravena série takrin-NO donorů (obr. 15). Chemicky se jedná o skupinu esterů kyseliny dusičné, které po aktivaci v organismu uvolňují NO. Všechny testované látky této řady prokázaly silnější inhibiční působení na oba cholinesterasové enzymy oproti takrinu. Při dalších studiích se ukázalo, že zmírňují skopolaminem navozené poruchy paměti, nezatěžují jaterní metabolismus a interagují duálně s AChE66). Látky s nejlepšími hodnotami IC50 jsou vyznačeny na obrázku 15 (16a, 16b).
Obr. 15. Látky s nejlepším profilem v sérii takrin-NO donorů 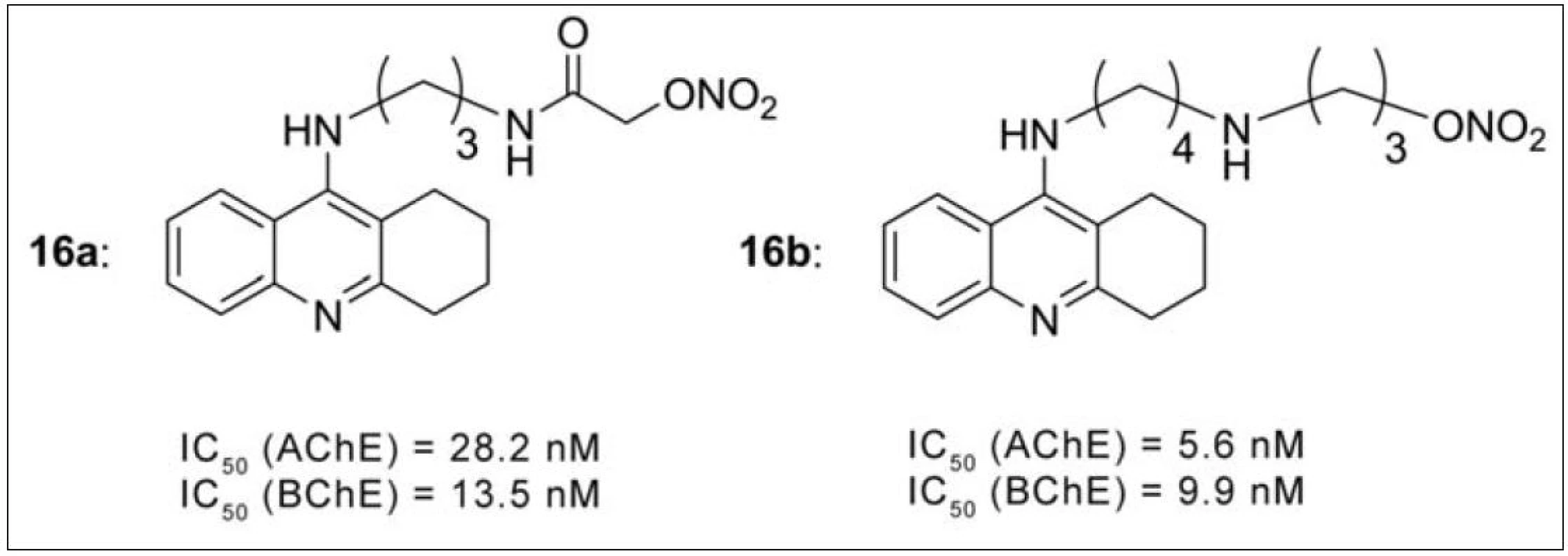
Design další série molekul vzešel ze spojení gallaminu, typického alosterického modulátoru M2 receptorů, s takrinem (obr. 16) (17). Gallamin je rovněž schopný inhibovat AChE v její periferní anionické části. Všechny deriváty ukázaly inhibiční potenciál v řádu nM koncentrací i vyšší alosterickou afinitu k M2 receptorům než standardy takrin a gallamin67).
Obr. 16. Takrin-gallaminová série (17), pro ilustraci je zobrazena i struktura samotného gallaminu 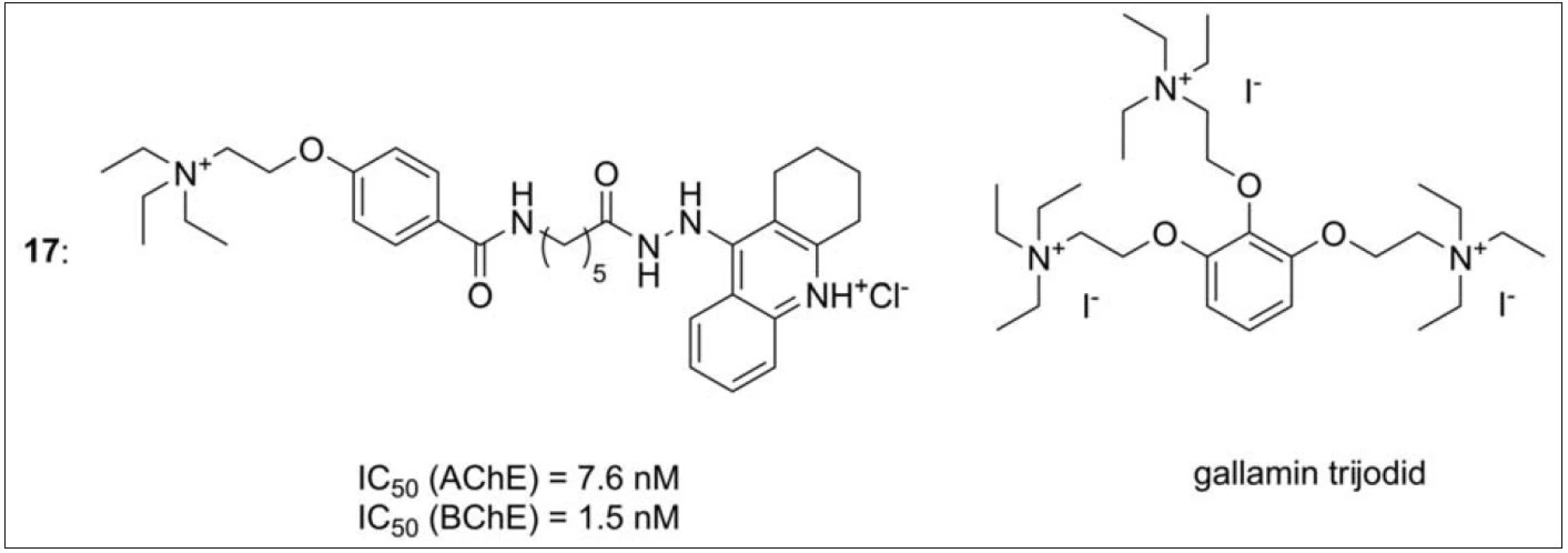
Záměnou benzylové části ve struktuře donepezilu takrinem vznikly takrin-donepezily (obr. 17) (18). Donepezil se váže na periferii AChE, zatímco takrin je inhibitor aktivního místa. Nové sloučeniny tak získaly duální mechanismus účinku a vysokou selektivitu k AChE. Tato série molekul si zachovává většinu z donepezilové skeletu (ta je prezentována 5,6‑dimethoxy-2-[(4-piperidinyl)methyl]-1-indanonem). U nových heterodimerů byla rovněž pozitivně hodnocena schopnost inhibovat tvorbu Aβ fibril indukovanou AChE68)
Obr. 17. Takrin-donepezilová řada (18). Nejvyšší afinitu k AChE demonstroval derivát s dvěma methylenovými můstky (n = 2) a kyslíkovým atomem v indanové části. 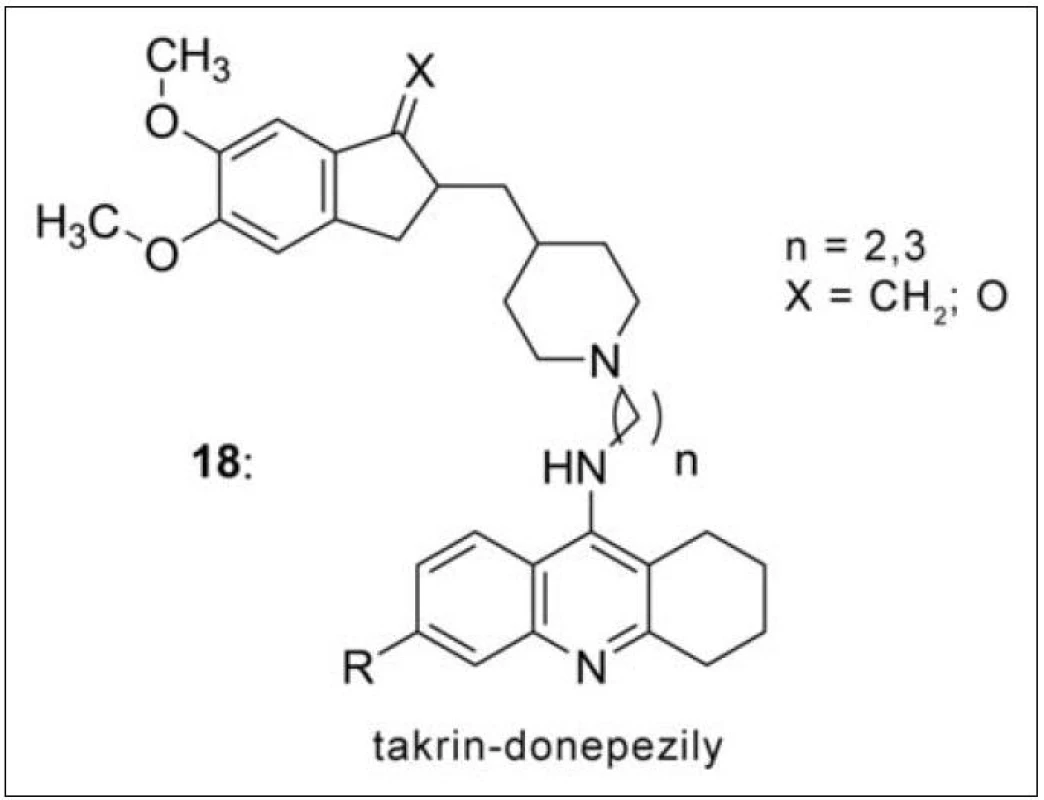
Propididum dijodid (propidium, 19) je prototypem periferního inhibitoru AChE (obr. 18). Jeho struktura zahrnuje kvartérní amoniovou funkci a aromatickou část a obě z nich mohou interagovat na periferii AChE pomocí kation-π a π-π interakcí. Spojení propidia, resp. jeho derivátu 5‑fenylpyrano[3,2-c]chinolinu, s 6-chlortakrinem (20) přineslo zvýšení inhibiční účinnosti, poměrně vysokou selektivitu k AChE, zabránění formování Aβ fibril indukovaných AChE a μM až nM efektivní koncentrace vůči β‑sekretase (obr. 18). Celá série byla sledována z hlediska prostupu HEB metodou umělé semipermeabilní membrány, přičemž shodně u všech látek byla zaznamenána pozitivní korelace 69).
Obr. 18. Deriváty propidia s 6-chlortakrinem 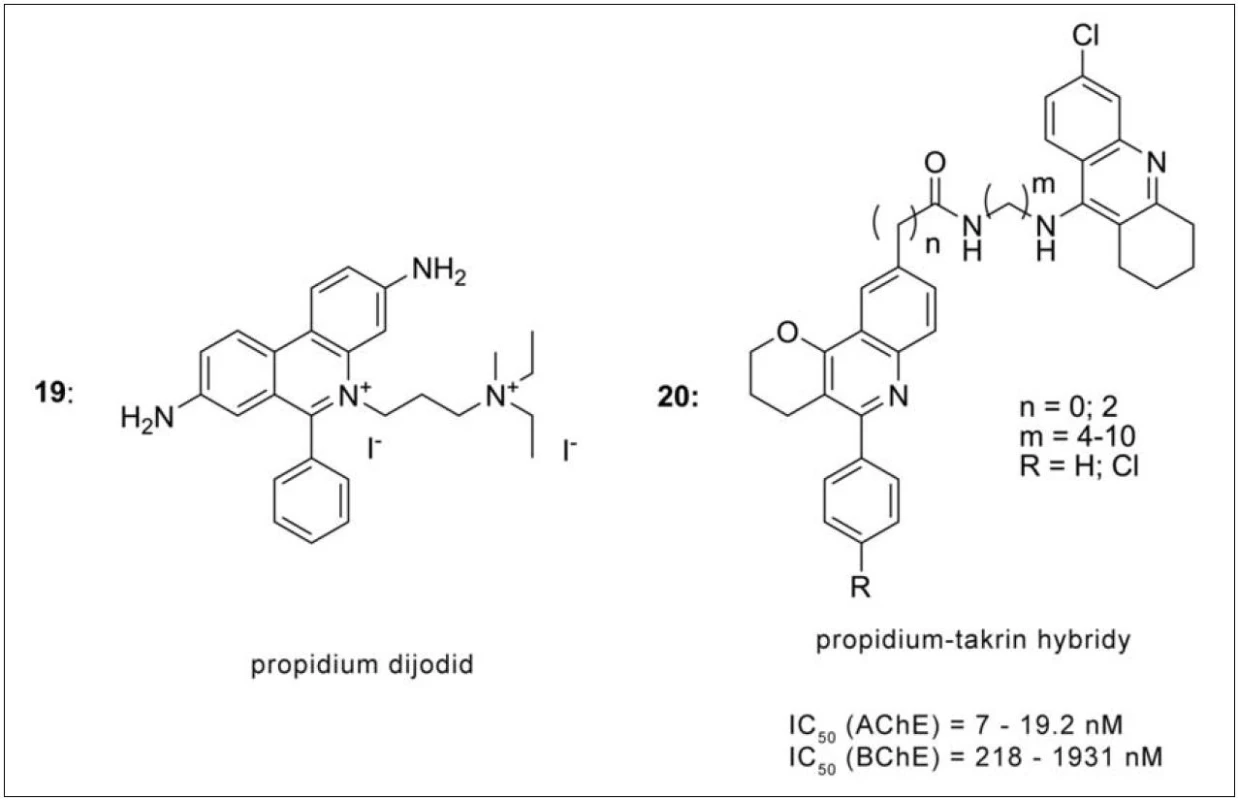
V poslední době se objevují nové práce poukazující na souvislost mezi AD a insuficiencí některých vitaminů, zejména vitaminů řady B70). Jedním z nich je niacin (vitamin B3), u kterého byla prováděna rozsáhlá klinická studie v souvislosti s demencí typu AD. Studie naznačila možný protektivní vliv niacinu v rozvoji AD nebo jiného typu demence71). V návaznosti na tyto poznatky byla připravena série takrin-niacinových derivátů Szymanski et al. (obr. 19) (21). U nich se opět předpokládá duální působení na AChE. Sloučeniny byly dosud testovány pouze na své cholinergní vlastnosti, žádná z nich však nepřekonala aktivitu takrinu pro obě testované ChE. Je však potřeba říci, že zatím se jedná o neucelenou sérii molekul s ohledem na délku spojovacího řetězce72).
Obr. 19. Takrin-niacinové deriváty 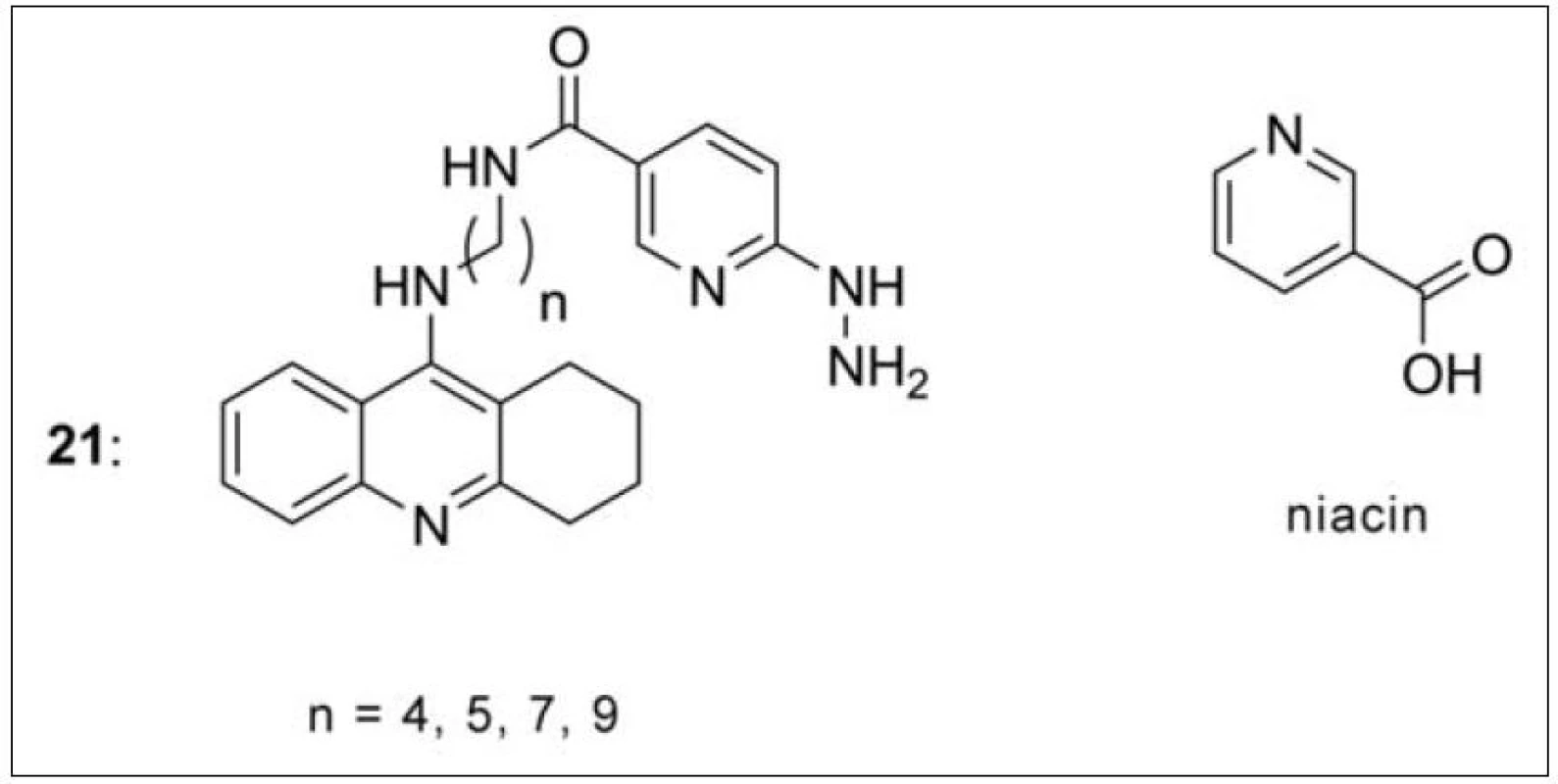
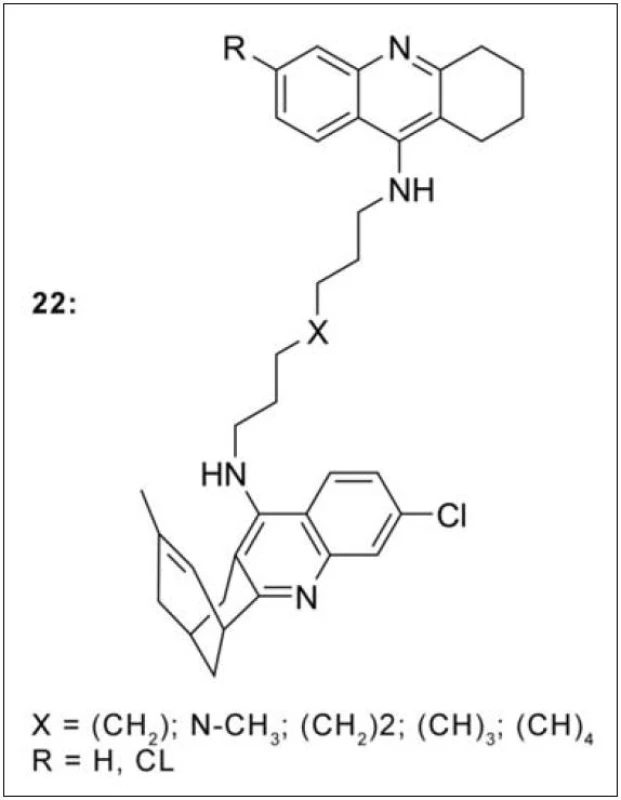
Jednou z nejnovějších a zároveň nejvíce prostudovaných sérií sloučenin z hlediska preklinického testování je skupina heterodimerů vzniklá spojením takrinu nebo 6‑chlortakrinu s huprinem Y (22, derivát huperzinu a takrinu) (obr. 20). Takrin-hupriny blokují aktivní i periferní místo AChE, prakticky zcela zamezují agregaci Aβ, a to přímým vlivem na tento peptid nebo skrze inhibici periferního místa AChE. Působí také inhibičně vůči β‑sekretase a na základě modelu umělé membrány (PAMPA-BBB test) prostupují snadno hematoencefalickou bariérou73).
V návaznosti na výše uvedenou sérií thiomočovinových resp. močovinových monotakrinů (viz obr. 3), které vykázaly zajímavou míru selektivity k AChE, byla připravena série duálně působících heterodimerů takrinu obsahující piperazinový fragment ve spojovací části řetězce. Piperazin byl zvolen jako zástupce aminů s širokým biologickým účinkem, ke kterému je z jedné strany připojena terciární amino skupina a ze strany druhé takrinový skelet (obr. 21). Interakce s oběma částmi AChE byla následně potvrzena metodami in silico. Všechny připravené sloučeniny převýšily inhibiční potenciál srovnávacích standardů takrinu a 7-MEOTA pro AChE, efektivní koncentrace takrinu pro BChE nebyla překročena. Zajímavým se profiloval zejména analog 21i (s připojeným takrinem k piperazinu přes amidický můstek), který in vitro vykázal vysokou míru selektivity vůči AChE (obr. 21)74).
Obr. 21. Takrin-piperazinová série 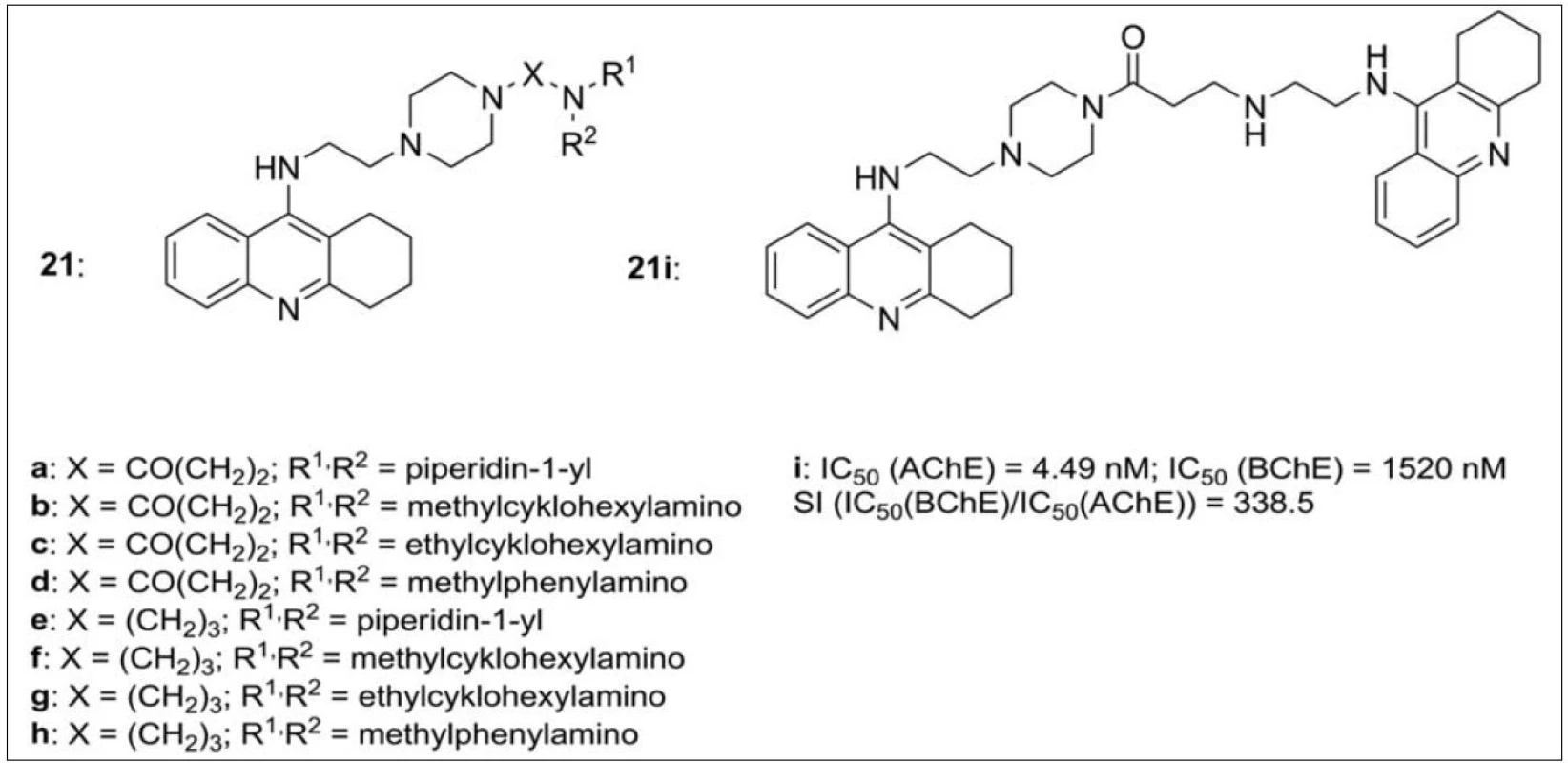
Závěr
Inhibitory cholinesteras mají v současné době nejrozšířenější zastoupení v terapii AD. Nejvíce probádanou a dále intenzivně zkoumanou skupinu představují inhibitory cholinesteras na bázi takrinu. Pro zvýšení účinnosti vůči AChE bývá takrin často zaměňován za 6‑chlortakrin, pro nižší výskyt nežádoucích účinků je pak používána 7-MEOTA. Prvotní výzkum byl zaměřen na tzv. monotakrinové deriváty, u kterých byl sledován vliv velikosti nasyceného kruhu v takrinovém základu, substituce v různých polohách (zejména 6-,7 - a 9-) a v neposlední řadě chiralita (terpenické monotakriny). Velkým mezníkem ve vývoji předznamenala syntéza bis-7-takrinu, prvního duálně působícího homodimerního analoga. U této sloučeniny lze pozorovat nárůst v účinnosti inhibice na AChE, dané jeho prostorovým uspořádáním v aktivní části enzymu. Objevují se rovněž nové biologické vlastnosti, jako je např. inhibice agregace Aβ. Nevýhodou bis-7-takrinu byla jeho nízká perorální dostupnost a vysoká míra hepatální transformace na neúčinný metabolit. Bis‑7‑takrin však odstartoval nový směr vedoucí k syntézám četných heterodimerních i homodimerních sloučenin takrinu. Vznikají tak zcela nové entity duálně působících agens se zvýšeným inhibičním působením vůči oběma cholinestarasam, sloučeniny blokující agregaci Aβ do fibril (dané inhibicí periferního anionického místa AChE) často se současným depolymerizačním efektem již vytvořených spletenců Aβ. Nové molekuly mají mnohdy navíc antioxidační vlastnosti, inhibují BACE-1 a jiné enzymové systémy účastnící se patologických pochodů v průběhu AD (monoaminoxidasa, GSK-3β), disponují chelatačními vlastnostmi vůči těžkým kovům nebo alostericky modulují receptory (muskarinové, nikotinové, GABA) aj. Vývoj nových duálně působících inhibitorů na bázi takrinu tak neustále pokračuje.
Střet zájmů: žádný.
Adresa pro korespondenci:
prof. Ing. Kamil Kuča, Ph.D.
Univerzita Obrany,
Fakulta vojenského zdravotnictví,
Centrum pokročilých studií a Fakultní nemocnice Hradec Králové
Sokolská 581, 500 05 Hradec Králové
e-mail: kucakam@pmfhk.cz
Zdroje
1. Alzheimer’s Association: 2012 Alzheimer’s disease facts and figures. Alzheimers Dement. 2012; 8, 131–168.
2. Chopra K., Misra S., Kuhad A. Current perspectives on pharmacotherapy of Alzheimer’s disease. Expert Opin. Pharmacother. 2011; 12, 335–350.
3. Launer L. J., Fratiglioni L., Andersen K., Breteler M. M. B., Copeland R. J. M., Dartiques J. F., Lobo A., Martinez-Lage J., Soininen H., Hofman A. Regional differences in the incidence of dementia in Europe: EURODEM collaborative analyses 1999. Collective authors of Alzheimer Europe organization: Dementia in Europe Yearbook: 2008, 20; 1–178.
4. Weiner M. W., Aisen P. S., Clifford R. J. Jr., Jagust W. J., Trojanowski J. Q., Shaw L., Saykin A. J., Morris J. C., Cairns N., Beckett L. A., Toga A., Green R., Walter S., Soares H., Snyder P., Siemers E., Potter W., Cole P. E., Schmidt M. The Alzheimer’s disease neuroimaging initiative: Progress report and future plans. Alzheimers Dement. 2010; 6, 202–211.
5. Green R. C., Cupples L. A., Go R., Benke K. S., Edeki T., Griffith P. A., Williams M., Hipps Y., Graff-Radford N., Bachman D., Farrer L. A. MIRAGE Study Group. Risk of dementia among white and African-American relatives of patients with Alzheimer’s disease. J. Am. Med. Assoc. 2002; 287, 329–336.
6. Drtinová L., Pohanka M. Alzheimerova demence: aspekty současné farmakologické léčby. Čes. slov. Farm. 2011; 60, 219–228.
7. Bartus R. T., Dean R. L., Beer B., Lippa A. S. The cholinergic hypothesis of geriatric memory dysfunction. Science 1982; 217, 408–414.
8. Bartus R. T., Dean R. L., Goas J. A., Lippa A. S. Age-related changes in passive avoidance retention: modulation with dietary choline. Science 1980; 209, 301–303.
9. Perry E. K., Tomlinson B. E., Blessed G., Perry R. H., Cross A. J., Crow T. T. Noradrenergic and cholinergic systems in senile dementia of Alzheimer type. Lancet 1981; 2, 8238–8249.
10. Drachman D. A. Memory and cognitive function in man: does the cholinergic system have a specific role? Neurology 1977; 27, 783–790.
11. Bowen D. M., Smith C. B., White P., Davison A. N. Neurotransmitter-related enzymes and indices of hypoxia in senile dementia and other abiotrophies. Brain 1976; 99, 459–496.
12. Davies P., Maloney A. J. F. Selective loss of central cholinergic neurones in Alzheimer’s disease. Lancet 1976; 2, 1403.
13. Perry E. K., Gibson P. H., Blessed G., Perry R. H., Tomlinson B. E. Neurotransmitter enzyme abnormalities in senile dementia. Choline acetyltransferase and glutamic acid decarboxylase activities in necropsy brain tissue. J. Neurol. Sci. 1977; 34, 247–265.
14. Drachman D. A., Leavitt J. Human memory and the cholinergic system. Arch. Neurol. 1974; 30, 113–121.
15. Bartus R. T., Dean R. L., Beer B., Lippa A. S. The cholinergic hypothesis of geriatric memory dysfunction. Science 1982; 217, 408–417.
16. Albert A. The chemical and biological properties of acridines. Sci. Prog. 1949; 37, 418–434.
17. Valenti P., Rampa A., Bisi A., Andrisano V., Cavrini V., Fin L., Buriani A., Giusti P. Acetylcholinesterase inhibition by tacrine analogues. Bioorg. Med. Chem. Lett. 1997; 7, 2599–2602.
18. Lee N. Y., Choi H. O., Kang Y. S. The acetylcholinesterase inhibitors competitively inhibited an acetyl L-carnitine transport through the blood-brain barrier. Neurochem. Res. 2012; 37, 1499–1507.
19. Inestrosa N. C., Alvarez A., Pérez C. A., Moreno R. D., Vicente M., Linker C., Casanueva O. I., Soto C., Garrido J. Acetylcholinesterase accelerates assembly of amyloid-beta-peptides into Alzheimer’s fibrils: possible role of the peripheral site of the enzyme. Neuron. 1996; 16, 881–891.
20. Recanatini M., Cavalli A., Belluti F., Piazzi L., Rampa A., Bisi A., Gobbi S., Valenti P., Andrisano V., Bartolini M., Cavrini V. SAR of 9-amino-1,2,3,4-tetrahydroacridine-based acetylcholinesterase inhibitors: Synthesis, enzyme inhibitory activity, QSAR, and structure-based CoMFA of tacrine analogues. J. Med. Chem. 2000; 43, 2007–2018.
21. dos Santos Pisoni D., Sobieski da Costa J., Gamba D., Petzhold C. L., de Amorim Borges A. C., Ceschi M. A., Lunardi P., Saraiva Gonçalves C. A. Synthesis and AChE inhibitory activity of new chiral tetrahydroacridine analoques from terpenic cyclanones. Eur. J. Med. Chem. 2010; 45, 526–535.
22. Hamuľakova S., Kristian P., Jun D., Kuca K., Imrich J., Danihel I., Bőhm S., Klika K. D. Synthesis, structure, and cholinergic effect of novel neuroprotective compounds bearing the tacrine pharmacophore. Heterocycles 2008; 76, 1219–1235.
23. Marco-Contelles J., León R., de Los Ríos C., Guglietta A., Terencio J., López M. G., García A. G., Villarroya M. Novel multipotent tacrine-dihydropyridine hybrids with improved acetylcholinesterase inhibitory and neuroprotective activities as potential drugs for the treatment of Alzheimer’s disease. J. Med. Chem. 2006; 49, 7607–7610.
24. Marco-Contelles J., León R., de los Ríos C., Samadi A., Bartolini M., Andrisano V., Huertas O., Barril X., Luque F. J., Rodríguez-Franco M. I., López B., López M. G., García A. G., Carreiras Mdo. C., Villarroya M. Tacripyrines, the first tacrine-dihydropyridine hybrids, as multitarget-directed ligands for the treatment of Alzheimer’s disease. J. Med. Chem. 2009; 52, 2724–2732.
25. Samadi A., Valderas C., de los Ríos C., Bastida A., Chioua M., González-Lafuente L., Colmena I., Gandía L., Romero A., Del Barrio L., Martín-de-Saavedra M. D., López M. G., Villarroya M., Marco-Contelles J. Cholinergic and neuroprotective drugs for the treatment of Alzheimer and neuronal vascular diseases. II. Synthesis, biological assessment, and molecular modelling of new tacrine analogues from highly substituted 2-aminopyridine-3-carbonitriles. Bioorg. Med. Chem. 2011; 19, 122–133.
26. Dejmek L. 7-MEOTA. Drugs Future 1990, 15, 126–129.
27. Patocka J., Jun D., Kuca K. Possible role of hydroxylated metabolites of tacrine in drug toxicity and therapy of Alzheimer’s disease. Curr. Drug Metab. 2008; 9, 332–335.
28. Korabecny J., Musilek K., Holas O., Binder J., Zemek F., Marek J., Pohanka M., Opletalova V., Dohnal V., Kuca K. Synthesis and in vitro evaluation of N-alkyl-7-methoxytacrine hydrochlorides as potential cholinestrase inhibitors in Alzhemeir disease. Bioorg. Med. Chem. Lett. 2010; 20, 6093–6095.
29. Korabecny J., Musilek K., Holas O., Nepovimova E., Jun D., Zemek F., Opletalova V., Patocka J., Dohnal V., Nachon F., Hroudova J., Fisar Z., Kuca K. Synthesis and in vitro evaluation of N-(bromobut-3-en-2-yl)-7-methoxy-1,2,3,4-tetrahydroacridin-9-amine as a cholinesterase inhibitor with regard to Alzheimer‘s disease treatment. Molecules 2010; 15, 8804–8812.
30. Korabecny J., Musilek K., Zemek F., Horova A., Holas O., Nepovimova E., Opletalova V., Hroudova J., Fisar Z., Jung Y.-S., Kuca K. Synthesis and in vitro evaluation of 7-methoxy-N-(pent-4-enyl)-1,2,3,4-tetrahydroacridin-9-amine – new tacrine derivative with cholinergic properties. Bioorg. Med. Chem. Lett. 2011; 21, 6563–6566.
31. Hroudova J., Fisar Z., Korabecny J., Kuca K. In vitro effects of acetylcholinesterase inhibitors and reactivators on Complex I of electron transport chain. Neuroendocrinol. Lett. 2011; 32, 259–263.
32. Defaux J., Sala M., Formosa X., Galdeano C., Taylor M. C., Alobaid W. A., Kelly J. M., Wright C. W., Camps P., Muñoz - -Torrero D. Huprines as a new family of dual acting trypanocidal-antiplasmodial agents. Bioorg. Med. Chem. 2011; 19, 1702–1707.
33. Vanlaer S., Voet A., Gielens C., De Maeyer M., Compernolle F. Bridged 5,6,7,8-tetrahydro-1,6-naphthyridines, analogues of huperzine A: Synthesis, modelling studies and evaluation as inhibitors of acetylcholinesterase. Eur. J. Org. Chem. 2009; 643–654.
34. Camps P., Contreras J., Font-Bardia M., Morral J., Muñoz - -Torrero D., Solans X. Enantioselective synthesis of tacrine-huperzine A hybrids. Preparative chiral MPLC separation of their racemic mixtures and absolute configuration assignments by X-ray diffraction analysis. Tetrahedron-Asymmetr. 1998; 9, 835–849.
35. Ronco C., Jean L., Renard P.-Y. Improved synthetic pathway for the derivatization of huprine scaffold. Tetrahedron 2010; 66, 7399–7404.
36. Camps P., El Achab R., Morral J., Muñoz-Torrero D., Badia A., Baños J. E., Vivas N. M., Barril X., Orozco M., Luque F. J. New tacrine-huperzine A hybrids (huprines): Highly potent tight-binding acetylcholinesterase inhibitors of interest for the treatment of Alzheimer’s disease J. Med. Chem. 2000; 43, 4657–4666.
37. Pang Y. P., Quiram P., Jelacic T., Hong F., Brimijoin S. Highly potent, selective, and low cost bis-tetrahydroaminacrine inhibitors of acetylcholinesterase. Steps toward novel drugs for treating Alzheimer’s disease. J. Biol. Chem. 1996; 271, 23646–23649.
38. Rydberg E. H., Brumshtein B., Greenblatt H. M., Wong D. M., Shaya D., Williams L. D., Carlier P. R., Pang Y. P., Silman I., Sussman J. L. Complexes of alkylene-linked tacrine dimers with Torpedo californica acetylcholinesterase: Binding of bis5-tacrine produces a dramatic rearrangement in the active-site gorge. J. Med. Chem. 2006; 49, 5491–5500.
39. Yu H., Li W. M., Kan K. K., Ho J. M., Carlier P. R., Pang Y. P., Gu Z. M., Zhong Z., Chan K., Wang Y. T., Han Y. F. The physicochemical properties and the in vivo AChE inhibition of two potential anti-Alzheimer agents, bis(12)-hupyridone and bis(7)-tacrine. J. Pharm. Biomed. Anal. 2008; 46, 75–81.
40. Li W., Xue J., Niu C., Fu H., Lam C. S., Luo J., Chan H. H., Xue H., Kan K. K., Lee N. T., Li C., Pang Y., Li M., Tsim K. W., Jiang H., Chen K., Li X., Han Y. Synergistic neuroprotection by bis(7)-tacrine via concurrent blockade of N-methyl-D--aspartate receptors and neuronal nitric-oxide synthase. Mol. Pharmacol. 2007; 71, 1258–1267.
41. Li C., Carlier P. R., Ren H., Kan K. K., Hui K., Wang H., Li W., Li Z., Xiong K., Clement E. C., Xue H., Liu X., Li M., Pang Y., Han Y. Alkylene tether-length dependent gamma aminobutyric acid type A receptor competitive antagonism by tacrine dimers. Neuropharmacology 2007; 52, 436–443.
42. Zhou L., Liu Y. W., Peoples R. W., Yang M., Tian X., Ai Y. X., Pang Y. P., Li Z. W., Han Y. F., Li C. Y. Mechanism of bis(7)-tacrine inhibition of GABA: activated current in cultured rat hippocampal neurons. Neuropharmacology 2009; 57, 33–40.
43. Korabecny J., Holas O., Musilek K., Pohanka M., Opletalova V., Dohnal V., Kuca K. Synthesis and in vitro evaluation of new tacrine derivatives-bis-alkylene linked 7-MEOTA. Lett. Org. Chem. 2010; 7, 327–331.
44. Wlodek S. T., Antosiewicz J., McCammon J. A., Straatsma T. P., Gilson M. K., Briggs J. M., Humblet C., Sussman J. L. Binding of tacrine and 6‑chlorotacrine by acetylcholinesterase. Biopolymers 1996; 38, 109–117.
45. Rosini M., Simoni E., Bartolini M., Cavalli A., Ceccarini L., Pascu N., McClymont D. W., Tarozzi A., Bolognesi M. L., Minarini A., Tumiatti V., Andrisano V., Mellor I. R., Melchiorre C. Inhibition of acetylcholinesterase, beta-amyloid aggregation, and NMDA receptors in Alzheimer’s disease: a promising direction for the multi-target-directed ligands gold rush. J. Med. Chem. 2008; 51, 4381–4384.
46. Alonso D., Dorronsoro I., Rubio L., Muñoz P., Garcia-Palomero E., Del Monte M., Bidon-Chanal A., Orozco M., Luque F. J., Castro A., Medina M., Martinez A. Donepezil-tacrine hybrid related derivatives as new dual binding site inhibitors of AChE. Bioorg. Med. Chem. 2005; 13, 6588–6597.
47. Muñoz-Torrero D., Camps P. Dimeric and hybrid anti-Alzheimer drug candidates. Curr. Med. Chem. 2006; 13, 399–422.
48. Carlier P. R., Du D. M., Han Y., Liu J., Pang Y. P. Potent, easily synthesized huperzine A-tacrine hybrid acetylcholinesterase inhibitors. Bioorg. Med. Chem. Lett. 1999; 9, 2335–2338.
49. Musial A., Bajda M., Malawska B. Recent developments in cholinesterases inhibitors for Alzheimer’s disease treatment. Curr. Med. Chem. 2007; 14, 2654–2679.
50. Decker M. Recent advances in the development of hybrid molecules/designed multiple compounds with antiamnesic properties. Mini Rev. Med. Chem. 2007; 7, 221–229.
51. Li W. M., Kan K. K., Carlier P. R., Pang Y. P., Han Y. F. East meets West in the search for Alzheimer’s therapeutics - novel dimeric inhibitors from tacrine and huperzine A. Curr. Alzheimer Res. 2007; 4, 386–396.
52. Jiang H., Luo X., Bai D. Progress in clinical, pharmacological, chemical and structural biological studies of huperzine A: a drug of traditional Chinese medicine origin for the treatment of Alzheimer’s disease. Curr. Med. Chem. 2003; 10, 2231–2252.
53. Fang L., Kraus B., Lehmann J., Heilmann J., Zhang Y., Decker M. Design and synthesis of tacrine-ferulic acid hybrids as multipotent anti-Alzheimer drug candidates. Bioorg. Med. Chem. Lett. 2008; 18, 2905–2909.
54. Heilmann J., Calis I., Kirmizibekmez H., Schuhly W., Harput S., Sticher O. Radical scavenger activity of phenylethanoid glycosides in FMLP stimulated human polymorphonuclear leukocytes: structure-activity relationships. Planta Med. 2000; 66, 746–748.
55. Yan J. J., Cho J. Y., Kim H. S., Kim K. L., Jung J. S., Huh S. O., Suh H. W., Kim Y. H., Song D. K. Protection against beta-amyloid peptide toxicity in vivo with long-term administration of ferulic acid. Br. J. Pharmacol. 2001; 133, 89–96.
56. Davalos A., Gomez-Cordoves C., Bartolome B. Extending applicability of the oxygen radical absorbance capacity (ORAC fluorescein) assay. J. Agric. Food Chem. 2004; 52, 48–54.
57. Pi R., Mao X., Chao X., Cheng Z., Liu M., Duan X., Ye M., Chen X., Mei Z., Liu P., Li W., Han Y. Tacrine-6-ferulic acid, a novel multifunctional dimer, inhibits amyloid-ββ-mediated Alzheimer’s disease-associated pathogenesis in vitro and in vivo. PLoS One. 2012; 7, Epub.
58. Fernández-Bachiller M. I., Pérez C., Campillo N. E., Páez J. A., González-Muñoz G. C., Usán P., García-Palomero E., López M. G., Villarroya M., García A. G., Martínez A., Rodríguez-Franco M. I. Tacrine-melatonin hybrids as multifunctional agents for Alzheimer’s disease, with cholinergic, antioxidant, and neuroprotective properties. ChemMedChem. 2009; 4, 828–841.
59. Nunomura R. J., Castellani X., Zhu P. I., Moreira G., Perry M. A., Smith J. Involvement of oxidative stress in Alzheimer disease. Neuropathol. Exp. Neurol. 2006; 65, 631–641.
60. Reiter R. J., Tan D.-X., Manchester L. C., Terron M. P., Flores L. J., Koppisepi S. Medical implications of melatonin: receptor-mediated and receptor-independent actions. Adv. Med. Sci. 2007; 52, 11–28.
61. Masilamoni J. G., Jesudason E. P., Dhandayuthapani S., Ashok B. S., Vignesh S., Jebaraj W. C., Paul S. F., Jayakumar R. The neuroprotective role of melatonin against amyloid beta peptide injected mice. Free Radical. Res. 2008; 42, 661–673.
62. Rodríguez-Franco M. I., Fernández-Bachiller M. I., Pérez C., Hernández-Ledesma B., Bartolomé B. Novel tacrine-melatonin hybrids as dual-acting drugs for Alzheimer disease, with improved acetylcholinesterase inhibitory and antioxidant properties. J. Med. Chem. 2006; 49, 459–462.
63. Lysko P. G., Lysko K. A., Webb C. L., Feuerstein G., Mason P. E., Walter M. F., Mason R. P. Neuroprotective activities of carvedilol and a hydroxylated derivative: role of membrane biophysical interactions. Biochem. Pharmacol. 1998; 56, 1645–1656.
64. Rosini M., Simoni E., Bartolini M., Cavalli A., Ceccarini L., Pascu N., McClymont D. W., Tarozzi A., Bolognesi M. L., Minarini A., Tumiatti V., Andrisano V., Mellor I. R., Melchiorre C. Inhibition of acetylcholinesterase, beta-amyloid aggregation, and NMDA receptors in Alzheimer’s disease: a promising direction for the multi-target-directed ligands gold rush. J. Med. Chem. 2008; 51, 4381–4384.
65. Malinski T. Nitric oxide and nitroxidative stress in Alzheimer’s disease. J. Alzheimers Dis. 2007; 11, 207–218.
66. Fang L., Appenroth D., Decker M., Kiehntopf M., Lupp A., Peng S., Fleck C., Zhang Y., Lehmann J. NO-donating tacrine hybrid compounds improve scopolamine-induced cognition impairment and show less hepatotoxicity. J. Med. Chem. 2008; 51, 7666–7669.
67. Elsinghorst P. W., Cieslik J. S., Mohr K., Tränkle C., Gütschow M. First gallamine-tacrine hybrid: design and characterization at cholinesterases and the M2 muscarinic receptor. J. Med. Chem. 2007; 50, 5685–5695.
68. Camps P., Formosa X., Galdeano C., Gómez T., Muñoz-Torrero D., Scarpellini M., Viayna E., Badia A., Clos M. V., Camins A., Pallàs M., Bartolini M., Mancini F., Andrisano V., Estelrich J., Lizondo M., Bidon-Chanal A., Luque F. J. Novel donepezil-based inhibitors of acetyl - and butyrylcholinesterase and acetylcholinesterase-induced beta-amyloid aggregation. J. Med. Chem. 2008; 51, 3588–3598.
69. Camps P., Formosa X., Galdeano C., Muñoz-Torrero D., Ramírez L., Gómez E., Isambert N., Lavilla R., Badia A., Clos M. V., Bartolini M., Mancini F., Andrisano V., Arce M. P., Rodríguez-Franco M. I., Huertas O., Dafni T., Luque F. J. Pyrano[3,2-c]quinoline-6-chlorotacrine hybrids as a novel family of acetylcholinesterase - and beta-amyloid-directed anti-Alzheimer compounds. J. Med. Chem. 2009; 52, 5365–5379.
70. Morris M. C., Schneider J. A., Tangney C. C. Thoughts on B-vitamins and dementia. J. Alzheimers Dis. 2006; 9, 429–433.
71. Morris M. C., Evans D. A., Bienias J. L., Scherr P. A., Tangney C. C., Hebert L. E., Bennett D. A., Wilson R. S., Aggarwal N. Dietary niacin and the risk of incident Alzheimer’s disease and of cognitive decline. J. Neurol. Neurosurg. Psychiatry. 2004; 75, 1093–1099.
72. Szymański P., Markowicz M., Mikiciuk-Olasik E. Synthesis and biological activity of derivatives of tetrahydroacridine as acetylcholinesterase inhibitors. Bioorg. Chem. 2011; 39, 138–142.
73. Galdeano C., Viayna E., Sola I., Formosa X., Camps P., Badia A., Clos M. V., Relat J., Ratia M., Bartolini M., Mancini F., Andrisano V., Salmona M., Minguillón C., González-Muñoz G. C., Rodríguez-Franco M. I., Bidon-Chanal A., Luque F. J., Muñoz-Torrero D. Huprine-tacrine heterodimers as anti-amyloidogenic compounds of potential interest against Alzheimer’s and prion diseases. J. Med. Chem. 2012; 55, 661–669.
74. Hamulakova S., Janovec L., Hrabinova M., Kristian P., Kuca K., Banasova M., Imrich J. Synthesis, design and biological evaluation of novel highly potent tacrine congeners for the treatment of Alzheimer’s disease. Eur. J. Med. Chem. 2012; 55, 23–31.
Štítky
Farmacie Farmakologie
Článek Studium směsného suchého pojiva složeného z mikrokrystalické celulosy a glycerol monostearátuČlánek Metody farmaceutické technologie v přípravě pelet pro detekci inhibitorů acetylcholinesterasy
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2012 Číslo 5- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
-
Všechny články tohoto čísla
- Rod Bergenia – obsahové látky a biologická aktivita
- Takrin a jeho deriváty v terapii Alzheimerovy choroby
- Významné toxické a nežádoucí účinky léků u zvířat z pohledu lékárníka
- Studium směsného suchého pojiva složeného z mikrokrystalické celulosy a glycerol monostearátu
- Metody farmaceutické technologie v přípravě pelet pro detekci inhibitorů acetylcholinesterasy
- Příspěvek k vývoji reklamy ve farmacii II* Historický vývoj regulace reklamy léčivých přípravků
- Ke vzniku československého lékopisu
- 76th Prague Meeting on Macromolecules
- EUFEPS a 9. středoevropské sympozium farmaceutické technologie
- Klimas J. (zostavovateľ): 60 rokov Farmaceutickej fakulty Univerzity Komenského v Bratislave (1952–2012). Bratislava: Univerzita Komenského 2012.
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Významné toxické a nežádoucí účinky léků u zvířat z pohledu lékárníka
- Takrin a jeho deriváty v terapii Alzheimerovy choroby
- Metody farmaceutické technologie v přípravě pelet pro detekci inhibitorů acetylcholinesterasy
- Rod Bergenia – obsahové látky a biologická aktivita
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Současné možnosti léčby obezity
nový kurzAutoři: MUDr. Martin Hrubý
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání