-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMelatonin jako základní stavební jednotka pro léčiva ve vztahu k neurodegenerativním poruchám
Melatonin as a structural template in the development of novel drugs for neurodegenerative disorders
Melatonin is a key regulatory hormone produced mainly in the pineal gland. In the recent years, melatonin contribution to neurodegenerative disorders has dramatically increased when inspecting its favorable pharmacological profile. Its levels were found to be decreased during aging. Data from clinical studies point out to its positive outcome not only in improving the quality of sleep but it also exerts anti-inflammatory and antioxidant profile. Moreover, it was found as an effective neuroprotective agent. Current study summarizes the experimental data from basic research of medicinal chemistry field devoted to melatonin. Particular emphasis is directed toward melatonin derivatives with multipotent profile affecting concomitantly several pathological hallmarks of the neurodegenerative disorders.
Key words:
acetylcholinesterase • Alzheimer’s disease • antioxidant • butyrylcholinesterase • melatonin • neurodegenerative disorders
Autoři: Jan Korábečný
Vyšlo v časopise: Čes. slov. Farm., 2018; 67, 51-58
Kategorie: Přehledy a odborná sdělení
Souhrn
Melatonin představuje klíčový hormon produkovaný epifýzou, který je intenzivně zkoumán ve vztahu k neurodegenerativním onemocněním v posledních letech. Kritický je zejména úbytek jeho hladiny ve stáří. Data z klinických studií ukazují na jeho pozitivní vlastnosti ve vztahu ke kvalitě spánku, protizánětlivý a antioxidační potenciál, hojně jsou rovněž diskutovány jeho neuroprotektivní vlastnosti. Předkládaná práce shrnuje poznatky základního výzkumu z oblasti medicinální chemie melatoninu. Zvláštní důraz je kladen na deriváty tohoto hormonu, které cílí na řadu patologických mechanismů neurodegenerativních chorob současně.
Klíčová slova:
acetylcholinesterasa • Alzheimerova choroba • antioxidant • butyrylcholinesterasa • melatonin • neurodegenerativní onemocnění
Úvod
Melatonin (N-[2-(5-methoxy-1H-indol-3-yl)ethyl]acetamid) (obr. 1) je hormon produkovaný zejména epifýzou, v menší míře pak řadou dalších částí organismu, jako jsou např. buňky imunitního systému, mozek, plicní epitel, kostní dřeň, střevo, vaječníky, varlata, kůže a další1). Snížené hladiny melatoninu hrají klíčovou roli v patogenezi a progresi různých onemocnění včetně neurodegenerativních chorob, nejrůznějších poruch kardiovaskulárního systému, nádorových onemocnění, gastrointestinálního traktu, infekčních chorob a dalších2).
Obr. 1. Chemická struktura melatoninu, hormonu produkovaného epifýzou 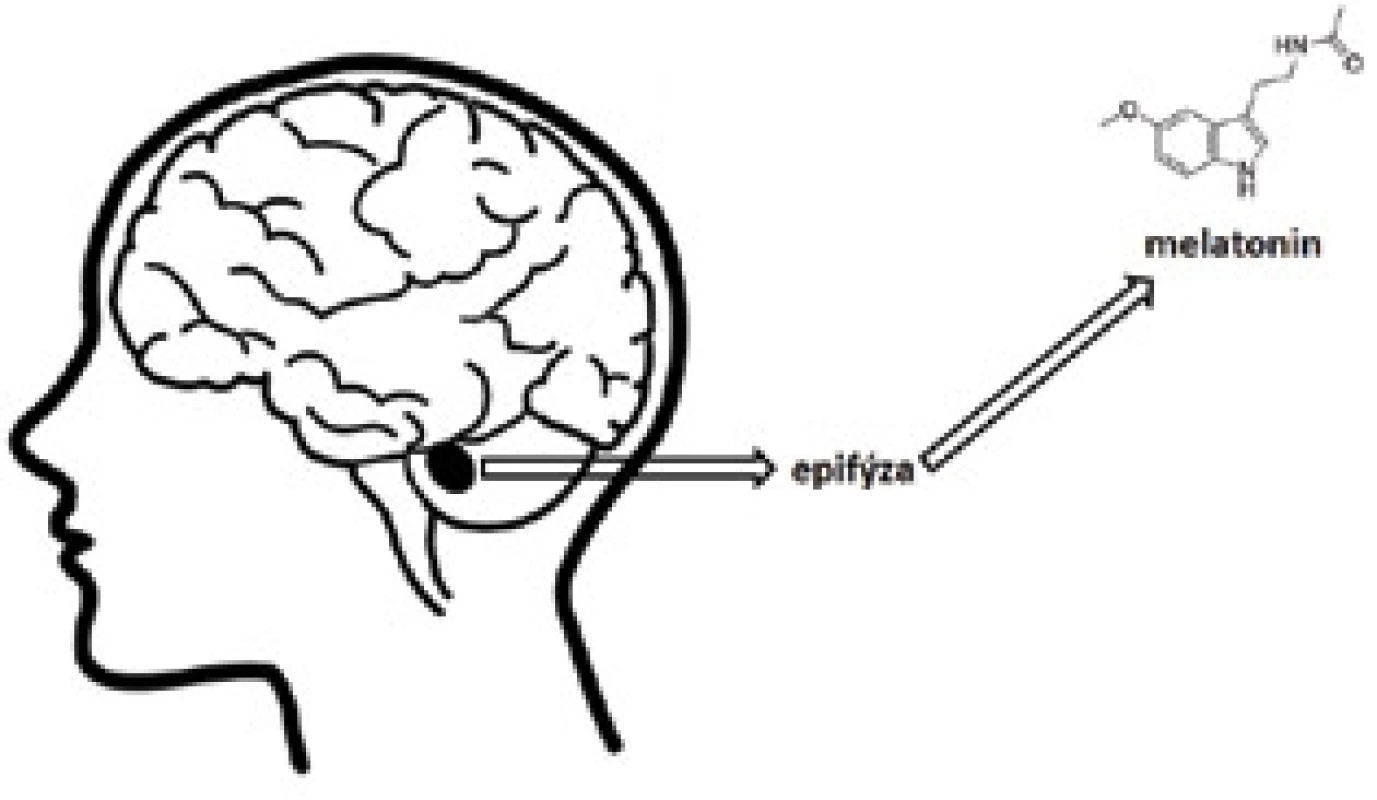
Melatonin hraje důležitou roli v činnosti mozku, imunitního systému i při obranných mechanismech, zejména s ohledem na snižování hladin reaktivních kyslíkových a dusíkových forem. Mechanismus účinku melatoninu může být přímo zprostředkován cestou tzv. melatoninových receptorů, které se nacházejí v centrálním nervovém systému (CNS) a většině buněk imunitního systému3). Samotný melatonin není pouze zodpovědný za regulaci spánku a cirkadiánního rytmu, ale je rovněž regulátorem sekrece dalších hormonů, navyšuje intracerebrální průtok krve a antagonizuje vliv některých excitačních sloučenin typu hormonů nebo aminokyselin. Velkým otazníkem zůstává jeho účinek ve vztahu k imunitnímu systému. Ten se na jednu stranu může projevovat pozitivně, tj. protizánětlivě jako antioxidant, na druhou stranu však může aktivizovat tento systém, což vede ke spuštění prozánětlivé kaskády4). Celá řada studií týkajících se neurodegenerativních chorob však hovoří spíše o převažujícím protizánětlivém účinku melatoninu. Tím zmírňuje příznaky oxidativního stresu na různých úrovních, zejména snižováním hladin indukovatelné i neuronální syntasy produkující oxid dusnatý a rovněž zvyšováním hladin antioxidačně účinných enzymů5–7). Za zmínku stojí dále jeho protektivní účinek vůči mitochondriím, melatonin zachovává elektronový potenciál na membráně zejména stabilizací integrity membrány mitochondrie8).
Vztah melatoninu a stárnutí úzce koreluje s nočním vyplavováním tohoto hormonu, kdy především u starších osob dochází k postupné redukci hladin9). Melatonin je na základě četných studií považován za unikátní sloučeninu, která je nejen zodpovědná za cirkadiánní rytmus, ale dost možná i prodlužuje délku života, což však nikdy nebylo a pravděpodobně ani nemůže být jednoznačně prokázáno10). Jeho substituce ve stáří je dnes považována za velice zajímavou alternativu k léčbě kognitivních symptomů, které často provázejí neurodegenerativní choroby. V současné době však zcela chybí jakékoliv údaje k dávkování melatoninu, doporučenému začátku jeho podávání, nejsou známy možné kontraindikace a rovněž chronobiologické následky/aspekty spojené s jeho suplementací.
Multipotentní sloučeniny
S přihlédnutím k výše jmenovaným pozitivním atributům melatoninu a jeho vztahu k neurodegenerativním onemocněním, stárnutí a zánětlivým procesům se tento hormon stal masivně vyhledávanou stavební jednotkou, která je vhodně implementována do nově vyvíjených léčiv typu „multi-target directed ligands“ (MTDLs). Jedná se o multipotentní sloučeniny, které cílí současně na několik patologických mechanismů onemocnění11).
Důvodem pro design sloučenin typu MTDLs je fakt, že dodnes neznáme přesnou příčinu vzniku neurodegenerativních onemocnění. Byla popsána řada hypotéz, z nichž zejména nejvíce relevantní a nejvíce používaná pro současnou léčbu Alzheimerovy choroby (AD) představuje tzv. cholinergní hypotéza poprvé definována roku 1976 a glutamátem navozená excitotoxicita na N-methyl-D-aspartátových (NMDA) receptorech12, 13). Na těchto dvou hypotézách dodnes staví jediná klinicky užívaná léčiva. Mezi ně patří donepezil, rivastigmin, galantamin jako zástupci inhibitorů acetylcholinesterasy (AChE, E.C. 3.1.1.7) a memantin působící jako antagonista na NMDA receptorech (obr. 2)14). Kromě těchto zmíněných hypotéz existuje celá řada dalších narušených systémů, jejichž činnost lze, alespoň dle dostupných experimentálních dat, modulovat ke zlepšení kognitivních projevů u pacientů s AD, ale i dalších typů demence, jako jsou např. Parkinsonova nemoc, Huntingtonova nemoc a jiné. Patří sem ovlivnění monoaminergního systému, extracelulární ukládání amyloidu beta (Aβ, součástí tzv. amyloidní hypotézy), intracelulární shluky hyperfosforylovaného τ-proteinu, kumulace některých kovů v mozku nebo oxidativní stres15–19). Všechny tyto hypotézy však doposud zůstávají pouze v teoretické rovině a žádné další léčivo stavějící na této hypotéze neprošlo do klinického užívání20).
Obr. 2. Vybraná klinicky užívaná léčiva pro léčbu neurodegenerativních chorob cílených na AD – memantin, galantamin, donepezil a rivastigmin 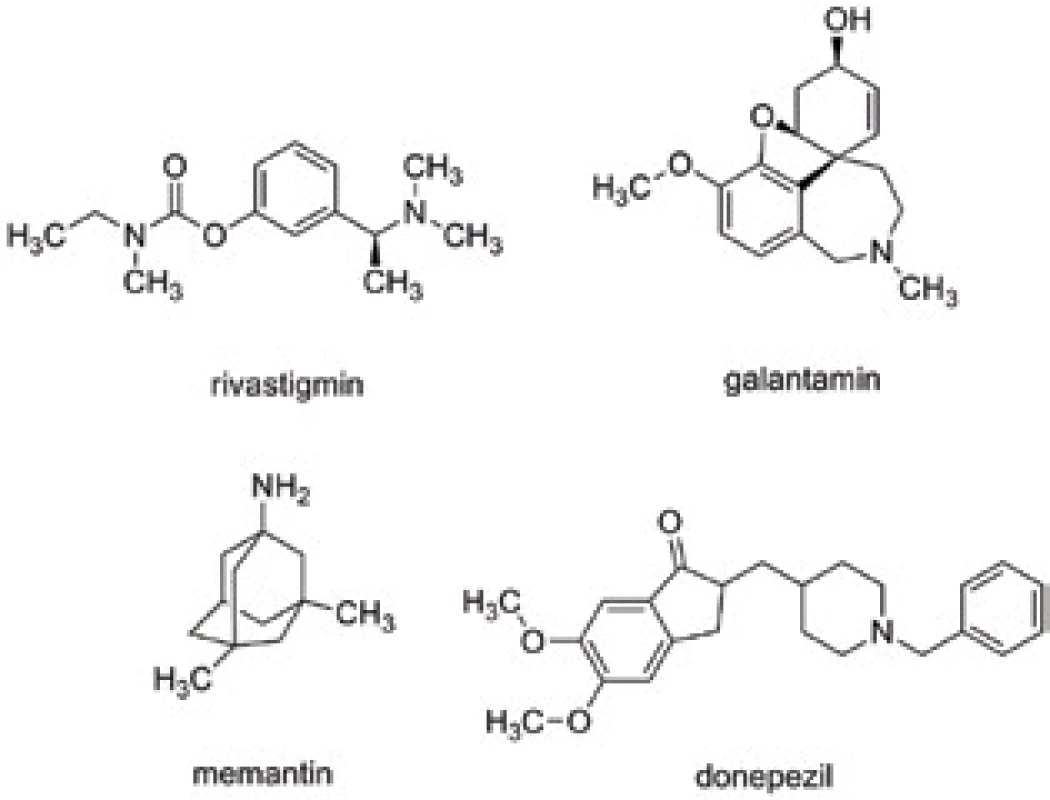
Nespornými výhodami MTDLs je kromě současného cílení na více patologických mechanismů onemocnění jejich omezení se pouze na jednu jedinou molekulu, u které sledujeme pouze jeden farmakodynamický a farmakokinetický profil, zcela odpadají lékové interakce a v neposlední řadě docílíme vyšší compliance u pacientů21). Z pohledu medicinální chemie prošel vývoj MTDLs v posledních dvou dekádách značnými změnami. Zatímco dříve bylo nejjednodušším a nejvíce efektivním způsobem jak získat toto multipotentní léčivo spojení dvou farmakoforů přes příslušný alifatický řetězec, v současně době je od této strategie odklon směrem k ligandům, které vznikly překryvem dvou účinných struktur. Důvod pro tuto změnu je prostý, větší důraz je kladen na fyzikálně-chemické vlastnosti těchto sloučenin tak, aby byly účinné po perorální aplikaci, vykazovaly dobrou rozpustnost ve vodě a aby splňovaly kritéria pro prostup do CNS22).
Melatonin jako součást MTDLs
Pilotní studie multipotentních sloučenin na bázi takrinu, reverzibilního inhibitoru AChE a různých indolových fragmentů, tedy základního skeletu melatoninu, byla publikována v roce 200523). Racionální podklad pro vývoj takovýchto duálních hybridů, kde obě dvě jednotky jsou navzájem spojené různými alifatickými řetězci nebo i dialkenylaminy, tvoří předpoklad o jejich schopnosti interagovat s oběma anionickými částmi AChE. Tato vlastnost je hojně vyhledávána s přihlédnutím k tzv. necholinergní roli AChE, kdy bylo zjištěno, že tento enzym je schopen podporovat agregaci Aβ skrze své periferní anionické místo (PAS) a interakce léčiva s touto částí se jeví jako velice zajímavý a inovativní přístup24). Řada sloučenin schopných selektivně ovlivňovat tuto část enzymu vskutku vykázala antiamyloidní profil.
V rámci výše zmíněné studie byly kombinovány dva různé takrinové fragmenty – takrin a jeho více účinný analog, 6-chlorotakrin, jež se orientují do katalytické části AChE25, 26). Indolový heterocykl byl zvolen nejen z důvodu strukturní příbuznosti k melatoninu, ale rovněž i k dalším příznivým farmakologickým vlastnostem. Nově vytvořená série takrin-indolových hybridů čítala celkově 26 sloučenin, všechny z těchto derivátů inhibovaly AChE izolovanou z lidského mozku v řádech subnanomolární až nanomolární účinnosti hodnot IC50. Mimoto byl stanoven i inhibiční potenciál vůči jiné, příbuzné cholinesterase, a to butyrylcholinesterase z lidského séra (BChE, E.C. 3.1.1.8). I zde se projevila vysoká afinita těchto sloučenin vůči BChE, kdy se inhibiční potenciál pohyboval opět v subnanomolární až nanomolární účinnosti. Dvě nejvíce potentní sloučeniny na AChE/BChE 1 a 2 jsou znázorněny na obrázku 3. Za zmínku rovněž stojí vysoká selektivita sloučeniny 2 vůči BChE. Ta se může jevit velmi slibná s přihlédnutím k faktu, že aktivita a hladina AChE v průběhu AD klesá, zatímco hladina BChE zůstává ustálená nebo dokonce mírně vzrůstá27). BChE tak může přebrat úlohu AChE v hydrolýze neuromediátoru acetylcholinu (ACh)28). Duální charakter inhibice byl potvrzen molekulově modelovacími studiemi, kdy sloučenina 1 byla schopná interagovat s oběma anionickými částmi AChE. Dle předpokladu byla takrinová část zanořena dovnitř enzymatické kavity, kde byla sendvičovitě obklopena aminokyselinovými rezidui Trp84 a Tyr330 pomocí π-π a kation-π interakcí. Při vstupu do enzymu se nacházel indolový heterocyklus, který interagoval s Trp279, klíčovým aminokyselinovým reziduem PAS. Vybrané sloučeniny z této rodiny byly dále podrobeny testování vůči Aβ. Prvně byla sledována jejich schopnost inhibovat AChE-indukovanou agregaci tohoto proteinu při 100 µM koncentraci s nalezenou 84–98% schopností zamezovat shlukování Aβ do fibril. Dále byla zjištěna jejich přímá afinita k Aβ bez přítomnosti AChE. I v tomto případě docházelo k potlačení shlukování Aβ, avšak v menší míře (46–65 %). Buněčná viabilita testovaná na lidské neuroblastomové linii (SH-SY5Y) odhalila cytotoxický vliv pouze u některých sloučenin, a to až při koncentraci 10 µM. S přihlédnutím k faktu, že tato koncentrace je minimálně o řád vyšší, než se projevuje jejich terapeutický potenciál, lze tyto hybridy označit za bezpečné.
Obr. 3. Takrin-melatoninové deriváty 1 až 4 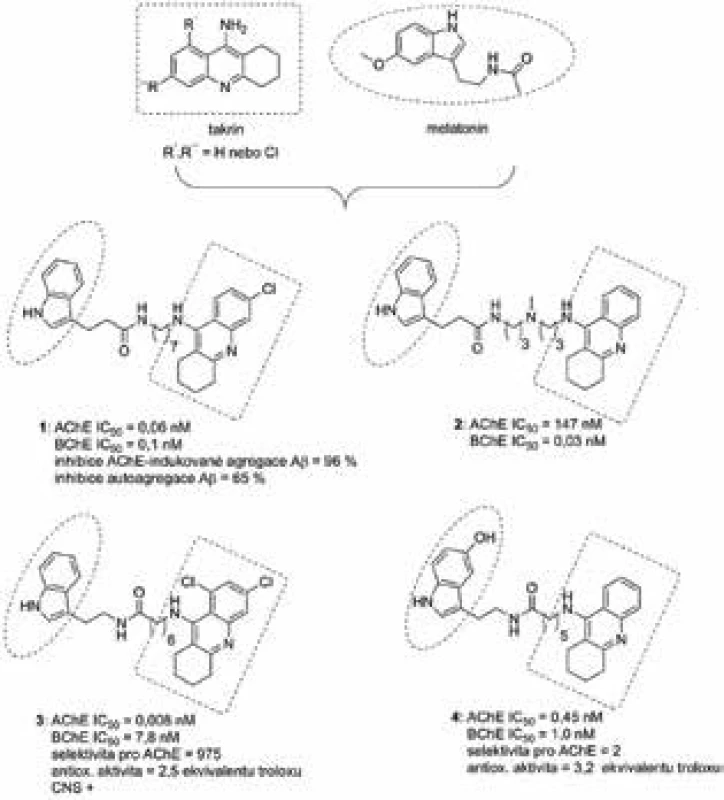
Navazující studie kombinovala opět různé takrinové deriváty (samotný takrin, 6-chlorotakrin nebo 6,8-dichlorotakrin) (obr. 3) s melatoninem29). Takto vzniklé heterodimerní sloučeniny inhibovaly obě cholinesterasy. Vyšší afinita a tedy i selektivní profil byly sledovány pro AChE, kde dosahovaly tyto multipotentní sloučeniny subnanomolárních až pikomolárních hodnot IC50. Nejúčinnější sloučeniny 3 a 4 jsou znázorněny na obrázku 3. Testované sloučeniny dále vykázaly slibný antioxidační potenciál, přičemž jejich účinnost byla 1,7–4,0krát vyšší v porovnání s troloxem, rozpustným derivátem vitaminu E. Samotný melatonin má přibližně 2krát vyšší antioxidační potenciál než trolox30). Dle testu pro přechod přes hematoencefalickou bariéru pomocí pasivní difuze jsou všechny sloučeniny ze série na bázi melatoninu schopné průchodu31).
Série 14 hybridních sloučenin na bázi melatonin-N,N--dibenzyl(N-methyl)aminů byla vyvinuta jako nové multifunkční sloučeniny pro možnou terapii AD32). Tato nová série se profilovala jako neselektivní s ohledem inhibice cholinesteras, kdy se afinita na oba zmiňované enzymy pohybovala v rozsahu mikromolárních hodnot IC50. Test pro vytěsnění propidium dijodidu, selektivního ligandu pro PAS AChE, se používá v případě, kdy chceme prokázat přímou interakci sloučeniny s tímto místem33). Většina testovaných sloučenin byla schopná vytěsňovat propidium dijodid i při nejnižších testovaných koncentracích (0,3 µM) s vysokou účinností, až 45,2 %. Stanovený antioxidační potenciál byl velice podobný parentní sloučenině melatoninu; všechny hybridy měly 1,5–4,3krát vyšší účinnost než trolox (hodnota naměřená pro melatonin byla v tomto případě 2,4krát ekvivalent troloxu). Směs rotenonu a oligomycinu A byla použita v buněčném modelu SH-SY5Y k navození podmínek oxidativního stresu. Inkubace tohoto systému s 1 µM koncentrací dané sloučeniny byla schopná navodit neuroprotekci buněčné linie v rozsahu 12–36 %. Další test rovněž poukázal na schopnost melatonin-N,N-dibenzyl(N-methyl)aminů procházet hematoencefalickou bariérou pomocí pasivní difuze. Nejúčinnější hybridní sloučenina 5 z této série je znázorněna na obrázku 4.
Obr. 4. Donepezil-melatoninové hybridní sloučeniny 5 a 6 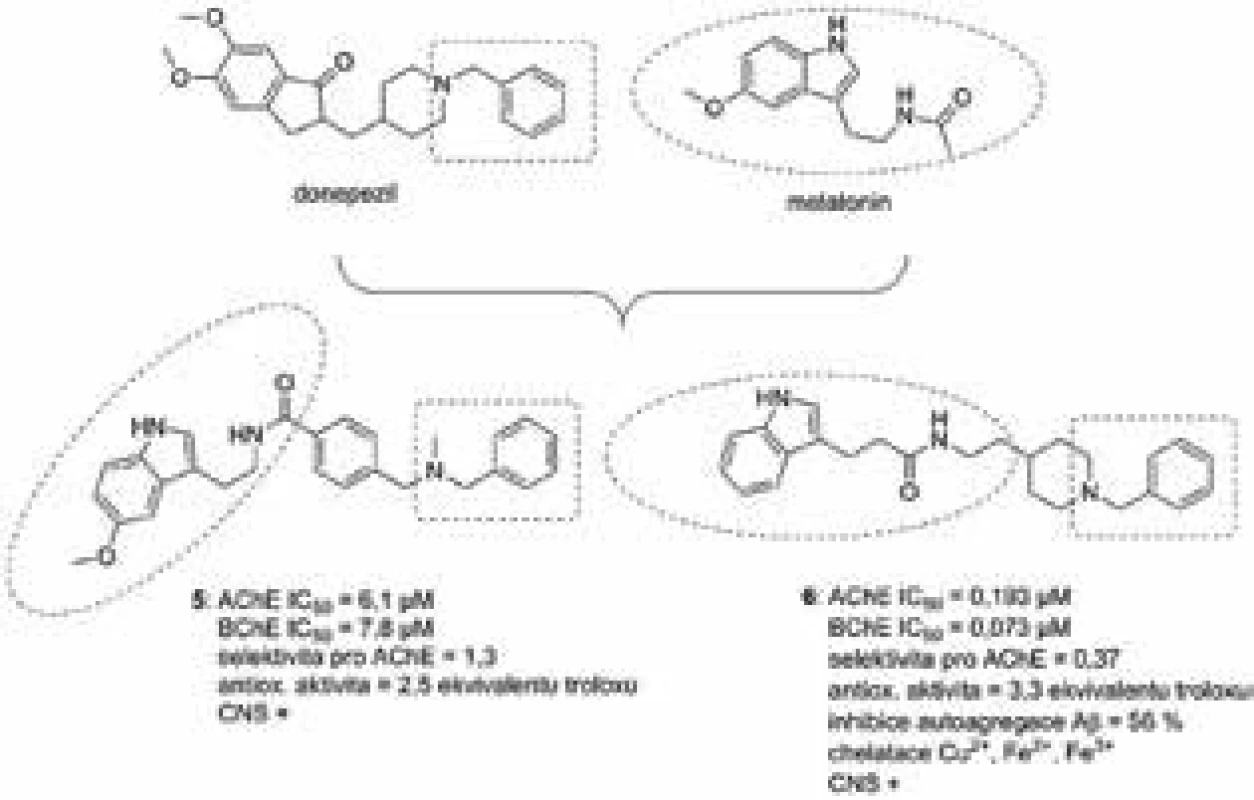
Kombinace N-benzylpiperidinové části donepezilu s melatoninem vedla k další sérii multipotentních sloučenin34). Nejzajímavější molekulou z celé série byla 6 (obr. 4), která vykazovala shodně submikromolární inhibici AChE i BChE s mírně převažující afinitou k BChE. Kinetická studie prováděná na AChE odhalila smíšený typ inhibice, což odpovídá interakci s oběma anionickými částmi enzymu. To bylo i následně potvrzeno pomocí in silico metod, kdy se melatoninová část 6 orientuje do PAS, zatímco N-benzylpiperidinový fragment interaguje v katalytické části enzymu. Toto rozložení je shodné rovněž s krystalografickou strukturou pro donepezil v aktivním místě AChE35). V koncentraci 20 µM tyto sloučeniny na bázi MTDLs ovlivňovaly autoagregaci Aβ42 od 38 % do 65 %. Tento efekt může pravděpodobně korelovat s chelatační schopností pro měďnaté ionty, kdy je ustanovena rovnováha mezi 6 a tímto kationtem v poměru 1 : 1. In vitro jsou tyto sloučeniny poměrně silnými antioxidanty, kdy jejich antioxidační potenciál dosahoval u některých až 3,94násobku účinnosti samotného troloxu. Vybrané sloučeniny ze série byly dále podrobeny protektivnímu experimentu na buněčné linii odvozené z feochromocytomu dřeně nadledvin laboratorního potkana (PC12). Jako sloučenina navozující toxický efekt byl v tomto případě použit peroxid vodíku. V 10 µM koncentraci tyto deriváty výrazně zvyšovaly viabilitu buněk. U všech sloučenin je rovněž předpoklad prostupu hematoencefalickou bariérou pomocí pasivní difuze.
Kurkumin (obr. 5) je přírodní sloučenina izolovaná z Curcuma longa L. (Zingiberaceae)36). Na její chemickou strukturu může být nahlíženo jako na biosyntetický dimer odvozený od fenylalaninu a kyseliny skořicové37). V tradiční medicíně se usušené kořínky této byliny používají k léčbě řady onemocnění, mezi které patří mimo jiné různé kožní defekty, povrchová zranění, revma, astma, alergie, jaterní potíže a další38). Kurkumin je především silným antioxidantem, mimoto ale rovněž pozitivně ovlivňuje řadu dalších patologických funkcí spojených s procesy neurodegenerace. Důležitý je zejména jeho neuroprotektivní účinek proti Aβ-indukovanému poškození nervových buněk, který byl prokázán na PC12 buněčné linie, má modulační účinky na fosforylaci τ-proteinu, čímž zabraňuje formování neurofibrilárních klubek, snižuje expresi β-sekretasy a tím nepřímo potlačuje produkci Aβ a v neposlední řadě je dobrým inhibitorem AChE39–44). Nové hybridní sloučeniny kombinující melatonin s kurkuminem vykázaly řadu příznivých farmakologických účinků45). Zejména sloučenina 7 (obr. 5) se profilovala jako neuroprotektivum u neuroblastomové buněčné linie MC65 s efektivní koncentrací v nanomolární škále účinnosti (EC50 = 27,60 nM). Podrobnější in vitro testování odhalilo inhibiční efekt vůči produkci oligomerů Aβ, samotný proces agregace tohoto proteinu však nebyl ovlivněn. Antioxidační efekt byl prokázán na stejné buněčné linii proti peroxidu vodíku i rotenonu. Negativní predikce průchodu přes hematoencefalickou bariéru s využitím lipidické membrány byla vyvrácena v in vivo modelu na myších, kde byl tento kurkuminový derivát po perorální aplikace (50 mg/kg) nalezen v mozku v efektivní koncentraci i za více než 24 h. Efekt tohoto heterodimeru byl následně potvrzen i na transgenním modelu myší s mutovaným amyloidním prekurzorovým proteinem a presenilinem 146).
Obr. 5. Kurkumin-melatoninový derivát 7 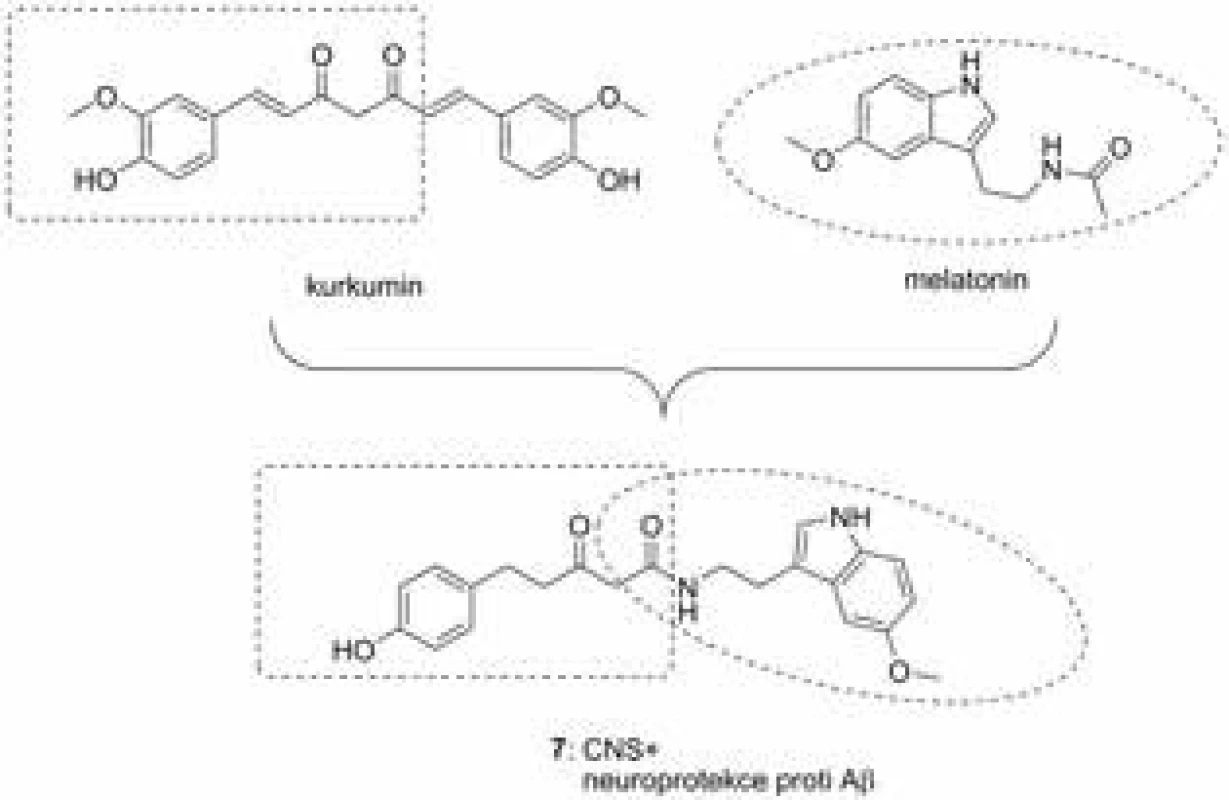
Estery kyseliny skořicové patří mezi induktory genu pro Nrf2. Nrf2 reguluje produkci celé řady antioxidačních a protizánětlivých proteinů, které chrání buňku proti oxidačnímu poškození47). Na základě této znalosti byla navržena a připravena série devíti melatonin-skořicových derivátů spadající do skupiny MTDLs48). Nově vzniklé hybridní sloučeniny vykázaly silný antioxidační potenciál, zejména pak derivát 8 (obr. 6) dosahoval devítinásobné účinnosti standardu troloxu. Neuroprotektivní vlastnosti byly ověřeny v modelu buněčné linie SHSY5Y s využitím směsi rotenonu a oligomycinu A jako toxických agens při 1 µM koncentracích testovaných substancí. Heterodimer 8 byl rovněž nejúčinnějším cytoprotektivem, kdy zvyšoval viabilitu buněk o 76,3 %.
Obr. 6. Hybridní struktura 8 na bázi melatoninu a ethylesteru kyseliny skořicové 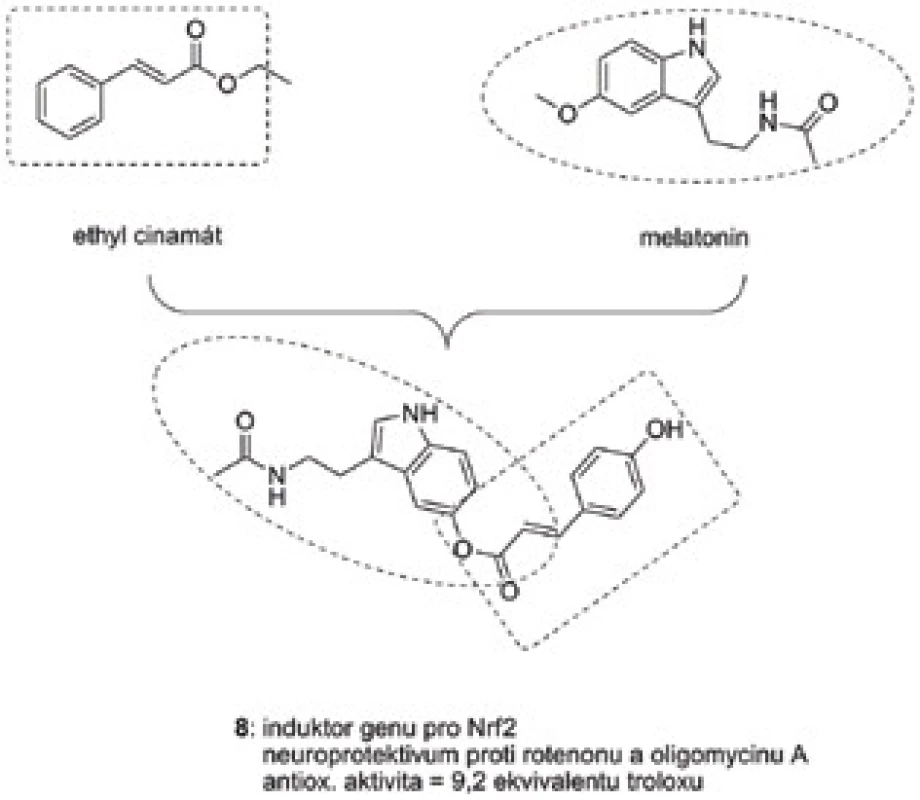
Pinolin (obr. 7) lze považovat za cyklický analog melatoninu se zachovanými antioxidačními vlastnostmi49). Ten je s největší pravděpodobností tvořen biosyntetickými pochody z 5-methoxytryptaminu, ale definitivní důkazy pro toto tvrzení neexistují50). Strukturně aktivitní studie věnována pinolinu se zaměřila zejména na polohu methoxy skupiny a dále na vliv acetylace přítomné cyklické, sekundární aminoskupiny s ohledem na antioxidační aktivitu51). Neacetylované deriváty v rámci studie rovněž vykázaly silnou afinitu k serotoninovým receptorům a serotoninovým transportérům. Submikromolární afinita byla shodně potvrzena pro všechny neacetylované deriváty pinolinu. Dle výsledků stanovení jsou tato cyklická analoga schopná rovněž inhibovat obě izoformy monoaminooxidas (MAO). Inhibice MAO-A může pozitivně přispívat k antidepresivnímu působení, zatímco důsledkem inhibice MAO-B je nepřímá antioxidační aktivita52, 53). Chování těchto sloučenin na melatoninových receptorech lze označit za parciální agonismus s převažující účinností na subtyp 2 melatoninového receptoru. Na základě predikce průchodu přes lipidickou membránu lze tyto sloučeniny označit za centrálně aktivní. Přímé stanovení antioxidačního potenciálu poukázalo na slabší efekt v porovnání s melatoninem nebo parentním pinolinem v rozsahu 1,38–2,39násobku účinnosti troloxu.
Obr. 7. Design a obecná struktura pinolin-melatoninových derivátů 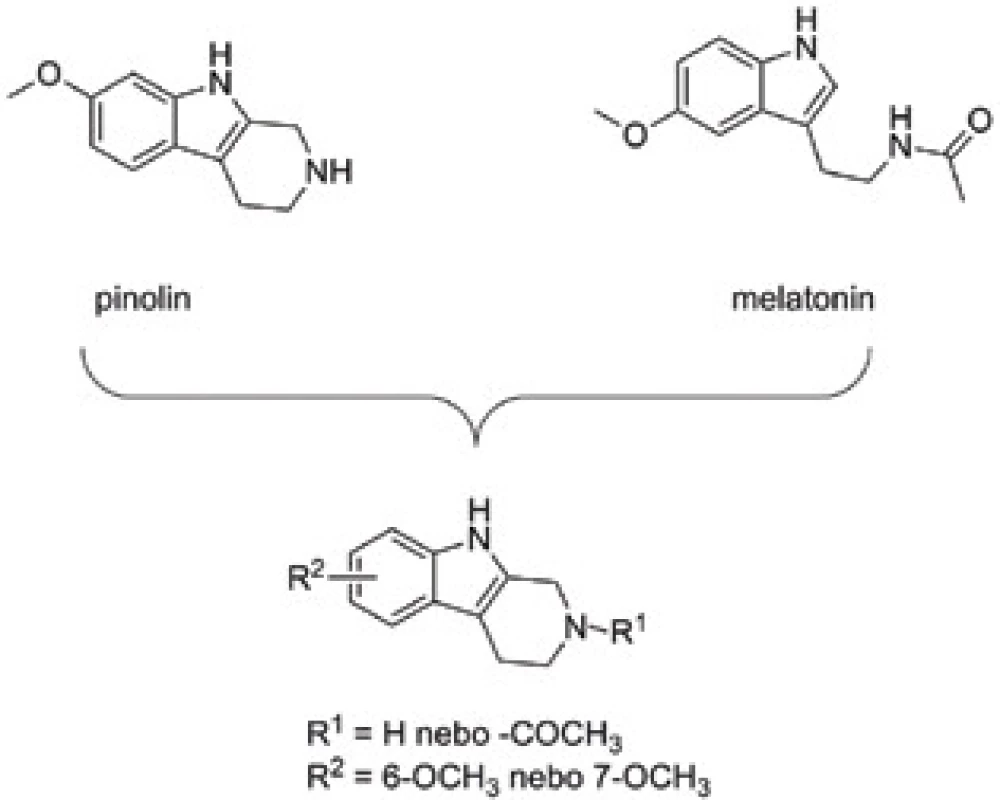
Homodimer (−)-meptazinolu byl popsán jako duální inhibitor AChE s antiagregační schopností proti Aβ54). Spojení (−)-meptazinolu s melatoninem vyústilo v nové sloučeniny typu MTDLs, které kromě vlivu na agregaci Aβ (autoagregace Aβ42 i AChE-indukovaná agregace Aβ40) byly podpořeny antioxidační aktivitou55). Nejúčinnější derivát 9 (obr. 8) lze označit jako AChE/BChE neselektivní, submikromolárně účinný inhibitor s vysokým antioxidačním potenciálem. Sloučenina 9 při 10 µM koncentraci inhibovala z 60 % autoagregaci Aβ42, byla však méně účinná v porovnání s propidium dijodidem v případě AChE-indukované agregace Aβ40.
Obr. 8. (−)-Meptazinol-melatoninový derivát 9 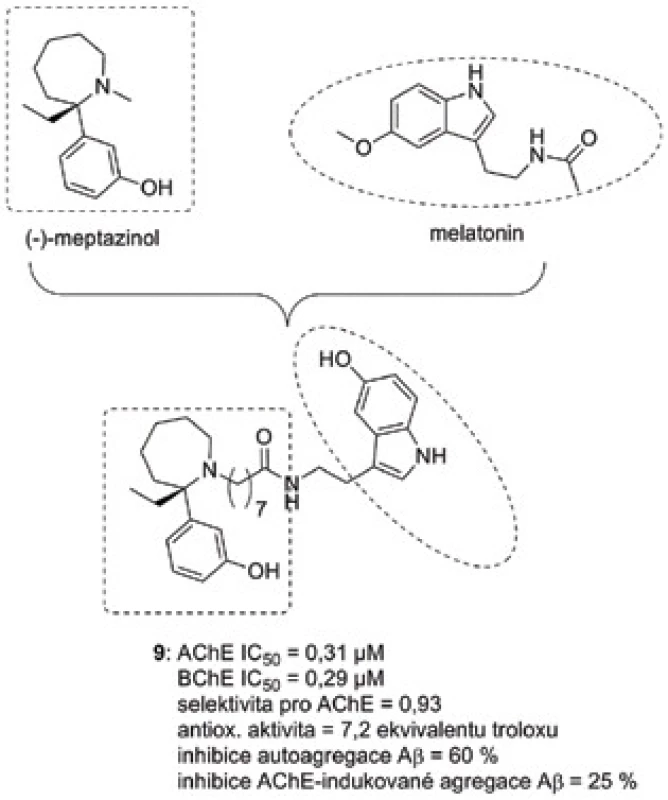
Využití Ugiho multikomponentní syntézy vedlo k sloučeninám na bázi takrinu jakožto reverzibilního inhibitoru AChE a melatoninu, na které byly současně navázány buď kyselina lipoová nebo ferulová jako aditivní antioxidanty56). Smyslem této studie bylo navýšit antioxidační působení samotného melatoninu právě přídavkem jednoho ze dvou zmíněných farmakoforů. Za nejvíce širokospektrou sloučeninu lze označit 10 (obr. 9), která ve své struktuře obsahovala 7-Methoxytakrin. 7-Methoxytakrin je v současné době jedním z nejvíce protežovaných takrinových analog z důvodu nižší incidence hepatotoxicity v porovnání s takrinem57). Derivát 10 spojoval přes sedmi uhlíkatý řetězec melatonin a kyselinu ferulovou. Celkově vykázal multipotentní charakter, inhiboval účinně obě cholinesterasy, byl více selektivní pro BChE, je schopen prostupu přes hematoencefalickou bariéru na základě predikce průchodu přes lipidickou membránu a má výrazný antioxidační profil. Naproti tomu je o trochu více cytotoxický na jaterní linie (HepG2) v porovnání s takrinem. V dávce 1 µM se jevil jako velice silné neuroprotektivum neuronální buněčné linie SH-SY5Y při koaplikaci různých toxických agens zahrnujíc Aβ40 (protekce 70,6 %), Aβ42 (57,4 %), peroxid vodíku (37,6 %) a směsi rotenonu a oligomycinu A (33,7 %).
Obr. 9. Melatoninový derivát 10 vzniklý Ugiho multikomponentní syntézou 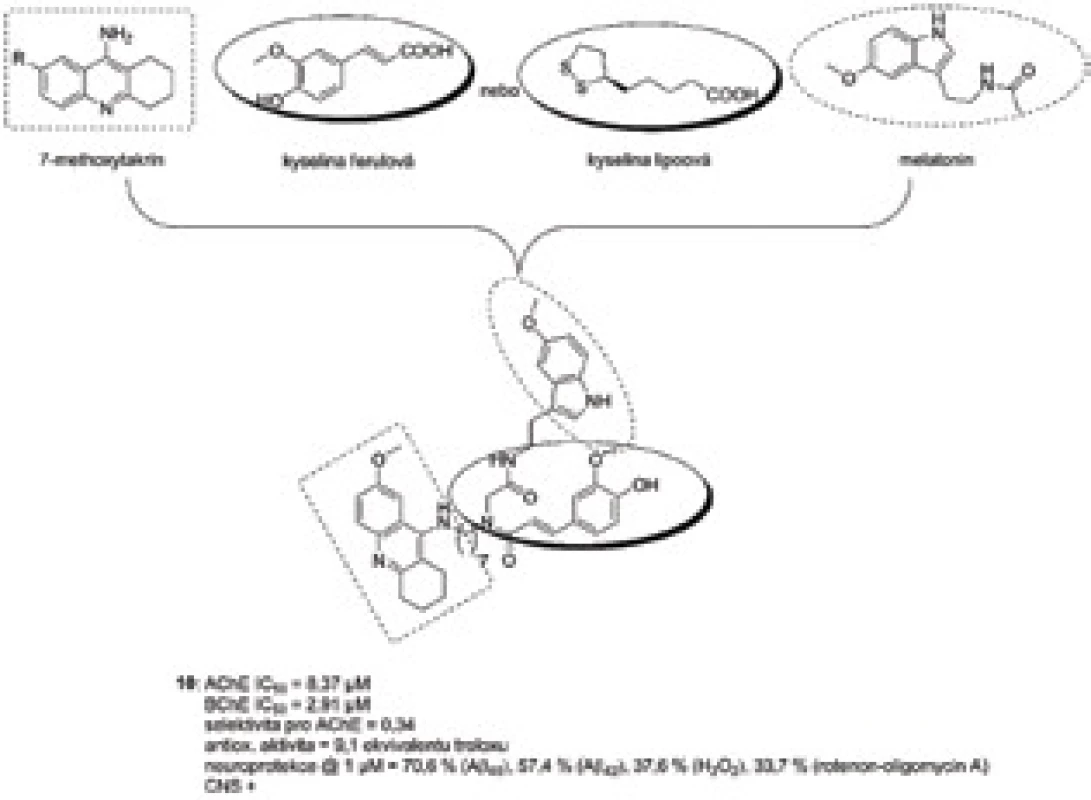
Závěr
Terapie neurodegenerativních onemocnění má v současné době pouze paliativní charakter. Neexistuje účinná léčba, která by byla schopna postihnout příčinu onemocnění, a dokonce není ani známo, co přesně je spouštěcím mechanismem. V řadě případů však panuje shoda, že nezvratné, neurodegenerativní procesy začínají řadu let před propuknutím symptomů. Současná společenská poptávka po účinném léčivu na tyto demence je zcela na místě, jelikož dlouhodobá prognóza není příliš příznivá a předpokládá se nárůst výskytu těchto onemocnění, což s sebou logicky nese obrovskou finanční zátěž, která se již nyní pohybuje okolo 1 % celosvětového hrubého domácího produktu58).
Roku 2003 bylo uvedeno na trh poslední léčivo na AD, memantin, od té doby postupně selhalo více než 200 jiných v různých fázích klinického hodnocení. V současném měřítku je AD považována za nejfrekventovanější multifaktoriální onemocnění, u kterého není přesně definována jedna příčina, jeden spouštěcí mechanismus, ale hned několik. Velmi často se hovoří o zánětlivém procesu, který je pozorován v prodromálních stadiích. Z těchto údajů jasně plyne, že je potřeba kriticky přehodnotit přístup nově vyvíjených antidementiv. Jako nejvíce perspektivní se za tímto účelem jeví vývoj multipotentních sloučenin, které nejčastěji kombinují různé farmakofory tak, aby bylo dosaženo účinku proti několika patologickým mechanismům onemocnění současně.
V předkládaném souhrnném článku je uvedena řada příkladů těchto MTDLs na bázi melatoninu, hormonu produkovaného epifýzou. Všechna tato data se shodují, že melatonin je účinným antioxidantem, který může zvrátit nebo výrazně potlačit zánětlivé procesy. Je rovněž vynikajícím neuroprotektivem. Velice často se dá vhodně kombinovat s jinými fragmenty z různých inhibitorů AChE (např. donepezil nebo takrin). V současné době chybí ve většině případů ověření konceptu těchto heterodimerních sloučenin postavených na melatoninu na zvířecím modelu demence. Teprve tyto navazující studie odhalí, zda jsou slibná in vitro data přenositelná na zvířata nebo dokonce na lidi v případě navazujících klinických studií. Prozatím jediným z výše uvedených derivátů, který byl podroben takovémuto in vivo stanovení na modelu transgenních myší, je kurkumin-melatoninový derivát 7.
Poděkování
Práce byla podpořena Dlouhodobým záměrem rozvoje a organizace – zdravotnická problematika ZHN (Fakulta vojenského zdravotnictví), finančními prostředky Fakultní nemocnice Hradec Králové (č. 00179906) a projektem Ministerstva zdravotnictví ČR s reg. č. 15-30954A.
Střet zájmů: žádný.
PharmDr. Jan Korábečný, Ph.D. (∗)
Centrum biomedicínského výzkumu Fakultní nemocnice Hr. Králové
Sokolská 581, 500 05 Hradec Králové
Katedra toxikologie a vojenské farmacie, Fakulta vojenského zdravotnictví
Třebešská 1575, 500 02 Hradec Králové
e-mail: korabecny.jan@gmail.com
Zdroje
1. Menendez‐Pelaez A., Reiter R. J. Distribution of Melatonin in Mammalian Tissues: The Relative Importance of Nuclear versus Cytosolic Localization. J. Pineal Res. 1993; 15, 59–69.
2. Sánchez-Barceló E. J., Mediavilla M. D., Tan D. X., Reiter R. J. Clinical Uses of Melatonin: Evaluation of Human Trials. Curr. Med. Chem. 2010; 17, 2070–2095.
3. Hardeland R. Melatonin Metabolism in the Central Nervous System. Curr. Neuropharmacol. 2010; 8, 168–181.
4. Albertini M. C., Radogna F., Accorsi A., Uguccioni F., Paternoster L., Cerella C., de Nicola M., D’Alessio M., Bergamaschi A., Magrini A., Ghibelli L. Intracellular pro-oxidant activity of melatonin deprives U937 cells of reduced glutathione without affecting glutathione peroxidase activity. Ann. N. Y. Acad. Sci. 2006; 1091, 10–16.
5. Reiter R. J., Acuña-Castroviejo D., Tan D. X., Burkhardt S. Free radical-mediated molecular damage. mechanisms for the protective actions of melatonin in the central nervous system. Ann. N. Y. Acad. Sci. 2001; 939, 200–215.
6. Reiter R. J., Tan D., Burkhardt S. Reactive oxygen and nitrogen species and cellular and organismal decline: amelioration with melatonin. Mech. Ageing Dev. 2002; 123, 1007–1019.
7. Reiter R. J., Tan D.-X., Mayo J. C., Sainz R. M., Leon J., Czarnocki Z. Melatonin as an antioxidant: Biochemical mechanisms and pathophysiological implications in humans. Acta Biochim. Pol. 2003; 50, 1129–1146.
8. Hardeland R. Melatonin and the theories of aging: a critical appraisal of melatonin’s role in antiaging mechanisms. J. Pineal Res. 2013; 55, 325–356.
9. Hardeland R., Coto-Montes A. New vistas on oxidative damage and aging. Open Biol. J. 2010; 3, 39–52.
10. Armstrong S. M., Redman J. R. Melatonin: a chronobiotic with anti-aging properties? Med. Hypotheses 1991; 34, 300–309.
11. Morphy R., Rankovic Z. Designed multiple ligands. An emerging drug discovery paradigm. J. Med. Chem. 2005; 48, 6523–6543.
12. Spilovska K., Zemek F., Korabecny J., Nepovimova E., Soukup O., Windisch M., Kuca K. Adamantane – a lead structure for drugs in clinical practice. Curr. Med. Chem. 2016; 23, 3245–3266.
13. Davies P., Maloney A. J. Selective Loss of central cholinergic neurons in Alzheimer’s disease. Lancet 1976; 2, 1403.
14. Zemek F., Drtinova L., Nepovimova E., Sepsova V., Korabecny J., Klimes J., Kuca K. Outcomes of Alzheimer’s disease therapy with acetylcholinesterase inhibitors and memantine. Expert Opin. Drug Saf. 2014; 13, 759–774.
15. Korábečný J., Nepovimová E., Cikánková T., Špilovská K., Vašková L., Mezeiová E., Kuča K., Hroudová J. Newly developed drugs for Alzheimer’s disease in relation to energy metabolism, cholinergic and monoaminergic neurotransmission. Neuroscience 2018; 370, 191–206.
16. Hardy J., Selkoe D. J. The amyloid hypothesis of Alzheimer’s disease: progress and problems on the road to therapeutics. Science 2002; 297, 353–356.
17. Liao D., Miller E. C., Teravskis P. J. Tau acts as a mediator for Alzheimer’s disease-related synaptic deficits. Eur. J. Neurosci. 2014; 39, 1202–1213.
18. Bolognin S., Drago D., Messori L., Zatta P. Chelation therapy for neurodegenerative diseases. Med. Res. Rev. 2009; 29, 547–570.
19. Rosini M., Simoni E., Milelli A., Minarini A., Melchiorre C. Oxidative stress in Alzheimer’s disease: Are we connecting the dots? J. Med. Chem. 2014; 57, 2821–2831.
20. Korábecný J., Hrubá E., Soukup O., Zemek F., Musílek K., Nepovímová E., Spilovská K., Opletalová V., Kuca K. Intended pharmacotherapeutical approaches of Alzheimer’s disease therapy. Ces. slov. Farm. 2012; 61, 4–10.
21. Cavalli A., Bolognesi M. L., Minarini A., Rosini M., Tumiatti V., Recanatini M., Melchiorre C. Multi-target-directed ligands to combat neurodegenerative diseases. J. Med. Chem. 2008; 51, 347–372.
22. Prati F., Cavalli A., Bolognesi M. L. Navigating the chemical space of multitarget-directed ligands: from hybrids to fragments in Alzheimer’s disease. Mol. Basel Switz. 2016; 21, 466.
23. Muñoz-Ruiz P., Rubio L., García-Palomero E., Dorronsoro I., del Monte-Millán M., Valenzuela R., Usán P., de Austria C., Bartolini M., Andrisano V., Bidon-Chanal A., Orozco M., Luque F. J., Medina M., Martínez A. Design, synthesis, and biological evaluation of dual binding site acetylcholinesterase inhibitors: new disease-modifying agents for Alzheimer’s disease. J. Med. Chem. 2005; 48, 7223–7233.
24. Inestrosa N. C., Alvarez A., Pérez C. A., Moreno R. D., Vicente M., Linker C., Casanueva O. I., Soto C., Garrido J. Acetylcholinesterase Accelerates assembly of amyloid-beta-peptides into Alzheimer’s fibrils: possible role of the peripheral site of the enzyme. Neuron 1996; 16, 881–891.
25. Korábečný J., Spilovská K., Benek O., Musílek K., Soukup O., Kuča K. Tacrine and its derivatives in the therapy of Alzheimers disease. Ces. slov. Farm. 2012; 61, 210–221.
26. Recanatini M., Cavalli A., Belluti F., Piazzi L., Rampa A., Bisi A., Gobbi S., Valenti P., Andrisano V., Bartolini M., Cavrini V. SAR of 9-amino-1,2,3,4-tetrahydroacridine-based acetylcholinesterase inhibitors: synthesis, enzyme inhibitory Activity, QSAR, and structure-based CoMFA of tacrine analogues. J. Med. Chem. 2000; 43, 2007–2018.
27. Nordberg A., Ballard C., Bullock R., Darreh-Shori T., Somogyi M. A review of butyrylcholinesterase as a therapeutic target in the treatment of Alzheimer’s disease. Prim. Care Companion CNS Disord. 2013; 15.
28. Minic J., Chatonnet A., Krejci E., Molgó J. Butyrylcholinesterase and acetylcholinesterase activity and quantal transmitter release at normal and acetylcholinesterase knockout mouse neuromuscular junctions. Br. J. Pharmacol. 2003; 138, 177–187.
29. Rodríguez-Franco M. I., Fernández-Bachiller M. I., Pérez C., Hernández-Ledesma B., Bartolomé B. Novel tacrine-melatonin hybrids as dual-acting drugs for Alzheimer disease, with improved acetylcholinesterase inhibitory and antioxidant properties. J. Med. Chem. 2006; 49, 459–462.
30. Sofic E., Rimpapa Z., Kundurovic Z., Sapcanin A., Tahirovic I., Rustembegovic A., Cao G. Antioxidant capacity of the neurohormone melatonin. J. Neural Transm. Vienna Austria 1996 2005; 112, 349–358.
31. Di L., Kerns E. H., Fan K., McConnell O. J., Carter G. T. High throughput artificial membrane permeability assay for blood-brain barrier. Eur. J. Med. Chem. 2003; 38, 223–232.
32. López-Iglesias B., Pérez C., Morales-García J. A., Alonso-Gil S., Pérez-Castillo A., Romero A., López M. G., Villarroya M., Conde S., Rodríguez-Franco M. I. New melatonin-n,n-dibenzyl(n-methyl)amine hybrids: potent neurogenic agents with antioxidant, cholinergic, and neuroprotective properties as innovative drugs for Alzheimer’s disease. J. Med. Chem. 2014; 57, 3773–3785.
33. Di Pietro O., Viayna E., Vicente-García E., Bartolini M., Ramón R., Juárez-Jiménez J., Clos M. V., Pérez B., Andrisano V., Luque F. J., Lavilla R., Muñoz-Torrero D. 1,2,3,4-tetrahydrobenzo[h][1,6]naphthyridines as a new family of potent peripheral-to-midgorge-site inhibitors of acetylcholinesterase: synthesis, pharmacological evaluation and mechanistic studies. Eur. J. Med. Chem. 2014; 73, 141–152.
34. Wang J., Wang Z.-M., Li X.-M., Li F., Wu J.-J., Kong L.-Y., Wang X.-B. Synthesis and evaluation of multi-target-directed ligands for the treatment of Alzheimer’s disease based on the fusion of donepezil and melatonin. Bioorg. Med. Chem. 2016; 24, 4324–4338.
35. Zhu J. T. T., Choi R. C. Y., Chu G. K. Y., Cheung A. W. H., Gao Q. T., Li J., Jiang Z. Y., Dong T. T. X., Tsim K. W. K. Flavonoids possess neuroprotective effects on cultured pheochromocytoma PC12 cells: A comparison of different flavonoids in activating estrogenic effect and in preventing beta-amyloid-induced cell death. J. Agric. Food Chem. 2007; 55, 2438–2445.
36. Verghese J. Isolation of curcumin from Curcuma Longa L. Rhizome. Flavour Fragr. J. 1993; 8, 315–319.
37. Katsuyama Y., Kita T., Funa N., Horinouchi S. Curcuminoid biosynthesis by two type III polyketide synthases in the herb Curcuma Longa. J. Biol. Chem. 2009; 284, 11160–11170.
38. Ammon H. P., Wahl M. A. Pharmacology of Curcuma Longa. Planta Med. 1991; 57, 1–7.
39. Dairam A., Fogel R., Daya S., Limson J. L. Antioxidant and iron-binding properties of curcumin, capsaicin, and s-allylcysteine reduce oxidative stress in rat brain homogenate. J. Agric. Food Chem. 2008; 56, 3350–3356.
40. Park S.-Y., Kim D. S. H. L. Discovery of natural products from Curcuma Longa that protect cells from beta-amyloid insult: A drug discovery effort against Alzheimer’s disease. J. Nat. Prod. 2002; 65, 1227–1231.
41. Kim H., Park B.-S., Lee K.-G., Choi C. Y., Jang S. S., Kim Y.-H., Lee S.-E. Effects of naturally occurring compounds on fibril formation and oxidative stress of beta-amyloid. J. Agric. Food Chem. 2005; 53, 8537–8541.
42. Shimmyo Y., Kihara T., Akaike A., Niidome T., Sugimoto H. Epigallocatechin-3-gallate and curcumin suppress amyloid beta-induced beta-site APP cleaving enzyme-1 upregulation. Neuroreport 2008; 19, 1329–1333.
43. Derosa G., Maffioli P., Simental-Mendía L. E., Bo S., Sahebkar A. Effect of curcumin on circulating interleukin-6 concentrations: A systematic review and meta-analysis of randomized controlled trials. Pharmacol. Res. 2016; 111, 394–404.
44. Tang M., Taghibiglou C. The mechanisms of action of curcumin in Alzheimer’s disease. J. Alzheimers Dis. JAD 2017; 58, 1003–1016.
45. Chojnacki J. E., Liu K., Yan X., Toldo S., Selden T., Estrada M., Rodríguez-Franco M. I., Halquist M. S., Ye D., Zhang S. Discovery of 5-(4-Hydroxyphenyl)-3-Oxo-Pentanoic Acid [2-(5-Methoxy-1H-Indol-3-Yl)-Ethyl]-Amide as a neuroprotectant for Alzheimer’s disease by hybridization of curcumin and melatonin. ACS Chem. Neurosci. 2014; 5, 690–699.
46. Gerenu G., Liu K., Chojnacki J. E., Saathoff J. M., Martínez-Martín P., Perry G., Zhu X., Lee H.-G., Zhang S. Curcumin/melatonin hybrid 5-(4-Hydroxy-Phenyl)-3-Oxo-Pentanoic Acid [2-(5-Methoxy-1H-Indol-3-Yl)-Ethyl]-Amide ameliorates AD-like pathology in the APP/PS1 mouse model. ACS Chem. Neurosci. 2015; 6, 1393–1399.
47. Ma Q. Role of Nrf2 in oxidative stress and toxicity. Annu. Rev. Pharmacol. Toxicol. 2013; 53, 401–426.
48. Buendia I., Navarro E., Michalska P., Gameiro I., Egea J., Abril S., López A., González-Lafuente L., López M. G., León R. New Melatonin-cinnamate hybrids as multi-target drugs for neurodegenerative diseases: Nrf2-induction, antioxidant effect and neuroprotection. Future Med. Chem. 2015; 7, 1961–1969.
49. Pähkla R., Zilmer M., Kullisaar T., Rägo L. Comparison of the antioxidant activity of melatonin and pinoline in vitro. J. Pineal Res. 1998; 24, 96–101.
50. Susilo R., Rommelspacher H. Formation of 1-methyl-beta-carbolines in rats from their possible carboxylic acid precursor. Naunyn. Schmiedebergs Arch. Pharmacol. 1988; 337, 566–571.
51. de la Fuente Revenga M., Pérez C., Morales-García J. A., Alonso-Gil S., Pérez-Castillo A., Caignard D.-H., Yáñez M., Gamo A. M., Rodríguez-Franco M. I. Neurogenic potential assessment and pharmacological characterization of 6-Methoxy-1,2,3,4-Tetrahydro-β-Carboline (Pinoline) and melatonin-pinoline hybrids. ACS Chem. Neurosci. 2015; 6, 800–810.
52. Mason R. P., Olmstead E. G., Jacob R. F. Antioxidant activity of the monoamine oxidase B inhibitor lazabemide. Biochem. Pharmacol. 2000; 60, 709–716.
53. Fiedorowicz J. G., Swartz K. L. The role of monoamine oxidase inhibitors in current psychiatric practice. J. Psychiatr. Pract. 2004; 10, 239–248.
54. Xie Q., Wang H., Xia Z., Lu M., Zhang W., Wang X., Fu W., Tang Y., Sheng W., Li W., Zhou W., Zhu X., Qiu Z., Chen H. Bis-(−)-nor-meptazinols as novel nanomolar cholinesterase inhibitors with high inhibitory potency on amyloid-β aggregation. J. Med. Chem. 2008; 51, 2027–2036.
55. Cheng S., Zheng W., Gong P., Zhou Q., Xie Q., Yu L., Zhang P., Chen L., Li J., Chen J., Chen H., Chen H. (−)-meptazinol-melatonin hybrids as novel dual inhibitors of cholinesterases and amyloid-β aggregation with high antioxidant potency for Alzheimer’s therapy. Bioorg. Med. Chem. 2015; 23, 3110–3118.
56. Benchekroun M., Romero A., Egea J., León R., Michalska P., Buendía I., Jimeno M. L., Jun D., Janockova J., Sepsova V., Soukup O., Bautista-Aguilera O. M., Refouvelet B., Ouari O., Marco-Contelles J., Ismaili L. The antioxidant additive approach for Alzheimer’s disease therapy: new ferulic (lipoic) acid plus melatonin modified tacrines as cholinesterases inhibitors, direct antioxidants, and nuclear factor (erythroid-derived 2)-like 2 activators. J. Med. Chem. 2016; 59, 9967–9973.
57. Soukup O., Jun D., Zdarova-Karasova J., Patocka J., Musilek K., Korabecny J., Krusek J., Kaniakova M., Sepsova V., Mandikova J., Trejtnar F., Pohanka M., Drtinova L., Pavlik M., Tobin G., Kuca K. A Resurrection of 7-MEOTA: A comparison with tacrine. Curr. Alzheimer Res. 2013; 10, 893–906.
58. Maresova P., Klimova B., Novotny M., Kuca K. Alzheimer’s and Parkinson’s diseases: expected economic impact on Europe-a call for a uniform european strategy. J. Alzheimers Dis. JAD 2016; 54, 1123–1133.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2018 Číslo 2- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
-
Všechny články tohoto čísla
- Melatonin jako základní stavební jednotka pro léčiva ve vztahu k neurodegenerativním poruchám
- Superrozvolňovadla ve farmaceutické technologii
- Selén v prevencii a podpornej liečbe nádorov mäkkých tkanív
- Mikrobióm v súvislosti s metabolickým syndrómom a možnosti terapeutického využitia jeho ovplyvnenia
- K obsahu národní části Českého lékopisu 2017
- Enchiridion medicinae Juraja Henischa (1549–1618)*
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- K obsahu národní části Českého lékopisu 2017
- Superrozvolňovadla ve farmaceutické technologii
- Mikrobióm v súvislosti s metabolickým syndrómom a možnosti terapeutického využitia jeho ovplyvnenia
- Melatonin jako základní stavební jednotka pro léčiva ve vztahu k neurodegenerativním poruchám
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Současné možnosti léčby obezity
nový kurzAutoři: MUDr. Martin Hrubý
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



