-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPredpokladané mechanizmy imunomodulačného a protizápalového pôsobenia probiotík
Potential immunomodulatory and antiinflammatory mechanisms of probiotics
The number of preclinical and clinical studies showing efficacy of probiotics in the treatment and prophylaxis of certain diseases, e.g. diarrhoea of various origin, irritable bowel syndrome, inflammatory bowel disease, allergies, hypercholesterolemia, bacterial vaginosis, and colorectal cancer, is increasing. These health benefits are often species and strain specific. This article provides an overview of available knowledge about the supposed mechanisms of probiotic microorganism’s action focusing in particular on the interaction between probiotic and host cells. One of the results of this interaction is induction of pro - or anti-inflammatory immune response in the macroorganism. Detailed knowledge of the signalling pathways involved in the communication between bacterial and human cells can find application in the selection of optimal probiotics for the targeted treatment of selected diseases. Additional possibilities for their use in clinical practice are provided by genetic manipulation of probiotic microorganisms.
Key words:
probiotics • inflammation • signalling pathways • immunomodulation • genetic manipulation
Autoři: Andrea Bilková; František Bilka; Hana Kiňová Sepová
Působiště autorů: Farmaceutická fakulta, Univerzita Komenského v Bratislave ; Katedra bunkovej a molekulárnej biológie liečiv
Vyšlo v časopise: Čes. slov. Farm., 2016; 65, 43-51
Kategorie: Přehledy a odborná sdělení
Souhrn
Počet predklinických a klinických štúdií, ktoré potvrdzujú účinnosť probiotík v profylaxii a terapii niektorých ochorení, napr. hnačiek rôzneho pôvodu, syndrómu dráždivého čreva, nešpecifickej zápalovej choroby čreva, alergie, hypercholesterolémie, bakteriálnej vaginózy, kolorektálneho karcinómu a i. stále rastie. Tieto zdraviu prospešné účinky sú často druhovo a kmeňovo špecifické. V práci podávame prehľad dostupných poznatkov o predpokladaných mechanizmoch účinku probiotických mikroorganizmov, pričom sa zameriavame najmä na interakciu probiotických buniek s bunkami hostiteľa. Jedným z výsledkov tejto interakcie je navodenie pro - alebo protizápalovej imunitnej odpovede makroorganizmu. Detailné poznanie signálnych dráh, ktorými prebieha komunikácia medzi bakteriálnymi a ľudskými bunkami môže nájsť uplatnenie pri selekcii vhodných probiotík pre cielenú liečbu vybraných ochorení. Ďalšie možnosti využitia probiotických mikroorganizmov v klinickej praxi poskytujú genetické manipulácie a metódy génového inžinierstva.
Kľúčové slová:
probiotiká • zápal • signálne dráhy • imunomodulácia • genetická manipuláciaÚvod
Medzi najčastejšie využívané probiotické baktérie patria druhy rodov Lactobacillus a Bifidobacterium, ktoré radíme do veľkej skupiny baktérií mliečneho kvasenia (LAB – lactic acid bacteria)1). Menej často sa ako probiotiká používajú Streptococcus spp. (S. thermophilus, S. salivarius, S. macedonicus), Enterococcus spp. (E. faecalis, E. faecium), Lactococcus spp. (L. lactis), Leuconostoc spp. (L. mesenteroides) a Pediococcus spp. (P. acidilactici, P. pentosaceus)2, 3). Z mikroorganizmov, ktoré nepatria k LAB, sa probiotickými vlastnosťami vyznačujú napr. Gram-pozitívne (G+) baktérie Bacillus toyonensis, B. coagulans a B. subtilis, Clostridium butyricum, Propionibacterium freudenreichii3), Gram-negatívna (G–) baktéria Escherichia coli Nissle 19174, 5) a kvasinky Saccharomyces cerevisiae a S. cerevisiae subsp. boulardii (niekedy uvádzaná ako Saccharomyces boulardii)6).
Mechanizmy, ktorými probiotiká poskytujú hostiteľovi zdravotné benefity, zatiaľ neboli jednoznačne objasnené. Predpokladá sa, že účinkujú na troch úrovniach, pričom hranice medzi nimi nie sú striktne vymedzené:
- antimikróbne pôsobenie probiotík – patria sem procesy ako kompetícia s patogénmi pri získavaní živín, produkcia antimikróbnych látok, kompetitívna exklúzia patogénov, medzibunková komunikácia tzv. „quorum sensing“ a iné7, 8)
- posilnenie funkcie črevnej epitelovej bariéry, ktoré sa uskutočňuje prostredníctvom regulácie signálnych dráh v bunkách hostiteľa a vedie napr. k zvýšenej produkcii hlienu, defenzínov a proteínov teplotného šoku, k posilneniu tesného spojenia medzi bunkami a prevencii apoptózy9)
- modulácia imunitnej odpovede hostiteľa na lokálnej aj systémovej úrovni – imunomodulácia zahŕňa reguláciu expresie cytokínov, aktiváciu fagocytózy, moduláciu funkcie dendritových buniek, indukciu Treg lymfocytov a i.7, 10)
Problematika antimikróbneho pôsobenia probiotík je podrobne spracovaná v prácach Kiňová Sepová a kol. 8) a Bilková a kol.11).
Táto práca je venovaná sumarizácii zdravotných benefitov, ktoré poskytujú probiotiká hostiteľovi a podrobne popisuje mechanizmy ich imunomodulačného a protizápalového pôsobenia.
Zdraviu prospešné účinky probiotických mikroorganizmov
Prehľad zdraviu prospešných účinkov probiotických mikroorganizmov pre hostiteľa a predpokladaných mechanizmov, ktoré ich zabezpečujú, podáva tabuľka 1. Rozdelenie do jednotlivých kategórií účinkov na antimikróbne, imunomodulačné, protizápalové a iné nie je vždy jednoznačné a je uskutočnené na základe prevládajúcej väčšiny predpokladaných mechanizmov, ktoré sa na danom účinku podieľajú.
Tab. 1. Zdraviu prospešné účinky probiotických mikroorganizmov pre hostiteľa a predpokladané mechanizmy, ktoré sa na nich podieľajú (podľa<sup>12– 14)</sup>) 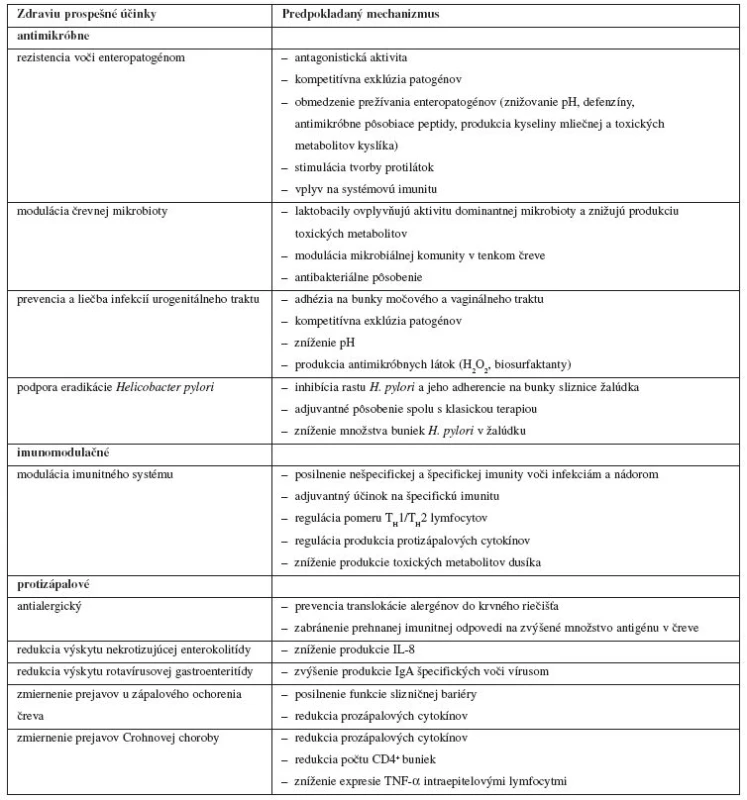
Imunomodulačný účinok probiotík
Pri interakcii hostiteľa s enterobaktériami zohráva dôležitú úlohu tzv. s črevom asociované lymfoidné tkanivo (GALT – gut associated lymphoid tissue). GALT je najväčším lymfoidným orgánom v ľudskom tele. Má dôležitú úlohu v ochrane pred infekčnými agens a udržiavaní imunitnej homeostázy organizmu. Z tohto pohľadu je dôležitá jeho schopnosť rozlíšiť patogénny a nepatogénny mikroorganizmus a zahájiť účinnú imunitnú odpoveď voči patogénu, alebo navodiť imunotoleranciu voči komenzálu. GALT má úlohu aj pri navodení tolerancie voči potravinovým antigénom15).
Interakcia hostiteľského organizmu s mikroorganizmom je najčastejšie sprostredkovaná molekulami vyskytujúcimi sa na ich bunkových povrchoch. Probiotické baktérie rovnako ako patogény obsahujú na svojom povrchu tzv. „molekulové vzory asociované s mikroorganizmom“ (MAMP – microbe-associated molecular pattern). Zo strany eukaryotickej bunky sú tieto štruktúry rozpoznávané buď širokou škálou špecifických molekúl, alebo obmedzeným množstvom molekúl s menšou špecificitou. Medzi špecifické molekuly patria imunoglobulíny (Ig) a receptory T buniek (TCR – T cells receptor). Oboje sú súčasťou adaptívnej imunity. K menej špecifickým molekulám patria „receptory rozpoznávajúce vzory“ (PRR – pattern recognition receptor)16, 17). Vďaka širokej špecificite dokáže obmedzené množstvo PRR interagovať s rôznymi typmi MAMP, a vyvolať tak rýchlu reakciu na akýkoľvek mikroorganizmus9). Modulácia imunitnej odpovede hostiteľa na bunkovej úrovni sa uskutočňuje prostredníctvom inhibície alebo aktivácie rôznych signálnych dráh (napr. dráhy nukleárneho faktora κB (NF-κB – nuclear factor-κB), dráhy proteínkinázy aktivovanej mitózou (MAPK – mitogen-activated protein kinase) alebo dráhy receptora aktivujúceho peroxizomálnu proliferáciu γ (PPAR-γ – peroxisome proliferator-activated receptor gamma) (obr. 1). Týmto spôsobom je navodená tolerancia hostiteľa voči komenzálnym baktériám a zachovaná imunitná odpoveď voči patogénom. Porušenie rovnováhy medzi toleranciou a imunitnou reakciou môže viesť k rozvoju rôznych patologických stavov, vrátane nešpecifickej zápalovej choroby čreva (IBD – inflammatory bowel disease) a kolorektálneho karcinómu20, 21).
Obr. 1 Interakcie probiotických baktérií s rôznymi typmi buniek hostiteľa (podľa 16, 18, 19)) 
Probiotiká zlepšujú bariérovú funkciu IEC posilnením tesného spojenia medzi bunkami, ako aj zvýšením produkcie hlienu. Reguláciou expresie receptorov pre bolesť a potenciálnych neurotransmiterov ovplyvňujú motilitu čriev a citlivosť na bolesť. Probiotiká môžu interakciou s DC modulovať subpopulácie T-lymfocytov a navodiť TH1, TH2 alebo Treg bunkovú odpoveď. Interferujú s patogénmi indukciou sekrécie β-defenzínov IEC a IgA plazmatickými bunkami a priamo blokujú signálne dráhy indukované patogénmi. Moduláciou klúčových signálnych dráh (napr. dráh NF-κB a MAPK), môžu regulovať sekréciu cytokínov IEC, DC a makrofágmi. Presmerovaním signálnych dráh môžu ovplyvniť proliferáciu a prežívanie cielových buniek. APRIL – ligand indukujúci proliferáciu (a proliferation-inducing ligand), DC – dendritová bunka, sIgA – sekrétový imunoglobulín A, HSP – proteín teplotného šoku, IEC – epitelová bunka čreva, MAPK – mitózou aktivovaná proteínkináza, NF-κB – nukeárny faktor-κB, pIgR – polymérny imunoglobulínový receptor (polymeric immunoglobulin receptor), STAT – prenášač signálu a aktivátor transkripcie (signal transducer and activator of transcription) Medzi najvýznamnejšie MAMP G+ baktérií, ku ktorým radíme väčšinu probiotík, patria peptidoglykán a rôzne v ňom zakotvené proteíny, teichoové kyseliny a polysacharidy22, 23). Z hľadiska interakcie s eukaryotickou bunkou je najvýznamnejšou povrchovou štruktúrou G– baktérií lipopolysacharid tvoriaci súčasť vonkajšej membrány24). Povrchové makromolekuly rôznych mikrobiálnych druhov, resp. kmeňov, vrátane probiotík, komenzálov a patogénov majú podobnú základnú štruktúru, líšia sa však rôznymi modifikáciami, napr. spôsobom glykozylácie. Táto variabilita vedie k rozdielom v interakcii s PRR a potenciálnymi koreceptormi. Tak makromolekula jedného druhu môže byť agonistom pre konkrétny PRR, zatiaľ čo podobná makromolekula iného druhu môže byť jeho antagonistom. MAMP jednotlivých kmeňov sú vysoko konzervované, čo zodpovedá u probiotík za ich kmeňovo špecifické probiotické účinky16).
Zo strany hostiteľa prichádzajú najčastejšie do kontaktu s enteromikroorganizmami epitelové bunky čreva (IEC – intestinal epithelial cell) umiestnené pod vrstvou hlienu a dendritové bunky (DC), nachádzajúce sa v lamina propria (obr. 1). IEC predstavujú prvú obrannú líniu voči enteropatogénom, DC hrajú dôležitú úlohu pri vrodenej a získanej imunite. PRR sa nachádzajú na oboch z nich. Najlepšie preštudovanými PRR sú receptory podobné Toll (TLR – Toll-like receptor). TLRs predstavujú veľkú rodinu transmembránových proteínov, ktoré sú lokalizované na povrchu bunky alebo v membráne vnútrobunkových organel25, 26). Po naviazaní ligandu na ich extracelulárnu doménu, bohatú na leucínové zvyšky, dochádza ku konformačnej zmene, na základe ktorej intracelulárna Toll/IL-1R (TIR – Toll/interleukin-1 receptor) doména iniciuje prenos signálu vo vnútri bunky. Výsledkom signálnej kaskády vyvolanej interakciou MAMP a PRR je odpoveď na detegovaný mikroorganizmus na molekulovej úrovni. Táto odpoveď môže zahŕňať „up“ alebo „down“ reguláciu produkcie imunomodulačných cytokínov, chemokínov, antimikróbnych alebo cytoprotektívnych faktorov a ko-stimulačných molekúl (obr. 1). Konkrétna forma odpovede závisí od typu mikroorganizmu a reaktivity interagujúcej bunky hostiteľa16, 17).
Medzi TLR exprimované na povrchu epitelových buniek čreva a dendritových buniek, u ktorých bola potvrdená interakcia s molekulovými vzormi asociovanými s mikroorganizmom patria TLR2, TLR4, TLR5 a TLR927). TLR2 je zakomponovaný do bunkovej signalizácie po interakcii bunky s molekulami na povrchu G+ baktérií, ako sú lipoteichoové kyseliny a peptidoglykán23, 24). TLR4 sa podieľa na detekcii povrchových štruktúr G– baktérií, napr. lipopolysacharidu. TLR5 viaže flagelín, ktorý je stavebnou jednotkou bakteriálnych bičíkov a zároveň faktorom virulencie. Aktivácia TLR5 mobilizuje NF-κB a stimuluje produkciu TNF-α28, 29). Nemetylovaný motív CpG bakteriálnej DNA interaguje s TLR97).
Okrem TLR sa na prenose signálu po kontakte s bakteriálnou bunkou môžu podieľať aj extracelulárne lektínové receptory typu C (CLR – C-type lectin receptor), napr. DC-SIGN (dendric cell-specific intracellular adhesion molecule 3-grabbing non-integrin)30) a receptory NLR (nucleotide-binding oligomerization domain-containing protein (NOD)-like receptor). S NOD1 a NOD2 interagujú muropeptidy pochádzajúce z peptidoglykánu31).
Mikrobiálne antigény ovplyvňujú aj aktivitu makrofágov, plazmatických a nervových buniek (obr. 1)18).
Viaceré štúdie potvrdili schopnosť probiotických baktérií, vrátane niektorých laktobacilov, alebo bezbunkových rastových médií, získaných po ich kultivácii, stimulovať expresiu proteínov teplotného šoku HSP25/27 a HSP72 (heat shock protein) epitelovými bunkami čreva. Tieto proteíny pomáhajú udržiavať tesné spojenie medzi bunkami čreva, zlepšujú funkčnú bariéru epitelu a chránia epitelové bunky pred apoptózou. HSP25/27 stabilizuje aktín a HSP72 chráni bunkové proteíny pred denaturáciou32).
Povrchové štruktúry špecifické pre patogénne mikroorganizmy vo všeobecnosti indukujú v makroorganizme prozápalové reakcie, ktorých cieľom je deštrukcia patogénu. Aktivujú napr. T - a B-lymfocyty, fagocyty a produkciu prozápalových cytokínov (TNF-α, IL-1, IL-6, IL-8, IL-12 a IL-18). V prípade akéhokoľvek neadekvátneho zásahu do regulácie tohto procesu môžu efektorové bunky, indukované antigénmi enteropatogénu, zahájiť chronický zápalový proces10, 33).
Regulácia zápalových signálnych dráh probiotickými mikroorganizmami
Reguláciou zápalových signálnych dráh v epitelových bunkách čreva, dendritových bunkách a makrofágoch hostiteľa dokážu probiotiká navodiť homeostázu imunitného systému makroorganizmu9, 18).
Hlavným „konverzačným uzlom“ medzi probiotickou bunkou a epitelovou bunkou čreva je pravdepodobne dráha transkripčného nukleárneho faktora NF-κB, ktorá predstavuje jeden z kľúčových signálnych kanálov pre aktiváciu imunitnej odpovede. Bez prítomnosti stimulu je NF-κB v cytoplazme prítomný v inaktívnej forme, viazaný na molekulu inhibítora IκB. Po spustení signálnej dráhy vhodným prozápalovým stimulom (napr. interakcia medzi špecifickým MAMP patogénu a príslušným PRR a následná aktivácia cytoplazmatického adaptéra MyD88) dôjde k fosforylácii IκB pomocou IκB-kinázy. Fosforylovaný IκB je ubikvitínovaný prostredníctvom ubikvitínligázy E3-SCFß-TrCP a následne degradovaný v 26S proteazóme. Uvoľnený NF-κB migruje do jadra, viaže sa na cieľové promótory a aktivuje transkripciu efektorových génov34, 35). Výsledkom je „up-regulácia“ expresie prozápalových cytokínov (TNF-α, IL-1β, IL-6, IL-8) a β-defenzínov. Aktivácia NF-κB má úlohu v patogenéze zápalových ochorení vrátane artritídy a IBD24). Viaceré kroky uvedenej dráhy predstavujú kľúčové regulačné body, do ktorých môžu probiotiká zasiahnuť a ovplyvniť bunkovú signalizáciu, zabrániť aktivácii NF-κB a „downregulovať“ expresiu prozápalových cytokínov. Deje sa to inhibíciou funkcie proteazómu, inhibíciou fosforylácie alebo ubikvitinácie α-podjednotky IκB a exportom p65 podjednotky NF-κB z jadra prostredníctvom dráhy závislej od PPAR-γ19, 36). Ale sú známe aj probiotické kmene, ktoré naopak uľahčujú prechod podjednotiek NF-κB do jadra a aktivujú transkripciu prozápalových génov19).
PPAR-γ patrí do superrodiny jadrových hormónových receptorov a podieľa sa na regulácii intestinálneho zápalu a homeostázy. Predstavuje ďalší potenciálny cieľ pre probiotickú moduláciu. V epitelových bunkách čreva pacientov s ulceróznou kolitídou bola pozorovaná redukcia PPAR-γ mRNA a zníženie expresie proteínu v porovnaní so zdravými jedincami37). Niektoré probiotické laktobacily (L. casei, L. crispatus M247) dokážu zvýšením expresie PPAR-γ inhibovať na TLR4 závislú prozápalovú signálnu dráhu18). Tieto pozorovania naznačujú, že probiotická terapia môže zvýšením expresie PPAR-γ pomôcť eliminovať zápal asociovaný s ulceróznou kolitídou19).
Probiotiká môžu ovplyvniť aj signálnu kaskádu MAPK, ktorá je nezávislá od dráhy NF-κB. Po ovplyvnení probiotickým prípravkom VSL#3 (obsahuje Bifidobacterium longum, B. breve, B. infantis, Lactobacillus acidophilus, L. delbrueckii subsp. bulgaricus, L. paracasei, L. plantarum, Streptococcus thermophilus) bola pozorovaná supresia fosforylácie MAPK p38 v epitelových bunkách čreva, ktorá viedla k inhibícii sekrécie IL-8 bez ovplyvnenia transkripcie IL-8 mRNA alebo aktivácie NF-κB38). Naopak, L. acidophilus ATCC 4356 aktivoval MAPK signalizáciu a indukoval fosforyláciu p3839).
Na protizápalových mechanizmoch sprostredkovaných probiotikami sa podieľajú aj indukcia expresie faktora transformujúceho rast β a nervového rastového faktora epitelovými bunkami čreva40). Jijon a kol.38) pozorovali, že cytokínmi indukovaný zápal v epitelových bunkách dokáže potlačiť dokonca aj samotná DNA izolovaná z probiotík. Ďalší z mechanizmov, ktorým môžu probiotiká modulovať zápalový proces, predstavuje regulácia expresie TLR črevnými epitelovými bunkami41).
Vybrané laktobacily dokážu modulovať vnútrobunkovú signalizáciu prostredníctvom dráh NF-κB a MAPK aj v makrofágoch a ovplyvniť tak sekréciu nimi produkovaných cytokínov. Okrem toho môžu inhibovať signalizáciu sprostredkovanú agonistami eukaryotických bunkových povrchových receptorov. AP-1 (activator protein-1), STAT (signal transducer and activator of transcription) a SOCS (suppressor of cytokine signaling) predstavujú ďalšie intracelulárne ciele probiotickej aktivácie špecifické pre makrofágy19). Predpokladá sa, že interakcia medzi vybranými laktobacilmi a makrofágmi sa realizuje, aspoň čiastočne, prostredníctvom receptora pre manózu (CD 206)42).
Rôzne kmene Lactobacillus spp. môžu stimulovať dendritové bunky k usmerneniu diferenciácie a proliferácie TH1, TH2 alebo TH3 bunkovej odpovede. K zahájeniu signalizačnej kaskády v dendritovej bunke dôjde po naviazaní vhodného ligandu na DC-SIGN receptor, ktorý je závislý od Ca2+ 43). Zatiaľ nie je známe, akým spôsobom interagujú laktobacily s DC-SIGN. Výsledný účinok je skôr imunoregulačný a nespočíva v navodení agresívnej imunitnej odpovede. Indukcia Treg lymfocytov po orálnej administrácii laktobacilov môže byť využitá nielen pri zmierňovaní lokálneho (slizničného), ale aj systémového zápalu34).
Z uvedeného vyplýva, že probiotické mikroorganizmy (alebo do budúcnosti len efektorové molekuly ich buniek) môžu modulovať zápalové reakcie makroorganizmu a to pozitívnym aj negatívnym smerom. Protizápalový účinok je výsledkom inhibície signálnych dráh NF-κB a MAPK, aktivácie dráhy PPAR-γ a zníženia expresie TLR na imunokompetentných bunkách. Prozápalový efekt má aktivácia signálnych dráh NF-κB a MAPK a aktivácia expresie TLR. Kmene s protizápalovým pôsobením môžu nájsť uplatnenie v praxi napr. pri terapii IBD, alergií, artritídy a zmierňovaní prejavov syndrómu dráždivého čreva. Chronický zápal je sprievodným javom aj mnohých ochorení spadajúcich pod označenie metabolický syndróm. Naopak, systémová indukcia mierneho zápalu probiotikami je užitočná v terapii atopickej dermatitídy, prevencii cestovateľskej hnačky a gastroenteritídy16, 19, 41, 44, 45).
Medzi probiotické mikroorganizmy inhibujúce zápalové reakcie patria napr. L. rhamnosus GG46), L. casei DN-114 00147) a L. fermentum DSMZ 2005248). Naopak Bifidobacterium lactis BB12 dokáže aktivovať NF-κB, a tým zvýšiť sekréciu prozápalového IL-649).
Imunomodulačný efekt probiotických organizmov sa líši nielen v závislosti od použitého kmeňa a jeho dávky, ale je závislý aj od stavu imunitného systému hostiteľa50). Rozdiely boli pozorované pri modulácii fagocytózy u zdravých a alergických jedincov. Kým u zdravých bol pozorovaný imunostimulačný účinok, u alergických jedincov prevládal imunosupresívny efekt51). Nakoľko výkonnosť imunitného systému sa so zvyšujúcim vekom zhoršuje, konzumácia probiotík predstavuje zaujímavú alternatívu imunostimulačnej terapie u seniorov52).
Schopnosť modulovať imunitnú odpoveď hostiteľa majú nielen živé, ale aj usmrtené probiotické baktérie. Niektoré štúdie dokladujú, že teplom usmrtené baktérie majú na hostiteľský organizmus skôr prozápalový ako protizápalový účinok (indukcia IL-6 alebo produkcia TNF-α)53).
Ovplyvnenie aktivity imunitného systému bolo pozorované aj u fragmentov buniek L. rhamnosus GG pozostávajúcich z peptidoglykánu alebo teichoových kyselín54). Iliev a kol.55) zistili, že aj sekvencia TTTCGTTT genómovej DNA L. rhamnosus GG stimuluje myšie a ľudské imunitné bunky.
Pokusy na „germ-free“ zvieratách pomohli lepšie pochopiť význam črevnej mikrobioty pre ľudský organizmus. Porovnávacie štúdie „germ-free“ a kolonizovaných zvierat ukázali, že „germ-free“ zvieratá sú náchylnejšie na infekcie a majú redukovanú sieť ciev, aktivitu tráviacich enzýmov, hrúbku membrán svalových buniek, produkciu cytokínov a hladinu sérových imunoglobulínov, menšie Peyerove plaky, menej intraepitelových lymfocytov a zvýšený podiel enterochromatínu v bunkách56, 57). Po kolonizácii „germ-free“ myší črevnou mikroflórou došlo k úplnému obnoveniu funkčnosti tráviaceho traktu, slizničného imunitného systému a rozvoja črevného nervového systému58).
Ovplyvnenie mechanizmu účinku probiotík genetickými manipuláciami
Možnosť pripraviť geneticky modifikované probiotické mikroorganizmy poskytuje nové perspektívy ich profylaktického a terapeutického využitia. Genetickou manipuláciou je možné vylepšiť existujúce probiotické vlastnosti konkrétneho kmeňa, ako aj pripraviť nové probiotické organizmy so špecifickými vlastnosťami, umožňujúcimi cielene ovplyvniť rozvoj a priebeh konkrétneho ochorenia59, 60). Transgénne probiotiká predstavujú ideálne vektorové systémy pre transport proteínových bioaktívnych molekúl (napr. antigénov, enzýmov, cytokínov, peptidov) priamo na povrch črevnej sliznice59). V porovnaní so systémovým podávaním pri tomto spôsobe aplikácie nehrozí riziko nežiaducich vedľajších účinkov. Naviac, rekombinantnou technikou je možné mikroorganizmy upraviť tak, aby nepredstavovali hrozbu pre životné prostredie5).
Jedným z najčastejšie geneticky modifikovaných druhov je Lactococcus lactis5). Na zvieracích modeloch (myši, potkany) ako aj v klinických skúškach boli testované protizápalové účinky rekombinantých kmeňov L. lactis, exprimujúcich napr. ľudský IL-1061), nanoprotilátky proti TNF62), hemoxidázu63) a ľudský TFF-1 (trefoil factor family)64).
Z laktobacilov boli geneticky modifikované napr. druhy L. plantarum, L. gasseri a L. casei. Rekombinantný L. casei, produkujúci ľudský elafín, by mohol byť účinný pri zmierňovaní zápalu, urýchľovaní hojenia sliznice a navodení črevnej homeostázy u pacientov, trpiacich IBD65–67). Elafín je endogénny inhibítor proteáz, ktorý sa vyskytuje v ľudskom čreve, a má protizápalový účinok na jeho sliznicu68). Genetickými manipuláciami boli do L. casei, L. gasseri a L. plantarum vložené gény pre antioxidačné enzýmy, napr. katalázu, superoxiddizmutázu a glutatiónperoxidázu, ktoré sa zúčastňujú na detoxikácii reaktívnych foriem kyslíka. Rekombinantné kmene boli následne testované v pokusoch na IL-10 deficientných myšiach a potkanoch s chemicky vyvolanou kolitídou. Výsledky experimentov ukázali, že intragastrická administrácia rekombinantných laktobacilov signifikantne zmierňovala zápal a skracovala dĺžku trvania kolitídy u testovaných zvierat69–71).
Detailné pochopenie mechanizmu kompetície medzi komenzálmi a patogénmi a objasnenie schopnosti patogénov (napr. Salmonella enterica ser. Typhimurium, Clostridium difficile a enteropatogénne kmene Escherichia coli) kolonizovať črevnú sliznicu postihnutú zápalom umožní pravdepodobne izolovať také kmene, alebo geneticky upraviť probiotické baktérie tak, aby boli schopné vytesniť patogény z miesta zápalu5).
V budúcnosti budú probiotické prípravky obsahovať pravdepodobne zmes viacerých kmeňov, ktorých zdraviu prospešné účinky sa budú vzájomne dopĺňať a budú „šité na mieru“ pre rôzne typy ochorení gastrointestinálneho traktu (napr. cestovateľská a postantibiotická hnačka, IBD, syndróm dráždivého čreva, prevencia kolorektálneho karcinómu a i.), bakteriálne vaginózy a moduláciu aktivity imunitného systému72, 73).
Perspektívne je možné počítať s využitím LAB aj ako vektorov pre proteínové a DNA vakcíny. Výhodou LAB v tejto aplikácii je, že majú potenciál elicitovať tak antigén-špecifickú imunitnú odpoveď na povrchu slizníc ako aj efektívnu systémovú imunitu5, 59, 74).
Publikácia vznikla vďaka podpore v rámci OP Výskum a vývoj pre dopytovo-orientovaný projekt: Univerzitný vedecký park Univerzity Komenského v Bratislave, ITMS 26240220086 spolufinancovaný zo zdrojov Európskeho fondu regionálneho rozvoja.
Podporujeme výskumné aktivity na Slovensku/Projekt je spolufinancovaný zo zdrojov EÚ.
Práca bola podporená aj grantom APVV 0484-12.
Stret záujmov: žiadny.
Mgr. Andrea Bilková, PhD. • F. Bilka • H. Kiňová Sepová
Katedra bunkovej a molekulárnej biológie liečiv
Farmaceutická fakulta, Univerzita Komenského v Bratislave
Kalinčiakova 8,
832 32 Bratislava, SR
e-mail: bilkova@fpharm.uniba.sk
Došlo 25. novembra 2015
Prijato 1. apríla 2016
Zdroje
1. Pot B., Tsakalidou E. Taxonomy and metabolism of Lactobacillus. In: Ljung Å., Wadström T. (eds.) Lactobacillus molecular biology. From genomics to probiotics. 1st ed. Norfolk: Caister Academic Press 2009.
2. Grover S., Rashmi H. M., Srivastava A. K., Batish V. K. Probiotics for human health – new innovations and emerging trends. Gut Pathogens 2012; 4, 1. http://www.ncbi.nlm.nih.gov/ pmc/articles/PMC3544614/ (12. 11. 2015)
3. Foligné B., Daniel C., Pot B. Probiotics from research to market: the possibilities risks and challenges. Curr. Opin. Microbiol. 2013; 16, 284–292.
4. Nissle A. Explanations of the significance of colonic dysbacteria the mechanism of action of E. coli therapy (mutaflor). Medizinische 1959; 4, 1017–1022.
5. Behnsen J., Deriu E., Sassone-Corsi M., Raffatellu M. Probiotics: Properties, examples, and specific applications. Cold Spring Harb. Perspect. Med. 2013; 3, a010074.
6. Khatri I., Akhtar A., Kaur K., Tomar R., Prasad G. S., Ramya T. N., Subramanian S. Gleaning evolutionary insights from the genome sequence of a probiotic yeast Saccharomyces boulardii. Gut Pathog. 2013; 5. http://www.ncbi.nlm.nih.gov/pmc/ articles/PMC3843575/ (12. 11. 2015)
7. Lebeer S., Vanderleyden J., De Keersmaecker S. C. J. Genes and molecules of lactobacilli supporting probiotic action. Microbiol. Mol. Biol. Rev. 2008; 72, 728–764.
8. Kiňová Sepová H., Bilková A., Bilka F., Bezáková L. Antimikróbne pôsobiace látky produkované baktériami mliečneho kvasenia. Čes. slov. Farm. 2010; 59, 155–159.
9. Hevia A., Delgado S., Sánchez B., Margolles A. Molecular players involved in the interaction between beneficial bacteria and the immune system. Front. Microbiol. 2015; 6, 1285.
10. Kang H.-J., Im S.-H. Probiotics as an immune modulator. J. Nutr. Sci. Vitaminol. 2015; 61, S103–S105.
11. Bilková A., Kiňová Sepová H., Bilka F., Balažová A. Bakteriocíny produkované baktériami mliečneho kvasenia. Čes. slov. Farm. 2011; 60, 65–72.
12. Nagpal R., Behare P. V., Kumar M., Mohania D., Yadav M., Jain S., Menon S., Parkash O., Marotta F., Minelli E., Henry C. J., Yadav H. Milk, milk products and disease free health: an updated overview. Crit. Rev. Food Sci. Nutr. 2012; 52, 321–333.
13. Bested A. C., Logan A. C., Selhub E. M. Intestinal microbiota, probiotics and mantal health: from Metchnikoff to modern advances: Part II – contemporary contextual research. Gut Pathogens 2013; 5, 1–14.
14. Karpiňski T. M., Szkaradkiewicz A. K. Characteristic of bacteriocines and their application. Pol. J. Bacteriol. 2013; 62, 223–235.
15. Kayserová H. Potravinová alergia. Via Practica 2004; 2, 90–94.
16. Lebeer S., Vanderleyden J., De Keersmaecker S. C. J. Host interactions of probiotic bacterial surface molecules: comparison with commensals and pathogens. Microbiol. 2010; 8, 171–184.
17. Sellge G., Kufer T. A. PRR-signaling pathways: learning from microbial tactics. Semin. Immunol. 2015; 27, 75–84.
18. O’Hara A. M., Shanahan F. The gut flora as a forgotten organ. EMBO Rep. 2006; 7, 688–693.
19. Thomas C. M., Versalovic J. Probiotics-host communication. Modulation of signaling pathways in the intestine. Gut Microbes 2010; 1, 148–163.
20. Tiptiri-Kourpeti A., Spyridopoulou K., Santarmaki V., Aindelis G., Tompoulidou E., Laprianidou E. E., Saxami G., Ypsilantis P., Lampri E. S., Simopoulos C., Kotsianidis I., Galanis A., Kourkoutas Y., Dimitrellou D., Chlichlia K. Lactobacillus casei exerts anti-proliferative effects accompanied by apoptoticcell death and up-regulation of TRAIL in colon carcinoma cells. PLoS One 2016; 11: e0147960.
21. Sengupta R., Altermann E., Anderson E., Anderson R. C., McNabb W. C., Moughan P.J ., Roy N. C. The role of cell surface architecture of lactobacilli in host-microbe interactions in the gastrointestinal tract. Med. Inflamm. 2013; 237921, doi:10.1155/2013/237921
22. Mohamadzadeha M., Pfeiler E. A., Brown J. B., Zadeha M., Gramarossa M., Managlia E., Berea P., Sarraj B., Khan M. W., Pakanati K. Ch., Ansari M. J., O´Flaherty S., Barrett T., Klaenhammer T. R. Regulation of induced colonic inflammation by Lactobacillus acidophilus deficient in lipoteichoic acid. PNAS 2011; 108, 4623–4630.
23. Meshkibaf Sh., Fritz J., Gottschalk M., Kim S. O. Preferential production of G-CSF by a protein-like Lactobacillus rhamnosus GR-1 secretory factor through activating TLR2-dependent signaling events without activation of JNKs. BMC Microbiol. 2015; 15, doi:10.1186/s12866-015-0578-2.
24. Schiffrin E. J., Blum S. Interaction between the microbiota and the intestinal mucosa. Eur. J. Clin. Nutr. 2002; 56, 60–64.
25. Yousefi M., Movassaghpour A. A., Shamsasenjan K., Ghalamfarsa G., Sadreddini S., Jadidi-Niaragh F. The skewed balance between Tregs and Th17 in chronic lymphocytic leukemia. Future Oncol. 2015; 11, 1567–1582.
26. Nyirenda M. H., Morandi E., Vinkemeier U., Constantin - Teodosiu D., Drinkwater S., Mee M. TLR2 stimulation regulates the balance between regulatory T cell and Th17 function: a novel mechanism of reduced regulatory T cell function in multiple sclerosis. J. Immunol. 2015; 194, 5761–5774.
27. Takeda K., Kaisho T., Akira S. Toll-like receptors. Annu. Rev. Immunol. 2003; 21, 335–376.
28. Yoon S. I., Kurnasov O., Natarajan V., Hong M., Gudkov A. V., Osterman A. L., Wilson I. A. Structural basis of TLR5-flagellin recognition and signaling. Science 2012; 17, 859–864.
29. Park B. S., Lee J.-O. Recognition of lipopolysacharide pattern by TLR4 complexes. Exp. Mol. Med. 2013; 45, e66.
30. Dambuza I. M., Brown G. D. C-type lectins in imunity: recent developments. Curr. Opin. Immunol. 2015; 32, 21–27.
31. Claes A. K., Zhou J. Y., Philpott D. J. NOD-like receptors: guardians of intestinal mucosal barriers. Physiology (Bethesda) 2015; 30, 241–250.
32. Liu H.-Y., Roos S., Jonsson H., Ahl D., Dicksved J., Lindberg J. E. Lundh T. Effects of Lactobacillus johnsonii and Lactobacillus reuteri on gut barrier function and heat shock proteins in intestinal porcine epithelial cells. Physiol. Rep. 2015; 3, e12355.
33. Koboziev I., Karlsson F., Grisham M. B. Gut-associated lymphoid tissue, T cell trafficking, and chronic intestinal inflammation. Ann. N. Y. Acad. Sci. 2010; 1207, 86–93.
34. Demeria D., Ewaschuk J., Madsen K. Interactions of Lactobacillus with the immune system. In: Ljung Å., Wadström T. (eds.) Lactobacillus molecular biology. From genomics to probiotics. 1st ed. Norfolk: Caister Academic Press 2009.
35. Mileti E., Matteoli G., Iliev I. D., Rescigno M. Comparison of the immunomodulatory properties of three probiotic strains of Lactobacilli using complex culture systems: prediction for in vivo efficacy. PLoS One 2009; 4, e7056.
36. Caselli M., Cassol F., Caló G., Holton J., Zuliani G., Gasbarrini A. Actual concept of „probiotics“: Is it more functional to science or business? World J. Gastroenterol. 2013; 19, 1527–1540.
37. Bassaganya-Riera J., Viladomiu M., Pedragosa M., De Simone C., Carbo A., Shaykhutdinov R., Jobin Ch., Arthur J. C., Corl B. A., Vogel H., Storr M., Hontecillas R. Probiotic bacteria produce conjugated linoleic acid locally in the gut that targets macrophage PPARγ to suppress colitis. PLoS One 2012; 7, e31238.
38. Jijon H., Backer J., Diaz H., Yeung H., Thiel D., McKaigney C., De Simone C., Madsen K. DNA from probiotic bacteria modulates murine and human epitelial and immune function. Gastroenterol. 2004; 126, 1358–1373.
39. Resta-Lenert S, Barrett K. E. Probiotics and commensals reverse TNF-alpha - and IFN-gamma-induced dysfunction in human intestinal epithelial cells. Gastroenterol. 2006; 130, 731–746.
40. Sakai F., Hosoya T., Ono-Ohmachi A., Ukibe K., Ogawa A., Moriya T., Kadooka Y., Shiozaki T., Nakagawa H., Nakayama Y., Miyazaki T. Lactobacillus gasseri SBT2055 induces TGF-βα expression in dendritic cells and activates TLR2 signal to produce IgA in the small intestine. PLoS One 2014; 9, e105370.
41. De Kivit S., Tobin M. C., Forsyth C. B., Keshavarzian A., Landay A. Regulation of intestinal immune responses through TLR activation: implication for pro - and prebiotics. Front. Microbiol. 2014; 5, 1–7.
42. Galdeano C. M., Perdigón G. The probiotic bacterium Lactobacillus casei induces activation of the gut mucosal immune system through innate imunity. Clin. Vaccine Immunol. 2006; 13, 219–226.
43. Smits H. H., Engering D., van der Kleij E. C., de Jong K., Schipper T. M. M., van Capel B. A., Zaat M. Selective probiotic bacteria induce IL-10-producing regulatory cells in vitro by modulating dendritic cell 3-grabbing nonintegrin. J. Allergy Clin. Immunol. 2005; 115, 1260–1267.
44. Viljanen M., Pohjavuori E., Haahtela T., Korpela R. Induction of inflammation as a possible mechanism of probiotic effect in atopic eczema-dermatitis syndrome. J. Allergy Clin. Immunol. 2005; 115, 1254–1259.
45. Guarino A., Lo Vecchio A., Canani R. B. Probiotics as prevention and treatment for diarhea. Curr. Opin. Gastroenterol. 2009; 25, 18–23.
46. Zhang L., Li N., Caicedo R., Neu J. Alive and died Lactobacillus rhamnosus GG decrease tumor necrosis factor-α-induced interleukin-8 production in Caco-2 cells. J. Nutr. 2005; 135, 1752–1756.
47. Tien M. T., Girardin S. E., Regnault B., Le Bourhis L., Dillies M. A., Coppee J. Y. Anti-inflammatory effect of Lactobacillus casei on Shigella-infected human intestinal epitelial cells. J. Immunol. 2006; 176, 1228–1237.
48. Frick J. S., Schenk K., Quitadamo M., Kahl F., Koberle M., Bohn E. Lactobacillus fermentum attenuates the proinflammatory effect of Yersinia enterocolitica on human epithelial cells. Inflamm. Bowel Dis. 2007; 13, 83–90.
49. Ruiz P. A., Hoffmann M., Szcesny S., Blaut M., Haller D. Innate mechanisms for Bifidobacterium lactis to activate transient pro-inflammatory host responses to intestinal epithelial cells after the colonization of germ-free rats. Immunology 2005; 115, 444–450.
50. Gourbeyre P., Denery S., Bodinier M. Probiotics, prebiotics, and synbiotics: impact on the gut immune system and allergic reactions. J. Leuko. Biol. 2011; 89, 685–694.
51. Pelto L., Isolauri E., Lilius E. M., Nuutila J., Salminen S. Probiotic bacteria down-regulate the milk-induced inflammatory response in milk-hypersensitive subjects but have an immunostimulatory effect in healthy subjects. Clin. Exp. Allergy 1998; 28, 1474–1479.
52. Aimutis W. R. Biology of Lactobacillus acidophilus. In: Batt C. A., Tortorello M.-L. (eds.) Encyclopedia of food microbiology. 2nd ed. London: Elsevier Ltd., Academic Press 2014.
53. Marin M. L., Lee J. H., Murtha J., Ustunol Z., Pestka J. J. Differential cytokine production in clonal macrophage and T-cell lines cultured with bifidobacteria. J. Dairy Sci. 1997; 80, 2713–2720.
54. Herbel S. R., Vahjen W., Wieler L. H., Guenther S. Timely approaches to identify probiotic species of the genus Lactobacillus. Gut Pathogens 2013; 5, 27.
55. Iliev I. D., Tohno M., Kurosaki D., Shimosato T., He F., Hosoda M., Saito T., Kitazawa H. Immunostimulatory oligodeoxynucleotide containing TTTCGTTT motif from Lactobacillus rhamnosus GG DNA potentially suppresses OVA-specific IgE production in mice. Scand. J. Immunol. 2008; 67, 370–376.
56. Tlaskalová-Hogenová H., Štepanková R., Kozáková H., Hudcovič T., Vannucci L., Tučková L., Rossmann P., Hrnčiř T., Kverka M., Zakostelská Z., Klimešová K., Přibylová J., Bártová J., Sanchez D., Fundová P., Borovská D., Srůtková D., Zídek Z., Schwarzer M., Drastich P., Funda D. P. The role of gut microbiota (commensal bacteria) and the mucosal barrier in the pathogenesis of inflammatory and autoimmune diseases and cancer. Contribution of germ-free and gnotobiotic animal models of human diseases. Cell Mol. Immunol. 2011; 8, 110–120.
57. Kamada N., Núnez G. Regulation of the immune system by the resident intestinal bacteria. Gastroenterology 2014; 146, 1477–1488.
58. Aureli P., Capurso L., Castellazzi A. M., Clerici M., Giovannii M., Morelli L., Poli A., Pregliasco F., Salvini F., Zuccotti G. V. Probiotics and health: An evidence based review. Pharmacol. Res. 2011; 63, 366–376.
59. Bermúdez-Humarán L. G., Aubry C., Motta J. P., Deraison C., Steidler L., Vergnolle N., Chatel J. M., Langella P. Engeneering lactococci and lactobacilli for human health. Curr. Opinion Microbiol. 2013; 16, 278–283.
60. Cano-Garrido O., Seraz-Franzoso J., Garcia-Fruitós E. Lactic acid bacteria: reviewing the potential of a promising delivery live vector for biomedical purposes. Microb. Cell Fact. 2015; 14, 137.
61. Braat H., Rottiers P., Hommers D. W., Huyghebaert N., Remaut E., Remon J. P., van Deventer S. J., Neirynck S., Peppelenbosch M. P., Steidler L. A phase 1 trial with transgenic bacteria expressing interleukin-10 in Crohn’s disease. Clin. Gastroenterol. Hepatol. 2006; 4, 754–759.
62. Vandenbroucke K., Haard H., Beinaert E., Dreier T., Lauwereys M., Huyck L., Van Huysse J., Demetter P., Steidler L., Reumaut E. Orally administered L. lactis secreting an anti-TNF nanobody demonstrate efficacy in chronic colitis. Mucosal Immunol. 2010; 3, 49–56.
63. Vijayan V., Mueller S., Baumgart-Vogt E., Immenschuh S. Heme oxygenase-1 as a therapeutic target in inflammatory disorders of the gastrointestinal tract. World J. Gastroenterol. 2010; 16, 3112–3119.
64. Caluwaerts S., Vandenbroucke K., Steidler L., Neirynck S., Vanhoenacker P., Corveleyn S., Watkins B., Sonis S., Coulie B., Rotters P. AG013, a mouth rinse formulation of Lactococcus lactis sectering human Trefoil Factor 1, provides a safe an efficacious therapeutic tool for treating oral mucositis. Oral Oncol. 2010; 46, 564–570.
65. Motta J. P., Magne L., Descamps D., Rolland C., Squarzoni-Dale C., Rosset P., Martin L., Cenac N., Balloy V., Huerre M. Modifying the protease, antiprotease pattern by elafin overexpression protects mice from colitis. Gastroenterol. 2011; 140, 1272–1282.
66. Motta J. P., Bermúdez-Humarán L. G., Deraison C., Martin L., Rolland C., Rousset P., Boue J., Dietrich G., Chapman K., Kharrat P. Food-grade bacteria expressing elafin protect against inflammation and restore colon homeostasis. Sci. Transl. Med. 2012; 4, 144–158.
67. Bernstein C. N. Treatment of IBD: where we are and where we are going. Am. J. Gastroenterol. 2015; 110, 114–126.
68. Shaw L., Wiedow O. Therapeutic potential of human elafin. Biochem. Soc. Trans. 2011; 39, 1450–1454.
69. Carroll I. M., Andrus J. M., Bruno-Barcena J. M., Klaenhammer T. R., Hassan H. M., Threadgill D. S. Anti-inflammatory properties of Lactobacillus gasseri expressing manganese superoxide dismutase using the interleukin 10-deficient mouse model of colitis. Am. J. Physiol. Gastrointest. Liver Physiol. 2007; 293, G729–G738.
70. Watterlot L., Rochat T., Sokol H., Cherbuy C., Bouloufa I., Lefevre F., Gratadoux J. J., Honvo-Hueto E., Chilmonczyk S., Blugeon S. Intragastric administration of a superoxide dismutase-producing recombinant Lactobacillus casei BL23 strain attenuates DSS colitis in mice. Int. J. Food Microbiol. 2010; 144, 35–41.
71. LeBlanc J. G., del Carmen S., Miyoshi A., Azevedo V., Sesma F., Langella P., Bermúdez-Humarán L. G., Watterlot L., Perdigon G., LeBlanc A. D. Use of superoxide dismutase and catalase producing lactic acid bacteria in TNBS induced Crohn’s disease in mice. J. Biotechnol. 2011; 151, 287–293.
72. Ljungh A., Wadström T. From probiotics, prebiotics and symbiotics to „living drugs“. In: Ljungh Å., Wadström T. eds. Lactobacillus molecular biology: From genomics to probiotics. 1st ed. Norfolk: Caister Academic Press 2009.
73. LeBlanc J. G., Aubry C., Cortes-Perez N. G., Dde Moreno de LeBlanc A., Vergnolle N., Langella P., Azevedo V., Chatel J. M., Miyoshi A., Bermudez-Humaran L. G. Mucosal targeting of therapeutic molecules using genetically modified lactic acid bacteria: an update. FEMS Microbiol. Lett. 2013; 344, 1–9.
74. Bermudez-Humaran L. G., Motta J. P., Aubry C., Kharrat P., Rous-Martin L., Sellenave J. M., Deraison C., Vergnolle N., Langella P. Serine protease inhibitors protect better than IL-10 and TGF-beta anti-inflammatory cytokines against mouse colitis when delivered by recombinant lactococci. Microb. Cell Fact. 2015;
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2016 Číslo 2- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
-
Všechny články tohoto čísla
- Predpokladané mechanizmy imunomodulačného a protizápalového pôsobenia probiotík
- Myši s absenciou jednotlivých molekulových foriem cholínesteráz
- Orální nežádoucí účinky léků při různých medikacích
- Fenolické sloučeniny rostlin rodu Iris (Iridaceae)
- Zhodnocení výskytu zácpy na odděleních LDN
- Výbor Slovenskej farmaceutickej spoločnosti na roky 2016–2020
-
Zemřel doc. RNDr. PhMr. Václav Rusek, CSc.
(25. února 1928 – 30. ledna 2016) - Bartunek A. Dejiny slovenského lekárnictva I, 10. storočie až 1918.
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Orální nežádoucí účinky léků při různých medikacích
- Predpokladané mechanizmy imunomodulačného a protizápalového pôsobenia probiotík
- Zhodnocení výskytu zácpy na odděleních LDN
- Fenolické sloučeniny rostlin rodu Iris (Iridaceae)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Současné možnosti léčby obezity
nový kurzAutoři: MUDr. Martin Hrubý
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





