-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSledování vzniku hydrátů diklofenaku sodné soli a jejich vlivu na disoluci léčiva z připravených tablet
Monitoring of formation of diclofenac sodium salt hydrates and their influence on the drug dissolution from prepared tablets
NIR spectroscopy together with multivariate data analysis were used to analyze the hydrates of diclofenac sodium prepared from the non-aqueous solvents tetrahydrofuran and methanol under standard laboratory conditions at 20 °C and relative humidity less than 60%. It was confirmed that the developed PLS regression model can monitor the process of formation of hydrates. It was also found that the hydrated form of diclofenac sodium arises during the preparation of the dosage form the using technology of impregnating the solid carrier by non-aqueous solvents, which resulted in reducing of the drug release rate from prepared tablets up to twice. NIR spectroscopy was confirmed as one of the effective PAT (Process Analytical Technology) methods.
Keywords:
process analytical technology method, PLS regression, NIR spectroscopy, hydrates, impregnation, diclofenac sodium
Autoři: Petr Doležel; Jan Muselík; Michaela Králová; David Vetchý
Vyšlo v časopise: Čes. slov. Farm., 2013; 62, 259-263
Kategorie: Původní práce
Souhrn
NIR spektroskopie společně s vícerozměrnou analýzou dat se použila k analýze hydrátů diklofenaku sodné soli připravených z nevodných rozpouštědel tetrahydrofuranu a methanolu za standardních laboratorních podmínek při 20 °C a RH < 60 %. Potvrdilo se, že pomocí vyvinutého PLS regresního modelu lze sledovat proces vzniku hydrátů. Dále se zjistilo, že při přípravě lékové formy využívající impregnaci na pevný nosič z nevodných rozpouštědel vzniká hydratovaná forma diklofenaku sodné soli, což se výsledně projevuje až dvojnásobným zpomalením uvolňování léčiva z tablet. NIR spektroskopie se zde potvrdila jako jedna z účinných PAT (process analytical technology) metod.
Klíčová slova:
PAT metody, PLS regrese, NIR spektroskopie, hydráty, impregnace, diklofenak sodná sůlÚvod
Odhaduje se, že nejméně 1/3 farmaceuticky účinných látek je schopna s molekulami vody vytvářet pevnou krystalickou strukturu zvanou hydrát. Tato pseudopolymorfní přeměna může nastávat v průběhu technologických procesů, jako je vlhká granulace, potahování tablet, krystalizace, nebo během skladování suroviny. Hydratovaná látka pak může mít odlišné fyzikální, chemické a farmakologické vlastnosti, jako jsou tokové vlastnosti, elektrostatický náboj, adhezivita, rozpustnost, stabilita nebo biodostupnost1–3).
Mezi látky schopné tvořit hydráty za běžných podmínek se řadí i diklofenak sodná sůl (DS). Už za podmínek dlouhodobého stabilitního zkoušení (25 ± 2 °C/60 ± 5 % relativní vlhkosti (RH) nebo 30 ± 2° C/65 ± 5 % RH) dochází prokazatelně k začleňování molekul vody ze vzdušné vlhkosti do krystalické struktury. Hydráty mohou vznikat i při krystalizacích DS z nevodných rozpouštědel při 25 °C a RH menším než 60 %1, 4).
Jedna z vhodných metod ke studiu procesů tvorby hydrátů je spektroskopie v blízké infračervené oblasti (NIR spektroskopie), protože v oblasti vlnových délek 800–2500 nm dochází k absorpci záření především u lehkých atomů s vodíkem, tedy i O-H v molekule vody. Jedná se o metodu procesní analytické technologie (process analytical technology, PAT) umožňující analyzovat vzorky přímo bez úprav, jako je rozpouštění, drcení nebo ředění, a tedy s minimálním ovlivněním krystalické struktury látky5). Jelikož výsledná spektra vznikají z velkého množství překrývajících se pásů, využívají se k jejich analýze vícerozměrné metody dekompozice dat, jako např. PLS regrese nebo-li metoda částečných nejmenších čtverců. Touto metodou je možné vyjádřit závislosti mezi maticí spektrálních dat a maticí závislé proměnné (např. obsahu vody) pomocí redukovaného počtu latentních proměnných, tzv. principal components, a odhalit tak spektrální pásy, které významně popisují závislou proměnnou6).
Cílem práce byla příprava hydrátů diklofenaku sodné soli a jejich hodnocení s využitím NIR spektroskopie, ověřování jejich vzniku při výrobě lékové formy využívající impregnaci na pevný nosič v prostředí organického rozpouštědla a sledování jejich vlivu na disoluční profil připravené lékové formy. Impregnace je v současnosti považována za progresivní metodu, díky které je možné připravit stabilní hydráty nebo polymorfy léčiv, a ovlivnit tak jejich biodostupnost nebo zlepšit obsahovou stejnoměrnost práškových směsí7, 8).
Pokusná část
Použité suroviny
Diklofenak sodná sůl (DS, Š: OP00407; Zentiva a.s.; Česká republika); Methanol (MeOH, Š: 4530051957; Dr. Kulich Pharma; Česká republika); Tetrahydrofuran (THF‘) (Š:1502260210; Penta; Česká republika); Mikrokrystalická celulosa (Avicel PH101; Š: 24015007; Pliva-Lachema; Česká republika); Koloidní oxid křemičitý (Aerosil 200; Š: 24020707; Zentiva; Česká republika); Hydrogenfosforečnan vápenatý (Š: 01/51699-01; Budenheim; Německo); Stearan hořečnatý (Š: C3228246, Kulich, Česká republika).
Metodika
Příprava hydrátů diklofenaku
Podle postupů z literatury se připravilo několik typů hydrátů. V literatuře popsaný DS tetrahydrát (DSH4a) obsahuje 20 hm.% vody, tetrahydrát DS (DSH4b) 20,9 hm. % vody, trihydrát DS (DSH3) 16 hm.% vody a 4,75 hydrát (DSH4,75) 21,2 hm. % vody. DSH4a se připravil skladováním DS v tenké vrstvě na Petriho misce v prostředí o 100 % RH při 20 °C po dobu 24 h. DSH4b se získal rekrystalizací z vody (100 mg DS v 10 ml H2O) při 20 °C. DSH3 se připravil a) dehydratací DSH4a při teplotě 40 °C po dobu 3 minut v horkovzdušné troubě, b) uložením DS po dobu 20 minut v prostředí při 40 °C a 75 % RH. DSH4,75 se připravil rekrystalizací z methanolu (50 mg DS v 5 ml MeOH) při 20 °C po dobu 48 h1, 4, 9).
Analýza hydrátů s využitím NIR spektroskopie
Vzorky připravených hydrátů a bezvodého DS (0,5 g) se bezprostředně po přípravě měřily metodou difuzní reflektance na FT-NIR spektroskopu Nicolet Antaris (Thermo Electron Corporation, Madison, USA). Měřilo se v rozsahu vlnočtů 10 000–4000 cm–1 s rozlišením 4 cm–1. Každý vzorek se proměřil 60krát a získalo se spektrum průměrné. Naměřená spektra se upravila metodou SNV (standard normal variate) normalizace, pro korekci efektu rozptylu záření. Následně se provedlo vysušení hydrátů v sušárně při 130 °C po dobu 15 minut, aby se gravimetricky zjistil obsah krystalicky vázané vody1, 4). Z naměřených dat se sestrojil vícerozměrný PLS (partial least squares) model pro zjištění závislostí mezi maticí X naměřených spekter a maticí Y % obsahu vody v hydrátech (program Unscrambler X, v. 1.3, Camo Software). Model se validoval úplnou křížovou validací, při které se použije stejná sada vzorků jako při kalibraci s vyloučením vždy jednoho ze standardů. Ze zbylých kalibračních dat se poté sestrojí nový model, který se použije pro kvantifikaci vyloučeného standardu6).
Příprava lékové formy impregnací
Během procesu impregnace se rekrystaloval DS z organického rozpouštědla v disperzním prostředí pomocných látek.
V úvodních experimentech se zkoušela rekrystalizace DS z čistých rozpouštědel MeOH a THF při standardních podmínkách 20 °C a RH < 60% a vzniklé krystaly se následně analyzovaly s využitím NIR spektroskopie na obsah krystalické vody. Následovala příprava tabletoviny s léčivem vázaným impregrací na nosič, která se již neanalyzovala NIR spektroskopií z důvodu nízkého obsahu léčiva ve směsi a složitého způsobu kalibrace. Předpokládalo se, že léčivo vytvořilo stejnou krystalickou formu jako při krystalizaci z čistých rozpouštědel a impregnace na nosič zabránila jeho případné přeměně1, 4, 9).
Disperzní prostředí pro metodu impregnace bylo složené z mikrokrystalické celulosy, koloidního bezvodého oxidu křemičitého a hydrogenfosforečnanu vápenatého. Zhomogenizované látky (4 min; 48 ot./min; Turbula T2F; Švýcarsko) se přesypaly do zařízení Rotolab (Zanchetta; Itálie) a homogenizovaly se společně s DS předem rozpuštěném v MeOH, nebo THF při 40 °C při 1200 ot./min a za sníženého tlaku do úplného odpaření. Poté se k naimpregnované směsi přidaly extragranulární látky (magnesium-stearát a karmelosa sodná sůl) a tabletovina se homogenizovala v přístroji Turbula po dobu 4 minut. Prostou homogenizací pomocných látek s bezvodým DS po dobu 10 minut se dále připravila kontrolní směs. Složení tabletoviny bylo v poměru DS : mikrokrystalická celulosa : koloidní bezvodý oxid křemičitý : hydrogenfosforečnan vápenatý : stearan hořečnatý : karmelosa sodná sůl 15 : 30 : 1 : 51 : 1 : 2 hm.%.
Z tabletovin se vylisovaly tablety s půlící rýhou uprostřed (výstředníkový tabletovací lis KORSCH) o průměrné hmotnosti přibližně 400 mg a o pevnostech 35 N, 65 N a 120 N.
Analýza lékové formy disoluční zkouškou
Disoluce se provedla na přístroji s pádly (SOTAX AT7 Smart, Švýcarsko) při 37 °C, 50 ot./min, v tlumivém fosforečnanovém roztoku o pH 6,8. Vzorky se odebíraly v 5minutových intervalech po dobu 30 minut a sledovala se absorbance při vlnové délce 276 nm (Perkin Elmer, Lambda 25). Disoluční zkouška se prováděla se třemi tabletami od každého vzorku.
Výsledky a diskuze
Příprava hydrátů diklofenaku
Podle postupů uvedených v literatuře se připravily hydráty DS. Sušením se zjistil obsah vody: 21,06 hm.% v DSH4a, 20,96 hm.% v DSH4b, 18,8 hm.% v DSH3 připraveného variantou a), resp. 4,64 hm.% v DSH3 připraveného variantou b) a 21,24 hm.% v DSH4,75. Kromě postupu pro DSH3 varianta b) se obsah vázané vody přibližně shodoval s literárními zdroji a předpokládalo se tedy, že se připravily tri - a více-hydráty DS.
Analýza hydrátů s využitím NIR spektroskopie
Ze spekter naměřených z připravených hydrátů se sestrojil PLS model vyjadřující závislost mezi intenzitami vlnových délek a obsahem vody v hydrátech. V grafu komponentních skóre (obr. 1) je 99 % variability matice X a Y popsáno již 1. komponentou. Rozložení vzorků podle 1. komponenty odpovídá jejich hydrataci a je zde dobře patrný rozdíl mezi bezvodým DS, resp. DSH3varianta b) s nejnižší hodnotou vázané vody a ostatními více-hydráty. Takto sestrojený model vykazuje dobrou kalibrační statistiku (koeficient determinace R2 = 0,978; chyba predikce RMSECV = 1,52). Na obrázku 2 jsou znázorněná měřená spektra. V oblasti 7000 a 5000 cm–1 je možné pozorovat rostoucí spektrální pásy v závislosti na hydrataci, náležící overtonům, resp. kombinačním přechodům OH skupin vody10). Vyvinutý PLS model tak umožňoval sledovat proces vzniku hydrátů.
Obr. 1. PLS-graf komponentních skóre zobrazuje rozložení vzorků v prostoru prvních dvou komponent. Z hlediska interpretace je významná 1. komponenta s 99 % vysvětlené celkové variability. Šipka znázorňuje trend hydratace. V levé části anhydrát DS, následuje částečně hydratovaný vzorek DSH3 varianta b). V pravé části více-hydráty DS. 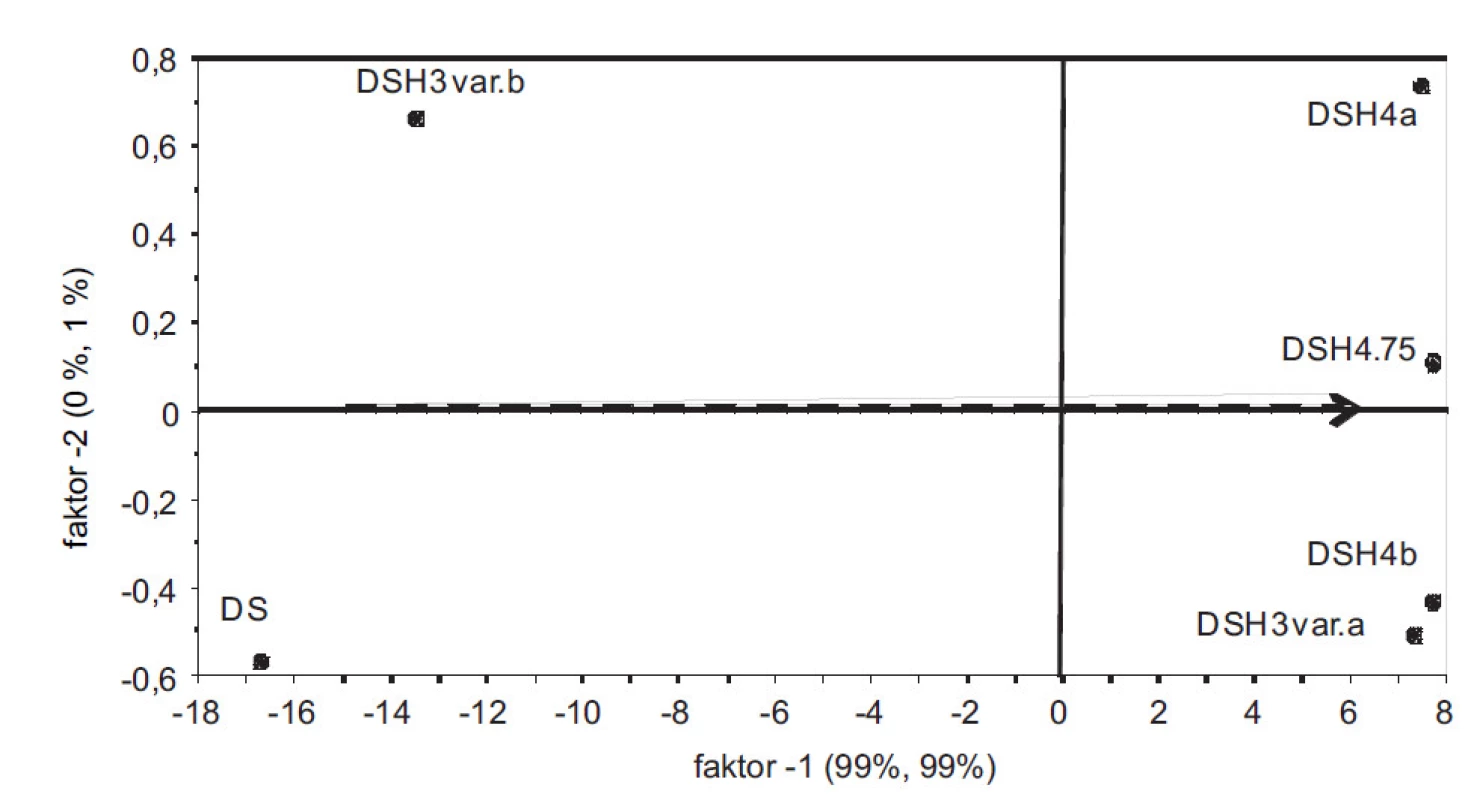
Obr. 2. Znázornění NIR spekter studovaných vzorků. V oblasti 5000 a 7000 cm<sup>–1</sup> jsou označené (---) měnící se spektrální pásy, které náleží overtonům, resp. kombinačním přechodům OH skupin vody a vyjadřují stupeň hydratace. V oblasti 6633 a 6000 cm<sup>–1</sup> se projevuje silná absorpce bezvodého DS a DSH3 varianta b). 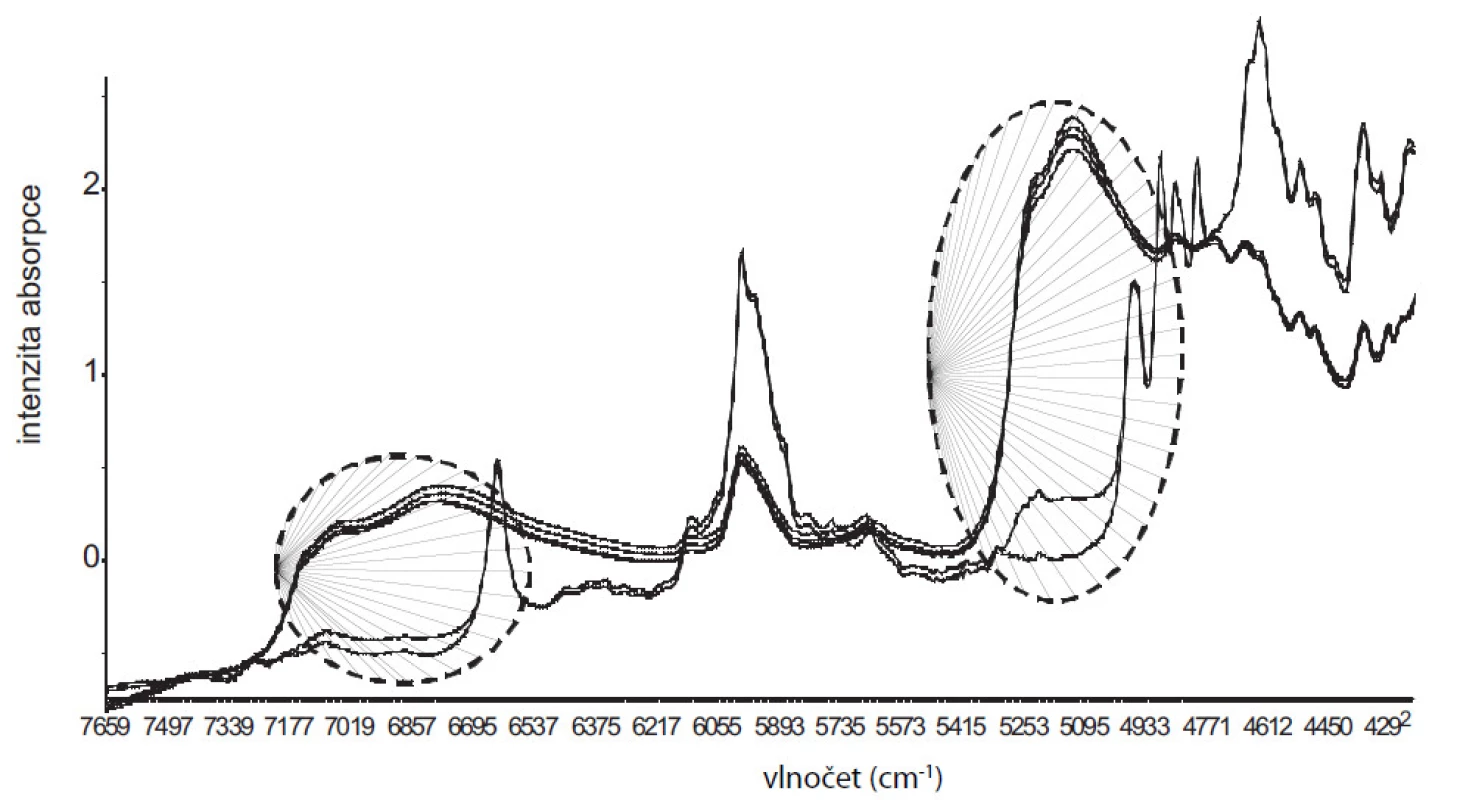
Příprava lékové formy impregnací
Rekrystalizací DS z nevodných rozpouštědel (MeOH, THF) za standardních podmínek se připravily krystaly, které se v 1. a 13. dnu po přípravě měřily NIR spektroskopií a na základě vyvinutého PLS modelu se z naměřených spekter předpověděl obsah vázané vody. V případě THF se 1. i 13. den zjistily přibližně stejné hodnoty 18,8, resp. 18,7 % vody. V případě MeOH se 1. den zjistila hodnota 18,1 % a 13. den hodnota 18,6 % vody. Z obrázku 3 pro MeOH je patrné, že bezprostředně po přípravě krystalů vzorek obsahoval zbytky nehydratované formy DS, která během 13 dnů hydratovala. Vzorky MeOH a THF po 13 dnech skladování již obsahovaly přibližně stejný obsah vody, a tedy i pravděpodobně stejnou formu hydrátu. Vzhledem k chybě predikce 1,52% hydratované vody lze předpokládat vznik tri - nebo více-hydrátů DS.
Obr. 3. NIR spektra bezvodého DS a hydrátů DS vykrystalizovaných z methanolu 1. a 13. den po přípravě. Šipka označuje spektrální oblast, v níž absorbuje bezvodá forma DS. Ze spekter je patrné, že v 1. dnu po vykrystalizování vzorek obsahoval částečně bezvodou formu DS, která během 13 dnů přešla na formu hydratovanou. 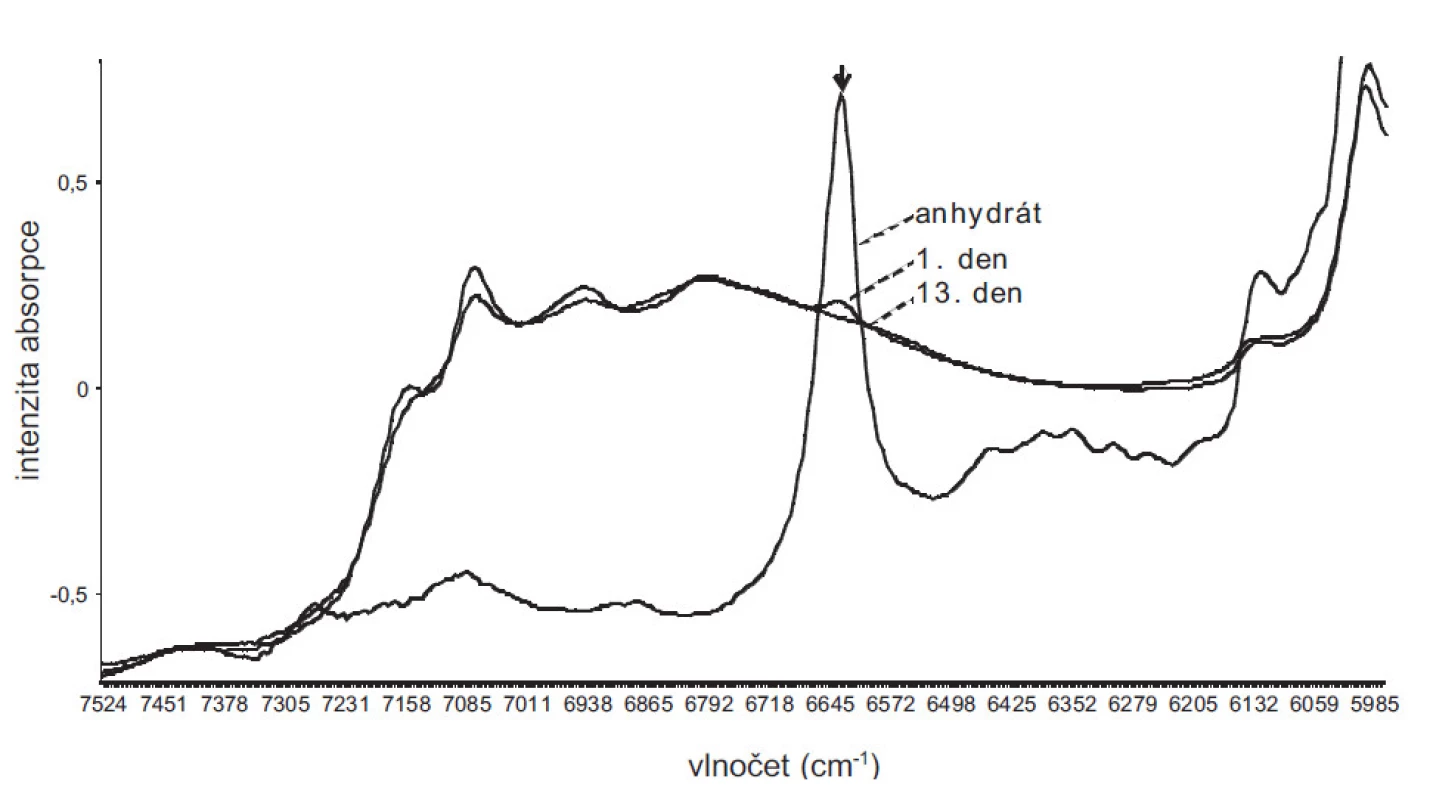
Analýza lékové formy disoluční zkouškou
Na základě disoluce tablet připravených při různých lisovacích tlacích se zjistilo, že nejrychleji se uvolňuje léčivo z kontrolní směsi připravené prostou homogenizací s bezvodým DS. Na obrázku 4 pro tablety lisované tlakem 65 N je patrné nižší množství uvolněného DS z obou rozpouštědel, kde DS z THF jeví přibližně dvojnásobné snížení rozpustnosti. V literatuře se popisuje 2,5 - a 1,7násobně nižší rozpustnost tetra-, resp. tri-hydrátu DS v porovnání s bezvodou formou1). Vyšší množství uvolněného DS ze vzorku MeOH oproti THF bylo způsobeno pravděpodobně nekompletní hydratací diskutovanou výše. Z výsledků lze usuzovat, že během procesu impregnace léčiva na pevný nosič z nevodných rozpouštědel došlo ke vzniku hydratovaných forem DS, což se projevilo zpomalením uvolňování léčiva z tablet.
Obr. 4. Porovnání disolučních profilů tablet s diklofenakem sodnou solí o pevnosti 65 N ve fosforečnanovém pufru o pH 6,8 pro tablety lisované z bezvodého DS (■), impregnovaného DS z methanolu (●) a tetrahydrofuranu (▲). Chybové úsečky znázorňují směrodatnou odchylku. 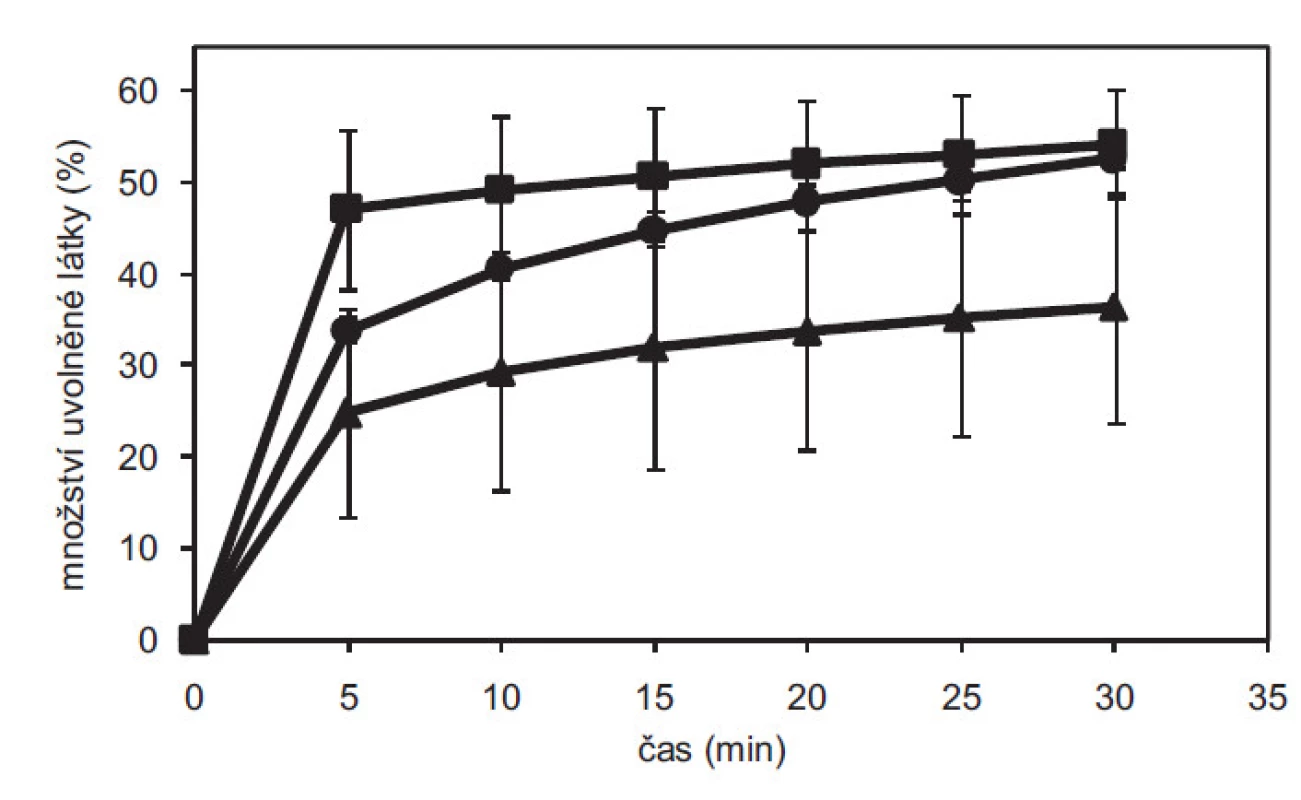
Střet zájmů: žádný.
Došlo 16. září 2013
Přijato 11. listopadu 2013
P. Doležel • doc. Mgr. Jan Muselík, Ph.D. (∗) • D. Vetchý
Ústav technologie léků, Veterinární a farmaceutická univerzita
Palackého tř. 1/3, 612 42 Brno
e-mail: muselikj@vfu.cz
M. Králová
Ústav hygieny a technologie mléka, Fakulta veterinární hygieny a ekologie, Veterinární a farmaceutická univerzita Brno
Zdroje
1. Bartolomei M., Rodomonte A., Antoniella E., Minelli G., Bertocchi P. Hydrate modifications of the non-steroidal anti-inflammatory drug diclofenac sodium: Solid-state characterisation of a trihydrate form. J Pharmaceut Biomed 2007; 45, 443–449.
2. Kou X., Chan L. W., Steckel H., Heng P. W. S. Physico-chemical aspects of lactose for inhalation. Adv Drug Deliver Rev 2012; 64, 220–232.
3. Karner S., Urbanetz N. A. The impact of electrostatic charge in pharmaceutical powders with specific focus on inhalation-powders. J Aerosol Sci 2011; 42, 428–445.
4. Bartolomei M., Bertocchi P., Antoniella E., Rodomonte A. Physico-chemical characterisation and intrinsic dissolution studies of a new hydrate form of diclofenac sodium: comparison with anhydrous form. J Pharmaceut Biomed 2006; 40, 1105–1113.
5. Muselík J. Aplikace blízké infračervené spektroskopie ve farmaceutické analýze. Chem Listy 2012; 106, 10–15.
6. Esbensen K. H. Multivariate Data Analysis – In Praktice, 5. vyd. CAMO Process AS 2004; 598.
7. Franc A., Rabišková M., Goněc R. Impregnation: a progressive method in the production of solid dosage forms with low content of poorly soluble drugs. Eur J Parent Pharm Sci 2011; 16, 85–93.
8. Franc A., Rabišková M., Goněc R. Impregnation method in the production of solid dosage forms containing low-dose poorly absorbable drugs. Ind Pharm 2011; 26, 7–9.
9. Llina’s A., Burley J. C., Box K. J., Glen R. C., Goodman J. M. Diclofenac Solubility: Independent determination of the intrinsic solubility of three crystal forms. J Med Chem 2007; 50, 979–983.
10. Gastaldi D., Canonico F., Irico S., Pellerej D., Paganini M. C. Near-infrared spectroscopy investigation on the hydration degree of a cement paste. J Mater Sci 2010; 45, 3169–3174.
Štítky
Farmacie Farmakologie
Článek Nové knihyČlánek Rejstříky
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2013 Číslo 6- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
-
Všechny články tohoto čísla
- Fyziologické faktory ovlivňující osud léčiva v gastrointestinálním traktu
- Cationic Eudragit® Polymers as Excipients for Microparticles Prepared by Solvent Evaporation Method
- Nové knihy
- Vplyv kvartérnej amóniovej soli na liberáciu liečiva s antiseptickým účinkom
- Sledování vzniku hydrátů diklofenaku sodné soli a jejich vlivu na disoluci léčiva z připravených tablet
- K životnímu jubileu doc. RNDr. PhMr. Milana Čeladníka, CSc.
- Alkalimetrické titrácie solí organických zásad v liekopise
- Stanovenie vareniklínu v lieku Champix® dvojdimenzionálnou kapilárnou elektroforézou v spojení s UV detekciou
- Pohľad na poskytovanie starostlivosti v oblasti liekov na Slovensku – lekárnik a pacient
- A chapter from the history of the pharmacy of the Brothers of Mercy in Spišské Podhradí in the 19th and 20th centuries
- 42. sympozium klinické farmacie
- Padesát let seminářů a sympozií z dějin farmacie
- Rejstříky
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pohľad na poskytovanie starostlivosti v oblasti liekov na Slovensku – lekárnik a pacient
- Alkalimetrické titrácie solí organických zásad v liekopise
- Vplyv kvartérnej amóniovej soli na liberáciu liečiva s antiseptickým účinkom
- Fyziologické faktory ovlivňující osud léčiva v gastrointestinálním traktu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Současné možnosti léčby obezity
nový kurzAutoři: MUDr. Martin Hrubý
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



