-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaObsahová stejnoměrnost směsí a tablet obsahujících warfarin
Content uniformity of warfarin-containing mixtures and tablets
This experimental study describes the method of direct compression of powder mixtures composed of warfarinum sodium salt. Warfarinum is a drug with a narrow therapeutics index. The aim of this study is to find a suitable composition and a process of preparing tablets with the best uniformity. The content uniformity is very important for the safety of the therapy. This study links up with the already published article including the results of content uniformity of mixtures and tablets prepared by direct compression. These mixtures contain fillers with different density and distribution size of the particles (excipients with digger particles were used in this experiment). The study is focused on the influence of magnesium stearate, which was added at the beginning of the homogenization or after the mixing of the other components. In addition to content uniformity and physical characteristics of the tablets, the study also evaluated the uniformity and physical characteristics of the mixtures. In this experimental study it has been found out that content uniformity is influenced by the total time of homogenization and the addition of magnesium stearate and much less by the distribution size of the particles of excipients in the mixtures. The appropriate selection of process parameters is important for obtaining tablets respecting the strict criterion of Bergum distribution. This distribution is a part of the GMP by the evaluation of the content uniformity in the U.S.
Keywords:
warfarin • content uniformity • homogenization • GMP
Autoři: Aleš Franc; Jan Muselík; Radka Máslová; Jana Hadrabová
Působiště autorů: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků, Brno
Vyšlo v časopise: Čes. slov. Farm., 2013; 62, 177-181
Kategorie: Původní práce
Souhrn
Práce popisuje metodu přímého lisování suchých směsí s obsahem warfarinu, který zde slouží jako modelové léčivo s úzkým terapeutickým indexem. Cílem bylo nalézt dostatečně robustní složení a postup přípravy tablet, které by vyhověly limitům obsahové stejnoměrnosti pro zavádění léku do výroby. Tyto limity jsou zároveň zárukou bezpečné farmakoterapie1). Experiment navazuje na již publikovaný článek shrnující výsledky obsahové stejnoměrnosti tablet vyrobených metodou přímého lisování směsí s obsahem plniv s rozdílnou velikostí distribuce částic a s různou hustotou. K nim pak byla v různém stupni mísení přidána kluzná látka2). Na základě těchto výsledků bylo nyní zvoleno plnivo s větší velikostí částic a jako proměnné sloužily rozdílný čas homogenizace a přísada kluzné látky v různém stupni mísení. Vedle obsahové stejnoměrnosti a fyzikálních vlastností tablet byla hodnocena i fyzikální charakteristika a obsahová stejnoměrnost suchých směsí. Z výsledků plyne, že obsahovou stejnoměrnost ovlivňuje zejména doba mísení spojená s přísadou stearanu hořečnatého na počátku či v průběhua homogenizace a mnohem méně distribuce velikosti částic složek směsi. Při správné volbě výrobních parametrů je možné obdržet tablety, které vyhovují přísnému kritériu Bergumova rozdělení, které je součástí SVP při validaci obsahové stejnoměrnosti tablet v USA.
Klíčová slova:
warfarin • obsahová stejnoměrnost • mísení • SVPÚvod
Warfarin patří do skupiny perorálních antikoagulancií s úzkým terapeutickým indexem. Za účelem individualizace léčby musí být odpovídající terapeutická hladina léčiva v krvi pečlivě vytitrována. Kolísání obsahu léčiva v tabletě ovšem může způsobit rozdílnost plazmatických hladin mimo rámec stanovené dávky. Aby se této možnosti zamezilo, rozhodly se registrační autority v USA zpřísnit kontrolu léčiv a vedle hodnocení finální lékové formy zkoušet i meziprodukt, v tomto případě tabletovou směs3).
Statistické metody uplatňující se v hodnocení obsahové stejnoměrnosti
ČL 2009 nabízí k hodnocení obsahové stejnoměrnosti dva články. Vývojově starší článek 2.9.6. hodnotí obsahovou stejnoměrnost na základě nalezených obsahů u deseti vzorků a jejich průměru, přičemž hlavní interval pro jednotlivé vzorky činí 85–115 % nalezeného průměru. Z tohoto principu vychází i požadavek FDA, který se týká zejména tabletovin a kde se lékopisný limit zužuje na 90–110 % a zároveň se požaduje RSD do 5 %. Článek ovšem nijak nezohledňuje, zda je průměrný obsah správný. Tuto nevýhodu u dávkových lékových forem odstranil článek 2.9.40, který hodnotí nejen individuální odchylky jednotlivých vzorků, ale za pomoci výpočtu zohledňuje i odchylku nalezeného průměrného obsahu od obsahu teoretického.
Z hlediska SVP je pak důležité, aby přípravek odpovídal nejen zavedeným lékopisným článkům (případně limitu FDA), ale aby jejich limitům vyhověl i na statisticky významné hladině spolehlivosti. K tomuto účelu je možné využít tzv. index správnosti Cpk a metodu Bergumova rozdělení. Pokud hodnota Cpk dosahuje alespoň hodnoty 1 a pokud RSD u tablet dosahuje na daném počtu vzorků tabelovaných hodnot Bergumova rozdělení, pak přípravek na statisticky významné hladině spolehlivosti splní lékopisné kritérium. Cpk index lze aplikovat na pevné limity článku 2.9.6 a požadavek FDA, které se zde používají především k hodnocení směsí, zatímco Bergumovo kritérium vychází z článku 2.9.40 a využívá se obvykle k hodnocení tablet. Podrobnější popis těchto statistických nástrojů uvádí naše předchozí práce2).
Technologické faktory ovlivňující výslednou homogenitu přípravku
Aby tablety vyhovovaly těmto požadavkům, je třeba – vedle vhodného složení – zvolit správné procesní podmínky přípravy. Sem patří pořadí přídavku jednotlivých součástí směsi, zejména kluzných látek, a délka a intenzita mísení. Neplatí zde, že čím delší dobu jsou použité složky míseny, tím lepší bude dosažená obsahová stejnoměrnost. Naopak zde často dochází k jejímu zhoršení. Mluvíme pak o tzv. „přemíchání“ (over-mixing). Čas nutný k dosažení adekvátní homogenity směsi se určuje zpravidla experimentálně, pomocí analýzy vzorků, které jsou odebrány z předem stanovených míst v průběhu či na konci doby mísen3).
Důležitou roli zde hraje i fyzikální charakteristika složek směsi. Podstatnými jsou zejména hustota, velikost, tvar a elektrostatický náboj částic. Lze konstatovat, že se vzrůstající velikostí částic směsi se, až do jisté míry, zvyšuje i předpoklad k dosažení dobré obsahové stejnoměrnosti. Při mísení částic o průměru menším než 150 μm se ve zvýšené míře uplatňují i elektrostatické sily a u částic s velikostí pod 10 μm se prosazují síly Van der Waalsovy. Ty pak během mísení vedou k tvorbě nežádoucích aglomerátů. Z hlediska morfologie je vhodný kulovitý tvar. Vláknité částice do sebe zapadají, hůře se sypou, a tím i obtížněji mísí. Teoreticky nejlepší homogenity se docílí mísením kulovitých částic o průměru nad 150 μm, o stejné hustotě a poměru5). To je ovšem u tablet s nízkým obsahem účinné látky prakticky nerealizovatelné.
Analytické faktory ovlivňující výslednou homogenitu přípravku
Nezanedbatelnou úlohu při stanovení obsahové stejnoměrnosti léku a jeho meziproduktů hraje chyba vzorkování. V případě tablet je tato chyba zanedbatelná, jelikož zde nedochází k dělení vzorku a k analýze je možné využít samotných výlisků. U tabletovin je ovšem třeba odebrat jen reprezentativní vzorek, jehož množství koreluje s hmotností výsledné lékové formy. U suchých směsí se obvykle odebírá trojnásobek hmotnosti tablety6). Farmaceutická technologie nabízí několik možností odběru vzorků. Nejjednodušší je vzorkování kalibrovanou lopatkou, kde ovšem dochází k možné nežádoucí segregaci během vnoření lopatky do směsi a odebrání nereprezentativního vzorku. Další možností je odběr vzorkovací jehlou, která se pod určitým úhlem ponoří do směsi, a odebere se její část. I zde však, vlivem tlaku při zasouvání jehly, dochází k rozdružování směsi. Navíc zde může dojít k selektivnímu ulpívání jednotlivých složek na vnitřní povrch jehly. Poslední uváděnou možností je odběr vzorku z proudu toku směsi, například při jejím vypouštění z mísiče7). U malého množství tabletoviny je ovšem tato možnost prakticky neproveditelná.
Pokusná část
Příprava suchých směsí a tablet
Složení směsí a základní fyzikálně chemické vlastnosti jednotlivých složek jsou uvedeny v tabulce 1.
Tab. 1. Složení směsí a fyzikálně chemické vlastnosti jednotlivých složek 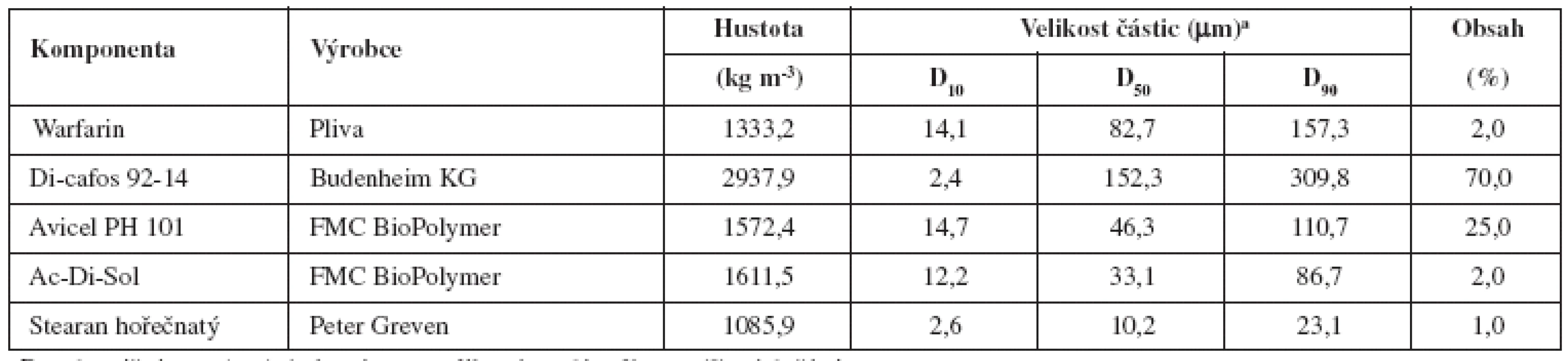
aDx = hraniční mez (μm) do které svou velikostí spadá x % proměřených částic Warafrin – sodná sůl warfarinu ve formě klathrátu izopropanolu Di-cafos – hydrogenfosforečnan vápenatý dihydrát Avicel PH 101 – mikrokrystalická celulosa Ac-Di-Sol – sodná sůl kroskarmelosy Jednotlivé látky se přesítovaly sítem o velikosti oka 250 μm a bezprostředně smísily po dobu 2, 5 nebo 15 minut (A, B, C). Alternativně se složky, vyjma stearanu hořečnatého, mísily 10 minut a následně pak 2 minuty (D), resp. 5 minut (E) po jeho přídavku. Mísení probíhalo v zařízení Turbula (T2C, Švýcarsko) rychlostí 40 otáček za minutu. Násada jedné šarže činila 500,00 g.
Celkem se připravilo deset tabletových směsí o identickém složení, za pomocí pěti technologických postupů (A, B, C, D, E), přičemž každým postupem byly připraveny dvě shodné šarže. Z jednotlivých směsí se nalisovaly ploché tablety o průmětu 7 mm a hmotnosti 200,0 mg pomocí excentrického lisu (Korsch EK0, Německo). Tablety z každé šarže se lisovaly při třech rozdílných lisovacích silách, odpovídajícím radiální pevnosti tablet o hodnotě přibližně 40, 70 a 110 N.
Hodnocení směsí a tablet
Každá hotová směs se umístila do nádoby tvaru válce o průměru dna 25 cm a lehkým, horizontálním pohybem po podložce se hladina směsi zarovnala do výšky asi 2 cm. Plocha směsi se rozdělila na deset stejných částí a z každé části se laboratorní lžičkou z povrchu „vykrojil“ vzorek o přibližné hmotnosti trojnásobku lékové formy. Každý odebraný vzorek se zvážil s přesností na desetinu miligramu.
U jednotlivých směsí se hodnotila setřesná a sypná hustota a z nich vyplývající charakteristiky jako Hausnerův poměr a Carrův index; dále sypnost a sypný úhel. Během lisování směsí se v pravidelných intervalech z každé šarže odebralo deset tablet na stanovení obsahové stejnoměrnosti. Kromě toho se pak u vzorků jednotlivých pevností tablet hodnotila hmotnost, výška, oděr a rozpadavost.
Obsah účinné látky ze vzorků směsí a tablet se stanovil pomocí kapalinového chromatografu YL 9100 (Young Lin Instrument) s kvaternární pumpou, automatickým dávkovačem a detektorem s diodovým polem. Mobilní fází byl methanol a 0,04 M kyselina mravenčí (64 : 36, v/v), její průtok byl 1,4 ml/min. Teplota kolony byla 25 °C, dávkováno bylo vždy 10 μl vzorku a spektra se snímala při 280 nm. Celková doba analýzy byla 7 minut. U směsí bylo všech deset vzorků o přesně známé hmotnosti kvantitativně převedeno do odměrných baněk a nechaly se rozpustit po dobu 24 hodin ve směsi methanol : voda v poměru 1 : 9 (v/v). Následující den byly z každého vzorku odebrány 2 ml roztoku, které byly odstředěny (10 minut, 15 000 ot. min-1) a následně se takto připravené vzorky analyzovaly pomocí HPLC. Kvantifikace byla provedena na základě kalibrační křivky, která vyjadřovala závislost plochy píku na koncentraci warfarinu (R2 > 0,99). V případě tablet byl postup obdobný, ale před rozpouštěním byla vždy u každé tablety zjištěna a zaznamenána hmotnost, která byla následně využita pro výpočet obsahu warfarinu.
Stanovení fyzikálních vlastností směsí a tablet se provádělo dle příslušných článků ČL 2009. Ke stanovení sypné a setřesné hustoty směsí sloužila zařízení SVM 102 (ERWEKA GmbH, Německo) a ke stanovení sypnosti zařízení Medipo (ZT, Česká republika). Pevnost tablet se měřila na zařízení Tablet Hardness & Compresion Tester C50 (Engineering Systems, Velká Británie); oděr tablet na zařízení TAR 10 (ERWEKA GmbH, Německo). Rozpadavost se zkoušela na zařízení ZT 4 (ERWEKA GmbH, Německo). Výška tablet se měřila mechanickým posuvným měřítkem.
Výsledky a diskuze
Připravené šarže tabletových směsí a tablet se lišily celkovou dobou mísení (2–15 minut) a přísadou lubrikantu v různém stupni promísení, a to na počátku (technologie A, B, C) nebo po 10 minutách (technologie D, E). Na základě literárních údajů jsme předpokládali, že pokud použijeme plnivo s většími částicemi, zlepší se tokové vlastnosti tabletoviny, minimalizují elektrostatické síly, a tím pak může dojít i ke zlepšení obsahové stejnoměrnosti5). U připravovaných směsí jsme proto použili Di-cafos 92-14, kde 50 % částic bylo větších než 152,3 μm. Distribuce velikosti částic složek tabletoviny uvádí tabulka 1.
Vyhodnocení obsahové stejnoměrnosti u směsí a tablet
Tabulka 2 v přehledu uvádí výsledky obsahové stejnoměrnosti směsí a z nich vylisovaných tablet. Hodnoceny jsou vždy průměry z deseti vzorků a relativní směrodatná odchylka měření (RSD). Dále se uvádí, zda dané vzorky vyhověly požadavkům lékopisných článků a limitu FDA u směsí a Bergumovu rozdělení v případě tablet. Lékopisné limity a limity FDA pak posloužily k výpočtům pravděpodobnosti za použití Cpk indexu.
Z tabulky 2 je zjevné, že obsahová stejnoměrnost ručně odebraných vzorků tabletovin je obvykle horší než u výlisků. To odpovídá i zkušenostem s přípravou tablet metodou přímého lisování s nízkým obsahem účinné látky. Horší výsledky obsahové stejnoměrnosti směsi zde bývají přisuzovány chybě vzorkování, neboť se v praxi doposud nepodařilo zavést adekvátní techniku odběru vzorků. Z tohoto hlediska se použitou technikou vzorkování nepodařilo tuto chybu u všech šarží eliminovat. Můžeme však v souladu s literárními údaji předpokládat, že o skutečné homogenitě směsi svědčí nejlépe obsahová stejnoměrnost produktu7).
Tab. 2. Vyhodnocení parametrů obsahové stejnoměrnosti směsí a tablet 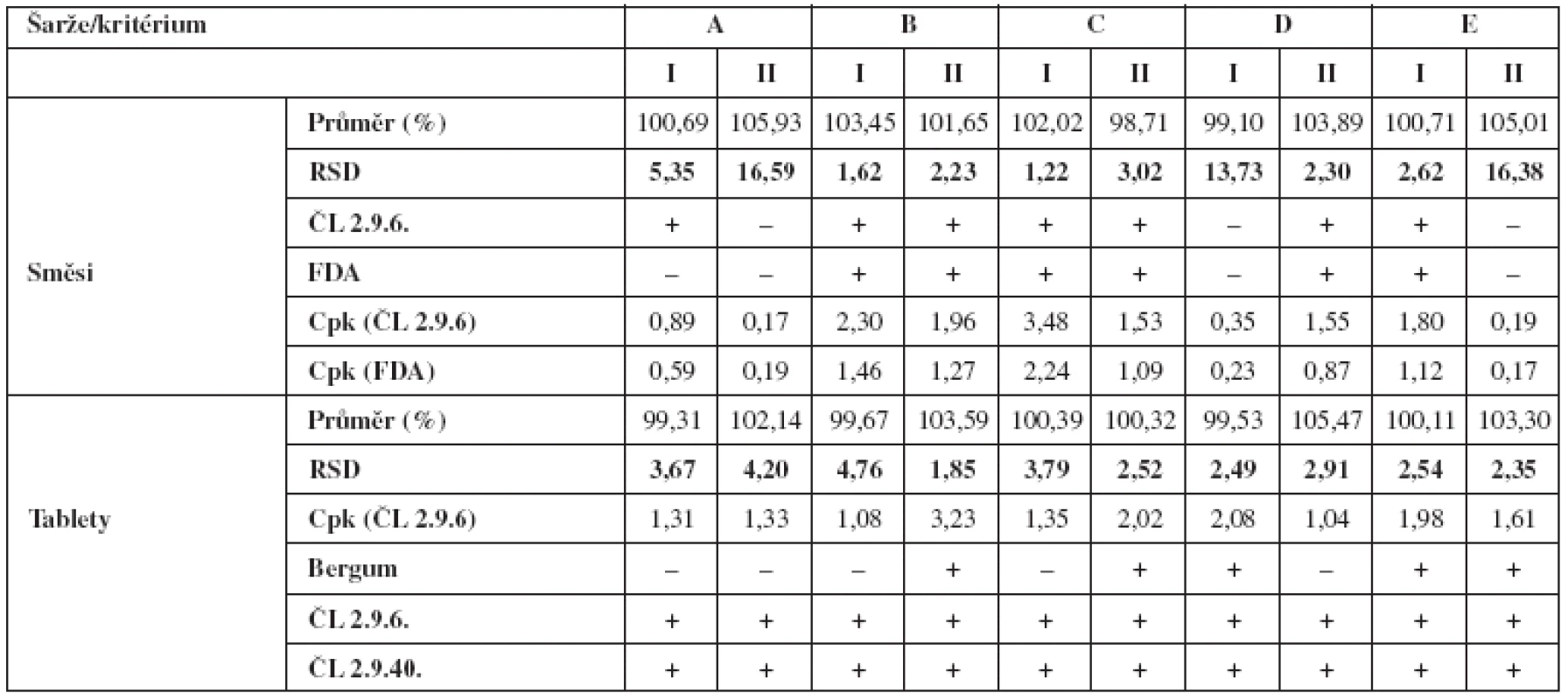
(+) vyhovuje, (–) nevyhovuje Dříve publikované výsledky hodnotí vliv přídavku kluzné látky v různém stupni mísení, kdy celková doba homogenizace je 15 minut (technologie C a E). Publikované hodnoty RSD tablet, vždy u dvou šarží, činily 2,13 % a 3,97 % (technologie C) a 3,03 % a 2,92 % (technologie E)2). Při porovnání těchto hodnot s hodnotami uvedenými v tabulce 3, můžeme vidět, že jsou prakticky identické. U technologie E došlo jen ke statisticky nevýznamnému zlepšení u obou šarží (F-test shody rozptylů; α = 0,05). Stejně jako u dříve publikovaných výsledků, i zde vyhověly obě šarže Bergumovu rozdělení pouze u technologie E.
Tab. 3. Vyhodnocení směsí 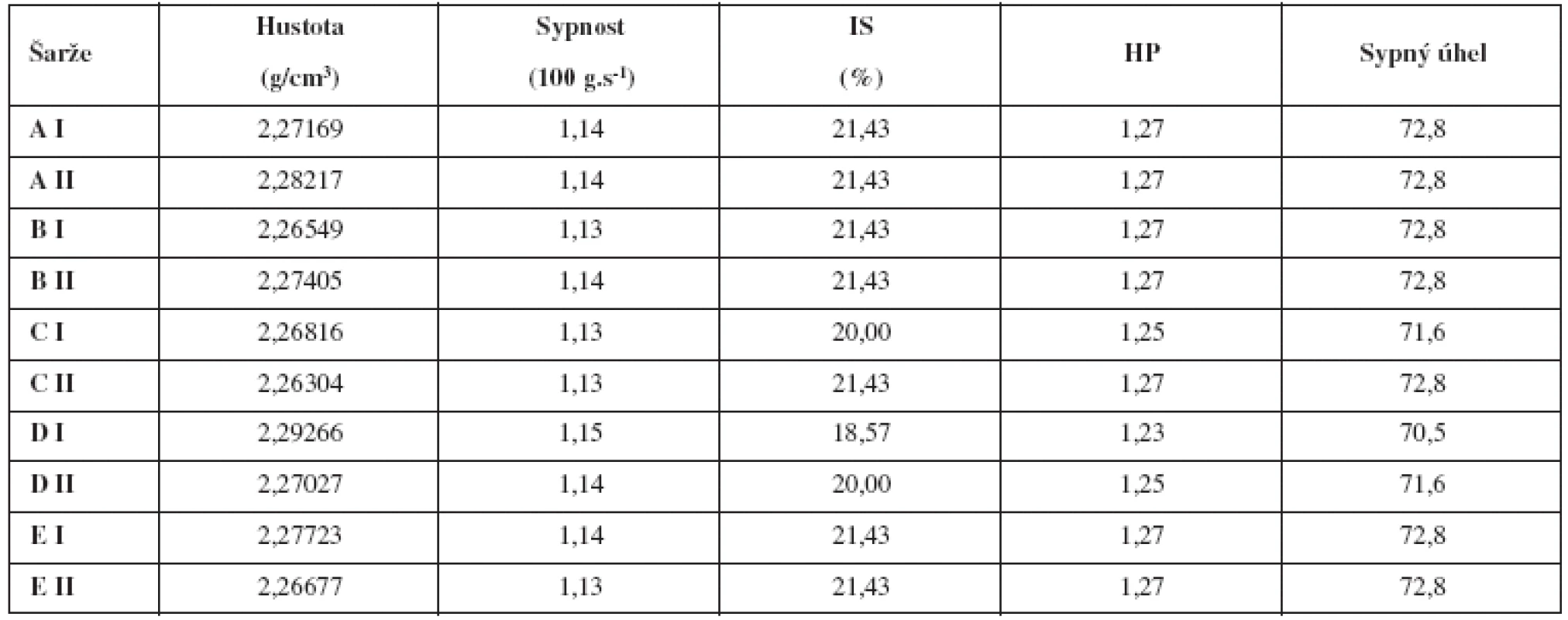
IS – index stlačitelnosti, HP – Hausnerův poměr Co se týká procesních podmínek, resp. času mísení a přísady kluzné látky v různém stupni homogenizace, pak samotné zkrácení času mísení nemá na obsahovou stejnoměrnost podstatný vliv. Pozitivního vlivu bylo dosaženo až pozdějším přídavkem stearanu hořečnatého ve spojení s delším časem domísení, čemuž odpovídá i splnění Bergumova kritéria u technologie E. Tuto skutečnost lze vysvětlit tím, že částice warfarinu se adsorbovaly na povrch částic plniva v nepřítomnosti stearanu hořečnatého, což je ve shodě s dříve publikovanými výsledky. Pokud je stearan hořečnatý přítomen od začátku mísení, zřejmě svými vlastnostmi naruší fyzikální vazbu mezi částicemi warfarinu a plniva. Pokud však k této adsorpci došlo, pozdější přísada stearanu hořečnatého již tuto skutečnost neovlivní.
Nicméně lékopisným parametrům vyhověly šarže připravené všemi pěti technologiemi, což bylo statisticky potvrzeno i Cpk indexy, které ve všech případech dosahovaly hodnoty větší než 1. Závěrem lze konstatovat pozitivní vliv přísady stearanu hořečnatého v průběhu procesu mísení spolu s delším časem homogenizace, což je ve shodě s dříve publikovanými výsledky, kde se použilo plnivo o zhruba poloviční velikosti částic.
Vyhodnocení fyzikálních vlastností směsí a tablet
Pro ověření robustnosti celého procesu přípravy se měřily i fyzikální vlastnosti směsí a tablet. Celková doba mísení a přísada kluzné látky v různém stupni nemají významný vliv na hustotu ani tokové vlastnosti hodnocených tabletovin. Lze jen konstatovat, že tokové vlastnosti jsou dle ČL 2009 průměrné, zatímco úhel sypnosti je velmi špatný (tab. 3). Všechny směsi je možné bez problémů ztabletovat.
Pokud se dané složení a technologie ověřují v praxi, je třeba definovat i rozmezí radiálních pevností tablet, ve kterých tablety splňují běžně požadovaná lékopisná kritéria. Na radiální pevnosti jsou přímo závislé výška, oděr a rozpadavost. Zkoušku disoluce jsme v tomto případě neprováděli. Z tabulky 4 je zřejmé, že tablety o průměrné radiální pevnosti v rozmezí 40–110 N, připravených jednotlivými technologiemi, spolehlivě vyhovují lékopisným požadavkům těchto zkoušek. Některé hodnoty oděru se při nejnižší radiální pevnosti již přibližují lékopisnému limitu 1 %, což naznačuje, že jde o vhodně stanovenou mez přijatelnosti. Z hodnot rozpadavosti, které se prakticky neliší pro obě krajní hodnoty radiální pevnosti, lze usuzovat, že uvolňování léčiva z tablety neovlivňuje pevnost ani zvolená technologie přípravy.
Tab. 4. Vyhodnocení tablet 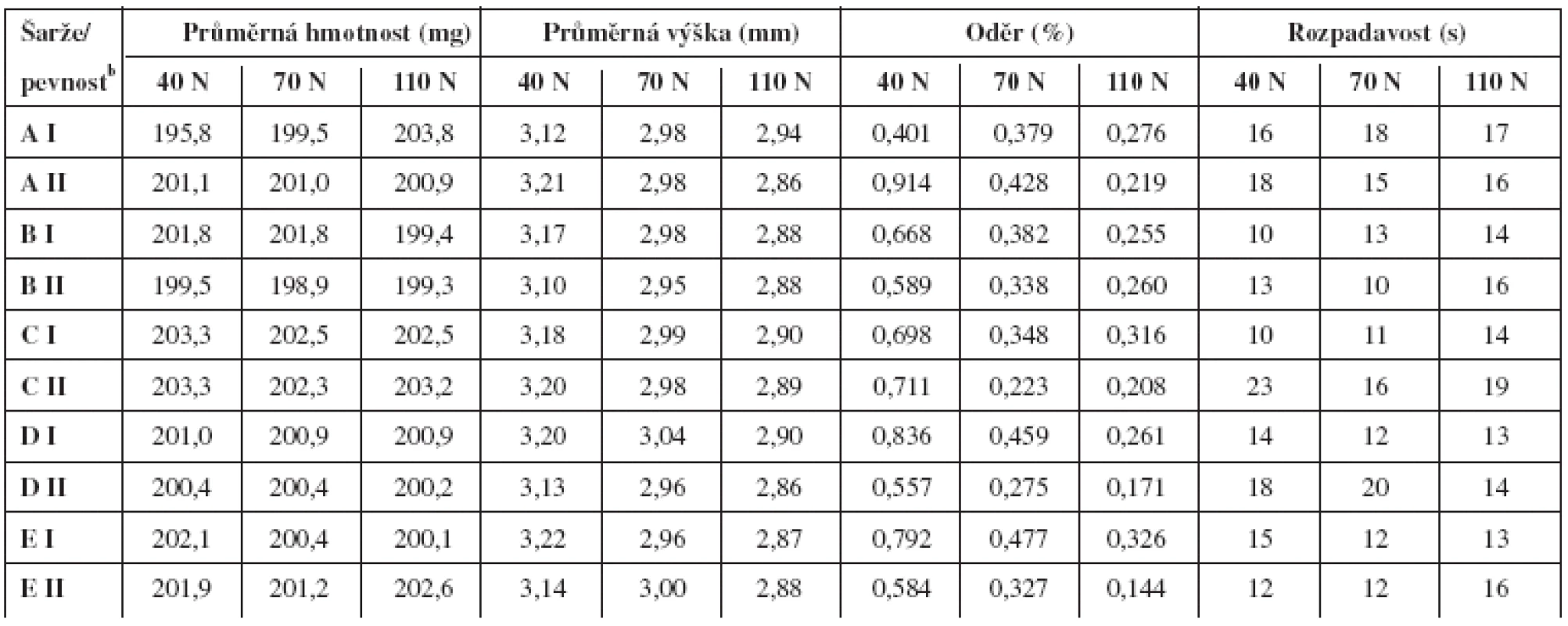
bPevnosti odpovídají cílovým teoretickým hodnotám, na které byly tablety lisovány. Závěr
Podařilo se nalézt vhodné složení a procesní podmínky homogenizace pro technologii přímého lisování tablet s nízkým obsahem warfarinu. Obsahová stejnoměrnost tablet vyhovuje přísnému Bergumovu rozdělení, které je akceptovatelné pro registrační autority v USA. Z nalezených výsledků plyne, že pozdější přísada stearanu hořečnatého spolu s delším časem mísením při přípravě suché směsi, má pozitivní vliv na obsahovou stejnoměrnost tablet. To je ve shodě s dříve publikovanými výsledky, kde bylo použito plnivo o jiné distribuci velikosti částic. Zároveň lze konstatovat, že obvykle vyšší hodnoty relativních směrodatných odchylek u směsí ve srovnání s produktem, jsou zřejmě způsobeny chybou vzorkování, což je v souladu s dosavadními publikovanými poznatky. Při dalším výzkumu by bylo vhodné použít jinou techniku vzorkování a ověřit, zda tato změna bude mít významný vliv na nalezené výsledky obsahové stejnoměrnosti směsi. Další možností může být použití léčiva s odlišnou distribucí velikosti částic, která by mohla chybu vzorkování, na základě odlišných fyzikálních vlastností směsi, významně snížit.
Střet zájmů: žádný.
Došlo 6. června 2013
Přijato 4. července 2013
Aleš Franc • Mgr. Jan Muselík, Ph.D. (∗) • Radka Máslová • Jana Hadrabová
Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků
Palackého tř. 1/3, 612 42 Brno
e-mail: muselikj@vfu.cz
Zdroje
1. Hirsh J., Dalen J. E., Anderson D. R., Poller R., Bussey H., Ansell J., Deykinn D. Oral anticoagulants: mechanism of action, clinical effectiveness, and optimal therapeutic range. CHEST 2011; 119, S8–21, http://journal.publications.chestnet.org.
2. Muselík J., Franc A. Hodnocení obsahové stejnoměrnosti tablet s nízkým obsahem léčivé látky s úzkým terapeutickým indexem. Čes. slov. Farm. 2012; 61, 271–275.
3. Blend uniformity analysis. Guidance for industy. CDER. August 1999, http://www.fda.gov.
4. Mohan P., Sharma N., Gupta M. K., Khinchi M. P., Agrawal D., Kabra M. P. A review on validation of solid dosages form. JSRP 2012; 1, 18–22.
5. Swarbrick J. Encyclopedia of pharmaceutical technology. Informa healthcare, 3th ed. New York, 2007, 1171 s.
6. Boehm G., Clark J., Dietrick J., Foust L., Garcia T., Gavini M., Geoffroy J. M., Jimenez P., Mergen G., Muzzio F., Planchard J., Prescott J., Timmermans J., Takiar N., Whiteman D. Results of statistical analysis of blend and dosage unit content uniformity data obtained from the Product Quality Research Institute Blend Uniformity Working Group data-mining effort. PDA J. Pharm. Sci. Tech. 2004; 58, 62–74.
7. Berman J., Elinski D. E., Gonzales C. R., Jimenez P. J., Planchard J. A., Tlachac R. J., Vogel P. F. Blend uniformity analysis: validation and in-process testing. PDA J. Pharm. Sci. Tech. 1997; 51, S1–99.
Štítky
Farmacie Farmakologie
Článek Nové knihy
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2013 Číslo 4- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
-
Všechny články tohoto čísla
- Vzácná onemocnění v Itálii: analýza nákladů a farmakoterapie
- Vývoj spoluúčasti pacienta na nákladech na farmakoterapii v letech 2008–2012
- Vplyv abiotickej elicitácie na produkciu sanguinarínu a aktivitu polyfenoloxidázy v suspenznej kultúre Eschscholtzia californica CHAM.
- Antioxidační aktivita extraktů a HPLC analýza flavonoidů Capsella bursa-pastoris (L.) Medik
- Obsahová stejnoměrnost směsí a tablet obsahujících warfarin
- Léky z barokní klášterní lékárny
-
XXXV. pracovní dny Radiofarmaceutické sekce
České společnosti nukleární medicíny ČLS JEP - Prof. RNDr. Ľudovít Krasnec – 100. výročie narodenia
- Prof. Ing. Jozef Lehotay, DrSc. – sedemdesiatnik
- Nové knihy
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léky z barokní klášterní lékárny
- Obsahová stejnoměrnost směsí a tablet obsahujících warfarin
- Antioxidační aktivita extraktů a HPLC analýza flavonoidů Capsella bursa-pastoris (L.) Medik
- Vplyv abiotickej elicitácie na produkciu sanguinarínu a aktivitu polyfenoloxidázy v suspenznej kultúre Eschscholtzia californica CHAM.
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Současné možnosti léčby obezity
nový kurzAutoři: MUDr. Martin Hrubý
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



