-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaŠtúdium disolučných profilov tramadoliumchloridu z liekových foriem s riadeným uvoľňovaním matricového a zásobníkového typu
A study of dissolution profiles of tramadol hydrochloride from the dosage forms with controlled release of the matrix and multiple unit types
The aim of the experimental paper was to evaluate the achieved retardation of prepared modified release formulations containing tramadol hydrochloride as an active ingredient by comparison of the dissolution profiles and to study the dissolution mechanism using mathematical models. The release of the active ingredient from the matrix tablet and multiple unit dosage form containing the coated microspheres was compared with the marketed once daily dosed modified release dosage forms of tramadol hydrochloride. The measured data were compared with the published pharmacokinetic data of available once daily formulations. Based on the evaluation of in vitro dissolution profiles, it can be assumed that the chosen formulations of matrix tablets using polyacrylate Eudragit NE 30 as a matrix-forming polymer and a pellet reservoir system containing the Kollicoat SR membrane allow to achieve the pharmacokinetic profile complying with the requirements for the dosage form of tramadol hydrochloride assuring a 24-hours prolonged effect of the active ingredient. The dissolution method employed is able to yield the results corresponding with the published data and predicting the differences in pharmacokinetic profiles described in the literature 4–6).
Key words:
tramadol hydrochloride – dissolution profile – dissolution mechanism – modified release
Autoři: V. Kormanová 1; B. Vladovičová 1; Ž. Bezáková 3; M. Vítková 2; J. Škodová 1; Š. Zoričák 1; V. Hubinová 1; M. Rabišková 4; K. Dvořáčková 4
Působiště autorů: Zentiva a. s., Hlohovec 1; Farmaceutická fakulta Univerzity Komenského v Bratislave, Katedra galenickej farmácie 2; Farmaceutická fakulta Univerzity Komenského v Bratislave, Katedra farmaceutickej chémie 3; Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků 4
Vyšlo v časopise: Čes. slov. Farm., 2010; 59, 210-218
Kategorie: Původní práce
Souhrn
Cieľom našej experimentálnej práce bolo vyhodnotenie retardácie pripravených formulácií tramadoliumchloridu s modifikovaným uvoľňovaním porovnaním disolučného profilu a posúdením mechanizmu uvoľňovania účinnej látky s využitím matematických modelov. Liberácia liečiva z matricovej retardety a z násobnej liekovej formy tvorenej peletami obalenými membránou polyméru sa porovnala s dostupnými prípravkami tramadoliumchloridu s predpísaným dávkovaním jedenkrát denne. Získané údaje sa interpretovali ohľadom na publikované údaje o priebehu farmakokinetického profilu dostupných OD foriem tramadoliumchloridu. Na základe vyhodnotenia výsledkov získaných in vitro môžeme konštatovať, že vybrané experimentálne matricové tablety na báze polyakrylátového Eudragitu NE 30D ako matricotvorného polyméru a násobná lieková forma tvorená peletami s membránou Kollicoatu SR, majú predpoklad dosiahnuť farmakokinetický profil, ktorý splní požiadavky na liekovú formu tramadoliumchloridu s predĺženým uvoľňovaním zabezpečujúcim dvadsaťštyrihodinový účinok liečiva. Použitá disolučná metóda poskytla výsledky, ktoré majú výpovednú hodnotu zodpovedajúcu publikovaným údajom: disolučná metóda predikuje rozdiely vo farmakokinetických profiloch popísané v citovanej literatúre 4–6).
Kľúčové slová:
tramadoliumchlorid – disolučný profil – mechanizmus disolúcie – predĺžené uvoľňovanieÚvod
Tramadol, ktorý syntetizovali Flick a Frankus v laboratóriách Grünenthal v roku 1965 ako nenávykové analgetikum, bol zavedený do terapie v druhej polovici sedemdesiatych rokov 1). Tramadol sa používa ako analgetikum pri akútnej, hlavne pooperačnej bolesti, ale aj pri silnej a stredne silnej chronickej bolesti 2). Na trhu sú dostupné rôzne liekové formy tramadoliumchloridu: tablety, kapsuly, kvapky, čapíky, injekcie. Niektoré z uvedených liekových foriem, tablety a kapsuly obsahujúce dávku 100–400 mg liečiva, sa podávajú pacientovi raz denne. Lieková forma dávkovaná jedenkrát denne („once daily“ – OD) má za úlohu zabezpečiť rýchly nástup účinku pri dostatočnej plazmatickej koncentrácii látky a následne pretrvávajúci dvadsaťštyrihodinový efekt tejto molekuly s relatívne krátkym plazmatickým polčasom – perorálne podané formy s okamžitým uvoľňovaním dosahujú maximum plazmatickej koncentrácie cmax 2 hodiny po podaní a polčas rozpadu je 5–6 hodín 3).
Porovnaním farmakokinetických profilov OD formulácie Tramadol LP-200 mg, SMB technology, Marche-en-Famenne, Belgicko s bežne uvoľňujúcimi kapsulami Topalgic® 50 mg Grünenthal, Aachen, Nemecko sa zaoberá práca autorov Malonne et al. 4). V štúdii za podmienok opakovaného podania mala postupne uvoľňujúca forma signifikantne dlhší Tmax a udržala plazmatické koncentrácie počas 24 hodín nad hodnotou 100 ng/ml, ktorá je podľa výsledkov autorov Lintz et al. 3) klinicky účinná v terapii bolesti. Relatívne krátky plazmatický polčas vyžadujúci časté dávkovanie robí z tramadoliumchloridu vhodného kandidáta na podávanie vo forme prípravku s riadeným/predĺženým uvoľňovaním.
Hernandez-Lopez et al.vo svojej práci 5) porovnávajú biologickú dostupnosť dvoch rôznych raz denne podávaných perorálnych formulácií s obsahom 200 mg tramadoliumchloridu: Contramid® o.d. tablety Labopharm, Kanada a Zytram® tablety, Zambon Španielsko po jednorazovom podaní. Contramid® využíva technológiu založenú na chemickom zosieťovaní molekúl predželatinovaného škrobu a vytvorení matrice, ktorá viaže účinnú látku vo svojej štruktúre. Po vytvorení gélu v prostredí gastrointestinálneho traktu liečivo difunduje z matrice konštantnou rýchlosťou a umožní kontinuálny analgetický účinok počas 24 hodín. Upravená vonkajšia vrstva tablety s obsahom časti liečiva je prispôsobená pre okamžité uvoľnenie iniciálnej dávky a rýchle dosiahnutie terapeutickej hladiny. Vo farmakokinetickej štúdii pre Contramid® o.d. boli nájdené signifikantne vyššie hodnoty pre všetky farmakokinetické parametre, okrem polčasu plazmatickej koncentrácie T1/2. V krivke plazmatickej koncentrácie tramadolu je pozorované plato nad 200 ng/ml v trvaní viac ako 12 hodín. Takáto hladina koncentrácie trvá u Zytramu iba 2 hodiny. Autori práce porovnali dosiahnuté výsledky s publikovanými farmakokinetickými profilmi 4) Tramium® vyvinutého v SMB Laboratories, Belgicko. Kým Contramid® a Zytram® vykazujú rýchly nástup absorpcie nasledovaný pomalým postupným uvoľňovaním, u Tramia vidieť na začiatku krivky asi dvojhodinové oneskorenie, maximálna koncentrácia je dosiahnutá až po 10 hodinách a po jej dosiahnutí nasleduje rýchly eliminačný proces.
Pozorované farmakokinetické rozdiely rôznych liekových foriem s predĺženým uvoľňovaním resp. OD foriem môžu viesť k rozdielom vo farmakodynamických parametroch. Podobné rozdiely medzi raz denne podávanými formuláciami tramadoliumchloridu zistili aj Traynor et al. 6). Vo svojej práci prezentujú in vitro disolučné profily troch rôznych OD formulácií tramadoliumchloridu: Ultram® tablety Ortho Mc-Neil, USA (liečivo obsiahnuté v jadre, uvoľňovanie kontroluje film tvorený kombináciou vodorozpustného a nerozpustného polyméru), Tridural tablety Labopharm, Kanada (zhodný s už zmieneným Contramidom®, rozdielny obchodný názov pre rôzne teritóriá) a T-long® kapsuly (zhodný s už zmieneným Tramium®, rozdielny obchodný názov pre rôzne teritóriá). In vitro disolučné profily vo fosforečnanovom tlmivom roztoku pH 6,8 ukazujú signifikantné rozdiely v uvoľňovaní liečiva. Významný vplyv na farmakokinetický profil sa dá očakávať aj z dôvodu použitia rozdielnych pevných liekových foriem, a to tabliet a kapsúl, resp. peliet. Tieto liekové formy sa považujú za ekvivalentné a u mnohých prípravkov s okamžitým ale aj predĺženým uvoľňovaním bola doložená bioekvivalencia. V prostredí in vitro sa však dajú predpokladať rozdiely. Pre liekovú formu tramadoliumchloridu s predĺženým uvoľňovaním Cnota et al. 7) pozorovali, že hoci Tramadol SR kapsuly a Tramadol SR tablety dosahujú rovnakú systémovú expozíciu liečiva, kapsuly dosiahli dlhšie trvajúci a vyrovnanejší plazmatický profil, čo sa prejavilo neskorším Tmax a nižším cmax. Naviac v prípade kapsúl sa zistila nižšia variabilita v rýchlosti aj rozsahu absorpcie po opakovanom podaní po jedle.
V súčasnosti je na trhu dostupné veľké množstvo rôznych typov polymérov, ktoré rôznym mechanizmom modifikujú uvoľňovanie liečiva. Uvoľňovanie liečiva z retardety prebieha na základe difúzie, rozpúšťania, výmeny iónov, osmózy, prípadne kombinovaným mechanizmom 8).
Na interpretáciu in vitro disolučných dát sa používajú rôzne matematické modely (kinetika nultého poriadku, kinetika prvého poriadku, Higuchi model, Hixson-Crowell a Korsmeyer - Peppas model), účelom ktorých je zistenie kinetiky a mechanizmu uvoľňovania liečiva z liekovej formy. Matematický popis vnútorných procesov prebiehajúcich pri uvoľňovaní je zložitý, do úvahy treba brať mnohé fyzikálne parametre: postupne/súbežne prebiehajú difúzia vody do matrice, napúčanie matrice, difúzia liečiva zo systému, rozpúšťanie polyméru, axiálny a radiálny transport v trojrozmernom priestore, zmena rozmerov matrice, porozity a pod. Každý model je odvodený za určitých predpokladov, preto je obmedzený na určitý druh systémov. V našej práci sme využili Higuchiho model, Hixson-Crowellov model a Korsmeyer-Peppasov model. Higuchi 9) popísal uvoľňovanie z nerozpustnej matrice ako závislosť uvoľneného množstva liečiva od druhej odmocniny času prebiehajúce podľa Fickovej difúzie:
Q = K t1/2, [1]
kde Q = uvoľnené množstvo liečiva v čase t, K = konštanta zahrňujúca variabilitu systému.
Tento model sa používa pre uvoľňovanie dobre rozpustného liečiva z polotuhej alebo tuhej matrice.
Hixson a Crowell 10) popísali uvoľňovanie zo systému, v ktorom dochádza k zmene povrchu a veľkosti častí tabliet rovnicou:
Q1/3 – Qt1/3 = KHC t, [2]
kde Qt = množstvo uvoľnenej látky v čase t, Q = počiatočné množstvo účinnej látky v tablete, KHC = rýchlostná konštanta Hixson-Crowellovej rovnice.
V tomto prípade sa predpokladá, že rýchlosť uvoľňovania je riadená veľkosťou častíc liekovej formy, nie difúziou cez polymérnu matricu.
Korsmeyer a Peppas 11, 12) odvodili jednoduchý vzťah, ktorý popisuje uvoľňovanie z polymérneho systému:
Mt / Mį = K tn, [3]
kde Mt /Mį = podiel uvoľneného množstva v čase t, K = konštanta charakterizujúca liekovú formu, n = exponent uvoľňovania.
Tento model sa používa v prípade polymérnych liekových foriem, u ktorých mechanizmus nie je celkom objasnený, prípadne sa na ňom podieľa viac javov. Vyhodnocujú sa výsledky do 60 % uvoľneného množstva liečiva.
Hodnota exponentu uvoľňovania n charakterizuje rôzne mechanizmy uvoľňovania z matríc cylindrického tvaru. Tabuľka 1 uvádza typy mechanizmu v závislosti od hodnoty exponentu n.
Tab. 1. Typy mechanizmu uvoľňovania liečiva z polymérneho systému zodpovedajúce nájdenej hodnote exponentu n podľa Korsmeyer-Peppasovho modelu 
V našej práci sme sa zamerali na vyhodnotenie možnosti dosiahnutia retardácie pripravených formulácií tramadoliumchloridu s modifikovaným uvoľňovaním s využitím rôznych retardačných excipientov a liekových foriem, resp. technologických prístupov. Liberáciu liečiva jednak z matricovej retardety, ktorá predstavuje najjednoduchší spôsob retardácie, ako aj z násobnej liekovej formy tvorenej peletami obalenými membránou polyméru, sme porovnali s dostupnými prípravkami tramadoliumchloridu s predpísaným dávkovaním jedenkrát denne. Experimentálne získané údaje sme interpretovali s použitím vybraných modelov – Higuchiho, Korsmeyer-Peppasovho a Hixson-Crowellovho. Možnosť dosiahnutia požadovanej dvadsaťštyrihodinovej retardácie liečiva navrhnutých formulácii sme posúdili vzhľadom na zistené i publikované výsledky liekov používaných v terapii.
POKUSNÁ ČASŤ
Materiál
Pre vykonanie analytických testov sme použili tramadoliumchlorid, referenčný štandard (Zentiva) a komerčne dostupné chemikálie dihydrogénfosforečnan draselný p.a (Mikrochem) a hydroxid sodný p.a (Mikrochem). Pre prípravu roztokov sa použila čistená voda R, Európsky liekopis Ph.Eur. 13a).
Príprava fosforečnanového tlmivého roztoku pH 6,8:
250 ml 0,2 mol/l roztoku dihydrogénfosforečnanu draselného sa vleje do 1000 ml odmernej banky a pridá sa 112 ml 0,2 mol/l hydroxidu sodného, doplní sa vodou po značku.
Pri príprave vzoriek sa použili pomocné farmaceutické látky Eudragit® NE 30 D (Evonik Industries), Kollicoat® SR 30 D (BASF), Methocel™ K 100 MCR (DOW Chemical), mikrokryštalická celulóza typ Avicel® PH 105 (FMC Biopolymers), dibutylsebakát (Verbellus), mastenec (Luzenac val Chinose) a liečivo tramadoliumchlorid (Zentiva) v kvalite zodpovedajúcej platnej monografii Ph.Eur. 13b).
Charakteristika vybraných prípravkov dostupných na trhu
Analyzované prípravky s obsahom tramadoliumchloridu sú uvedené v tabuľke 2.
Tab. 2. Prípravky tramadoliumchloridu s riadeným uvoľňovaním a dávkovaním jedenkrát denne dostupné na trhu 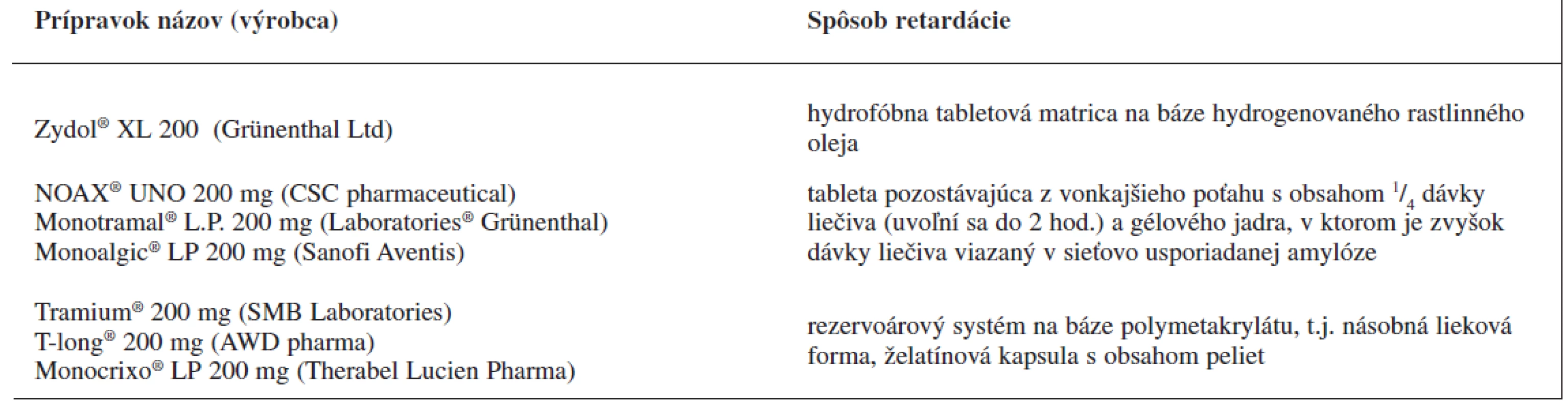
Charakteristika študovaných formulácií
Pre prípravu hydrofilnej matricovej retardety sa ako funkčný polymér použil Methocel™ K 100 v množstve 50 % w/w, tableta sa pripravila priamym lisovaním.
Ako matricotvorné polyméry sa použili hydrofóbne polyméry Eudragit® NE 30 D a Kollidon® SR v množstve 25 % w/w. Hydrofóbne matricové tablety sa pripravili jednak vlhkou granuláciou v prípade použitia Eudragitu NE 30 D a jednak priamym tabletovaním v prípade použitia Kollidonu SR ako funkčného polyméru. Pripravené matricové tablety sa následne obalili filmom Kollicoatu SR 30 D v množstve 30 μg/mm2. Násobnú liekovú formu tvorili pelety obsahujúce liečivo, ktoré sa pripravili metódou extrúzie a sferonizácie. Pelety sa obalili membránou Kollicoatu SR 30 D v množstve 13 % w/w fluidnou technikou so spodným nástrekom.
Študované formulácie sú uvedené v tabuľke 3.
Tab. 3. Študované formulácie tramadoliumchloridu s riadeným uvoľňovaním 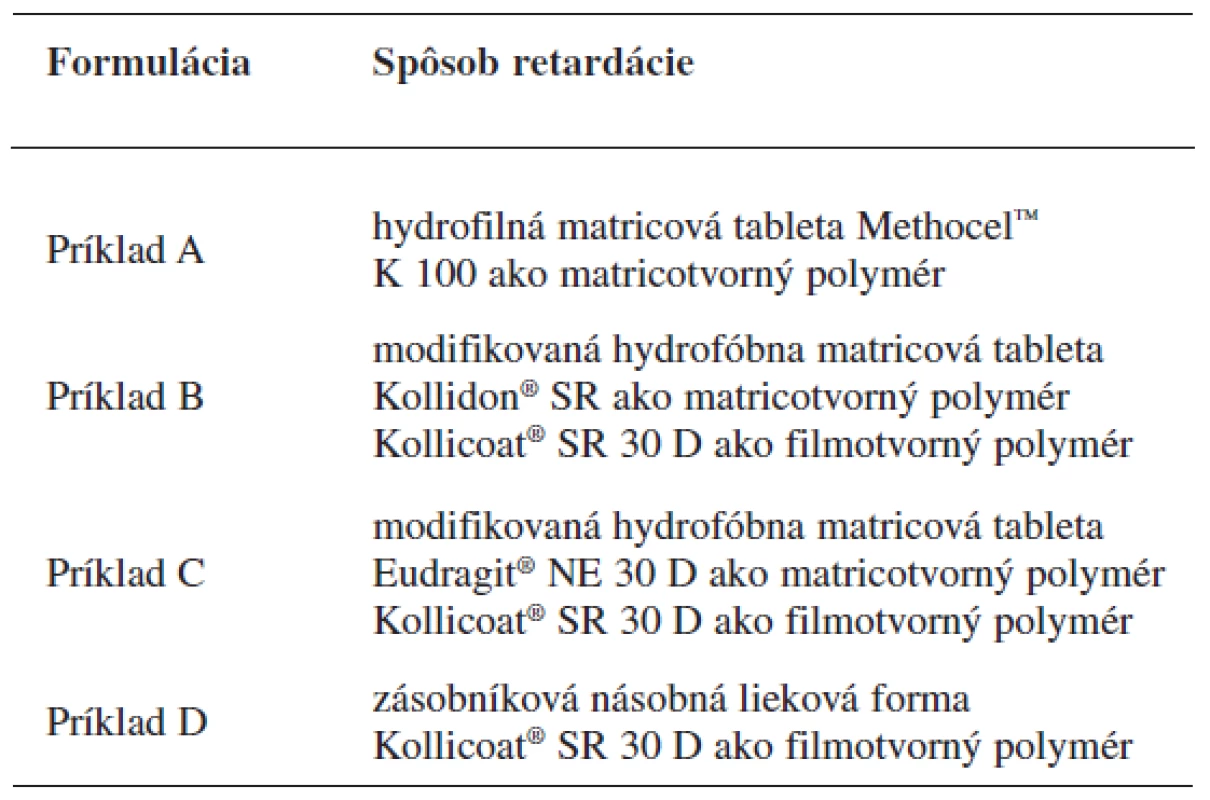
Disolučný test
Ako disolučné prostredie sa zvolil tlmivý fosforečnanový roztok pH 6,8, nakoľko toto pH vhodne reprezentuje hodnoty intestinálneho pH. Použilo sa disolučné zariadenie Vankel VK 7025 firmy Varian, podľa Ph.Eur. 13c), Aparatúra 1 (košíková aparatúra), rotačná rýchlosť 150 otáčok za minútu, doba uvoľňovania liečiva max. 24 hodín. V zvolených časových intervaloch sa UV spektrofotometrom Cary 50 firmy Varian stanovilo uvoľnené množstvo tramadoliumchloridu spektrofotometricky, pri vlnovej dĺžke 270 ± 2 nm. Uvoľnené množstvo liečiva sa vypočítalo vzhľadom na deklarovaný obsah liečiva vo vzorke.
Výsledky merania uvoľneného množstva liečiva nad 100 % v záverečných odberových intervaloch naznačili možnú interferenciu placeba u niektorých zo sledovaných formulácií v prípade použitia spektrofotometrie, preto sme preverili stanovenie uvoľneného množstva tramadoliumchloridu metódou HPLC s použitím kolóny s náplňou C8, 250 × 4,6 mm, veľkosť častíc 5 μm, LiChrosorb RP-Select B, mobilnej fázy acetonitril – roztok kyseliny trifluóroctovej (295 : 705) obj., s UV detekciou pri vlnovej dĺžke 270 ± 2 nm, prietoku 1,0 ml/min a nástreku 20 μl. Pozorovaný rozdiel vo výsledkoch nebol väčší ako 5 %, preto bola pre vyhodnotenie výsledkov použitá zmienená spektrofotometrická metóda.
Výsledky a diskusia
Disolučné profily prípravkov dostupných na trhu sme stanovili pri zvolených podmienkach (obr. 1) a dosiahnuté in vitro profily sme posudzovali a porovnávali s publikovanými údajmi o farmakokinetických a disolučných profiloch. Výsledky Zydolu XL 200, ako aj druhej skupiny študovaných prípravkov, ktorú reprezentuje NOAX® UNO, naznačujú uvoľnenie iniciálnej dávky, ktorému v in vivo farmakokinetických profiloch bude pravdepodobne zodpovedať rýchly nástup absorpcie a dosiahnutie potrebnej hladiny liečiva v plazme. Úvodná rýchla disolúcia je pri týchto prípravkoch nasledovaná pomalším postupným uvoľňovaním liečiva. V skupine reprezentovanej Tramiom vidieť na začiatku disolučnej krivky zjavné oneskorenie, v nasledujúcich hodinách však rýchlosť disolúcie narastá a predpokladáme, že takýto rýchly postup uvoľňovania môže indikovať dosiahnutie maximálnej koncentrácie cmax v plazmatickej krivke.
Obr. 1. Disolučné profily na trhu dostupných liekových foriem tramadoliumchloridu s dávkovaním jedenkrát denne 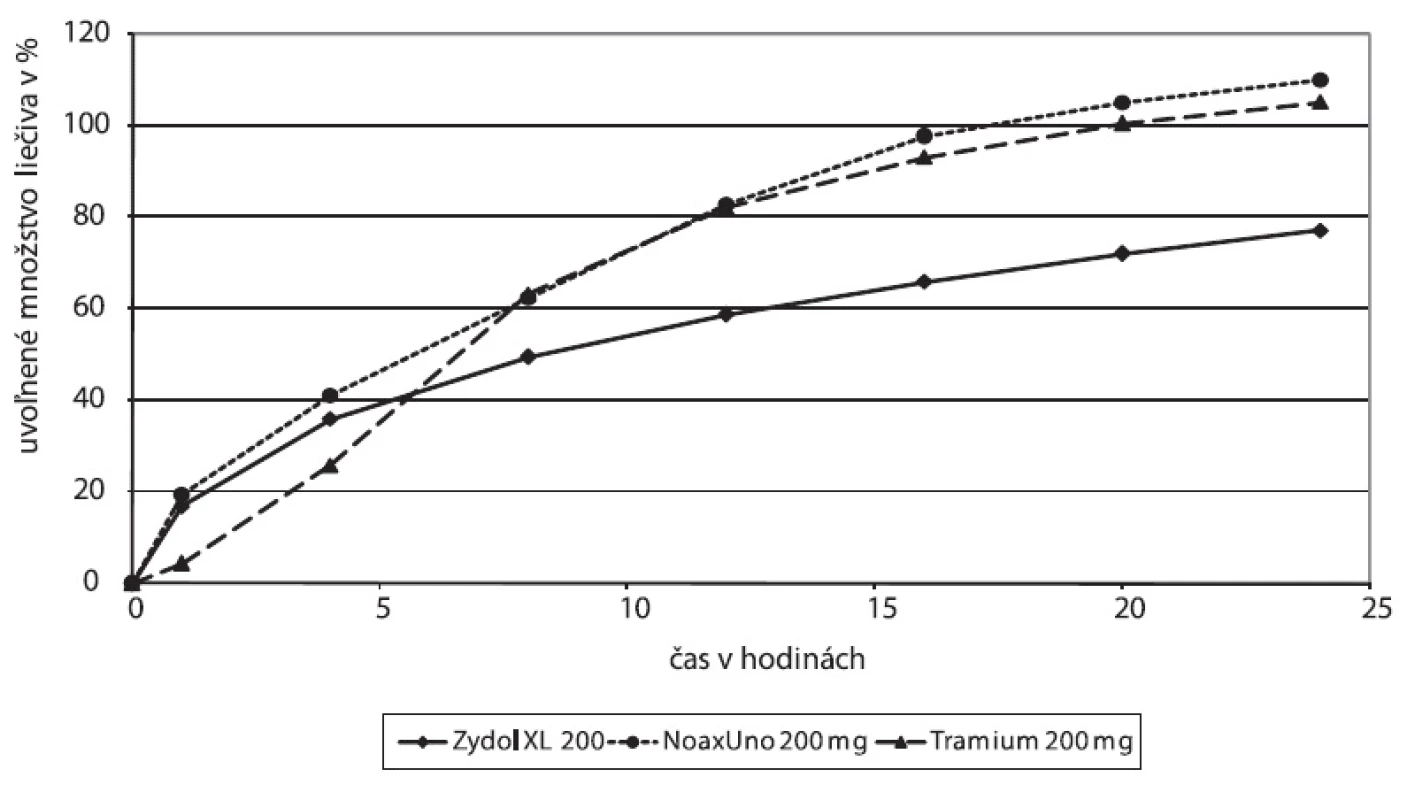
Disolučné profily experimentálne sledovaných formulácií sú znázornené na obrázku 2. V prípade dobre rozpustného liečiva, akým je tramadoliumchlorid, použitím hydrofilného matricotvorného polyméru (Príklad A) došlo ku kompletnému uvoľneniu liečiva už za 8 hodín. Methocel™ K 100 vytvára hydrofilnú gélovú matricu, polymér v biologickom prostredí hydratuje, napučiava, gelovatie, po čase je matrica napučaným útvarom, difúzna vrstva sa zväčšuje a jej prekonávanie rozpusteným liečivom sa prejavuje predĺžením liberácie.
Obr. 2. Disolučné profily experimentálne sledovaných liekových foriem tramadoliumchloridu s predĺženým uvoľňovaním 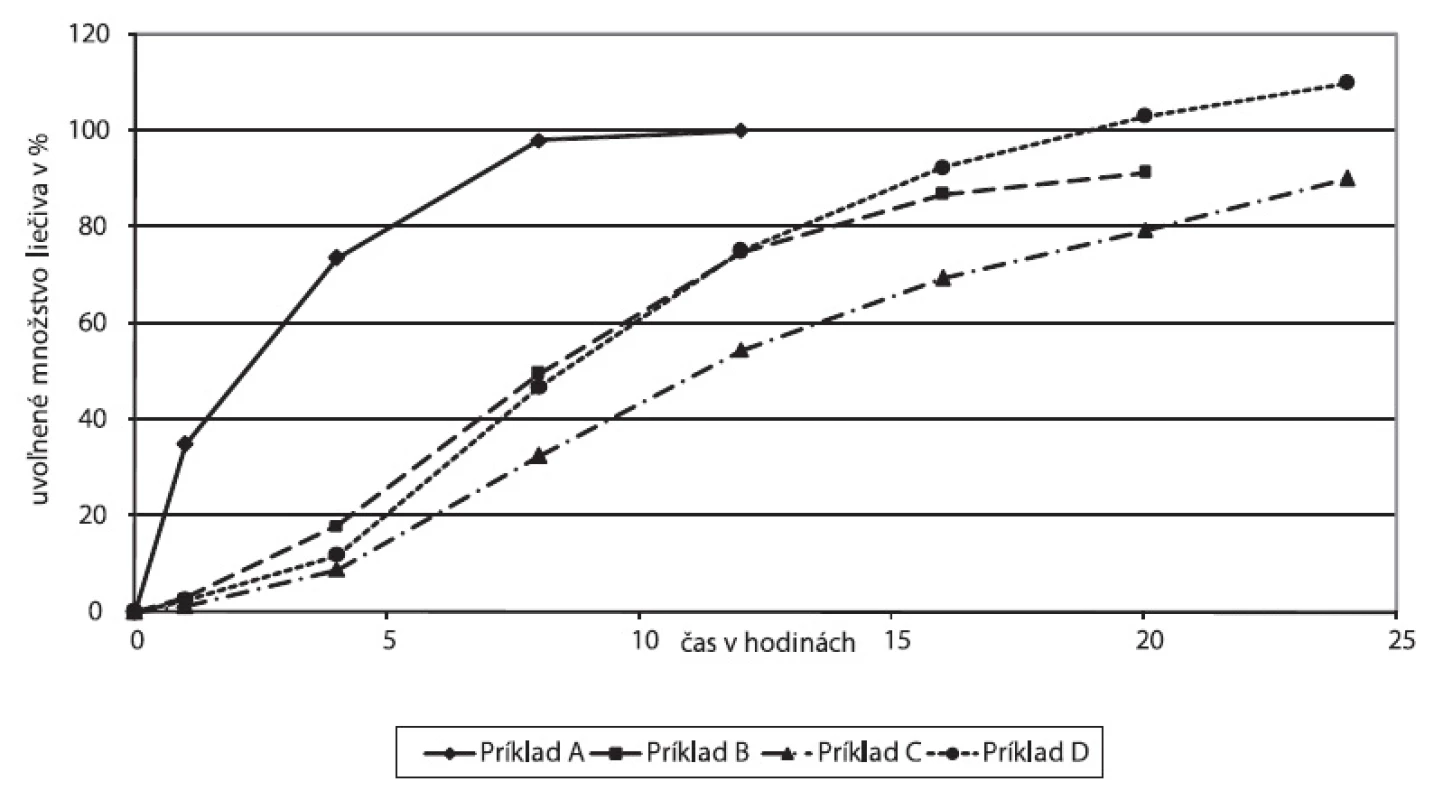
Z hydrofóbnych nerozpustných polymérov Kollidonu SR (Príklad B) a Eudragitu NE (Príklad C) po zlisovaní vzniká pevná skeletová štruktúta, z ktorej sa rozpustené liečivo uvoľňuje postupne kanálikmi v závislosti od pórovitosti matrice. Spomalenie liberácie potencuje filmový obal matrice tvorený nerozpustným polymérom Kollicoatom SR. V oboch prípadoch došlo k predĺženiu uvoľňovania liečiva po dobu 24 hodín.
Za liberáciu liečiva zo zásobníkovej retardety tvorenej mikročasticami je zodpovedný polymérny obal tvorený Kollicoatom SR, ktorý má riadiacu funkciu, reguluje uvoľňovanie liečiva do biofázy. Kollicoat® SR je vo vode nerozpustný, uvoľňovanie liečiva prebieha prevažne difúziou, a to v závislosti od hrúbky filmu, rozpustnosti a prítomnosti pomocných látok, ktoré tvoria vo filme kanáliky. V prítomnosti disolučného média vo filme obsiahnutý povidon zvyšuje zmáčavosť a penetráciu vody, jeho rozpustnením vznikajú póry a zvyšuje sa permeabilita filmu pre difúziu liečiva.
Vyhodnotenie mechanizmu uvoľňovania liečiva z liekovej formy matematickými modelmi
Porovnali sa disolučné profily matricovej tablety lieku Zydol XL 200 a vybranej experimentálnej matrice, Príklad A, hydrofilná matricová tableta s obsahom polyméu Methocel™ K 100 (obr. 3).
Obr. 3. Disolučné profily liekovej formy Zydol XL 200 a experimentálne skúšanej liekovej formy, Príklad A – hydrofilná matricová tableta s Methocelom K 100 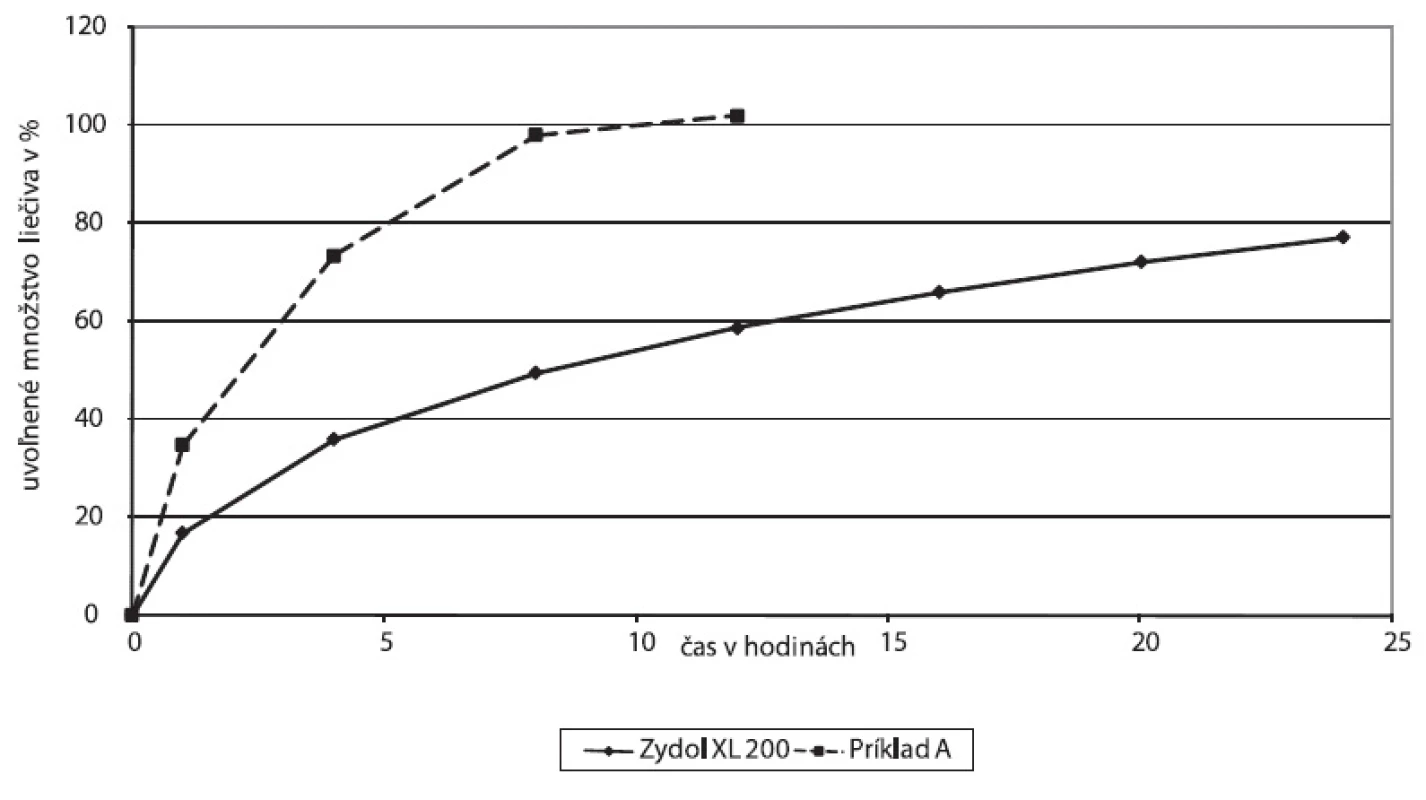
Štúdium mechanizmu uvoľňovania liečiva z matricovej tablety prípravku Zydol XL 200 za použitia matematických modelov indikuje difúzny mechanizmus uvoľňovania.
Korelačný koeficient Higuchiho závislosti 0,9932, ako aj hodnota exponentu n v Korsmeyer-Peppasovom modeli blízka 0,45 (n = 0,4699) potvrdzujú, že liečivo sa uvoľňuje z tablety difúziou podľa Fickovho zákona. Vizuálne pozorovanie tabliet po 24 hodinách disolúcie potvrdzuje absenciu signifikantnej erózie, tablety z pohľadu veľkosti, tvaru a povrchu, pri pozorovaní voľným okom boli nezmenené. Obrázok 4 vyjadruje parametre Higuchiho modelu, obrázok 5 závislosť podľa Korsmeyer-Peppasovho modelu pre prípravok Zydol XL 200.
Obr. 4. Zydol XL 200, parametre Higuchiho modelu spracované z disolučných údajov in vitro 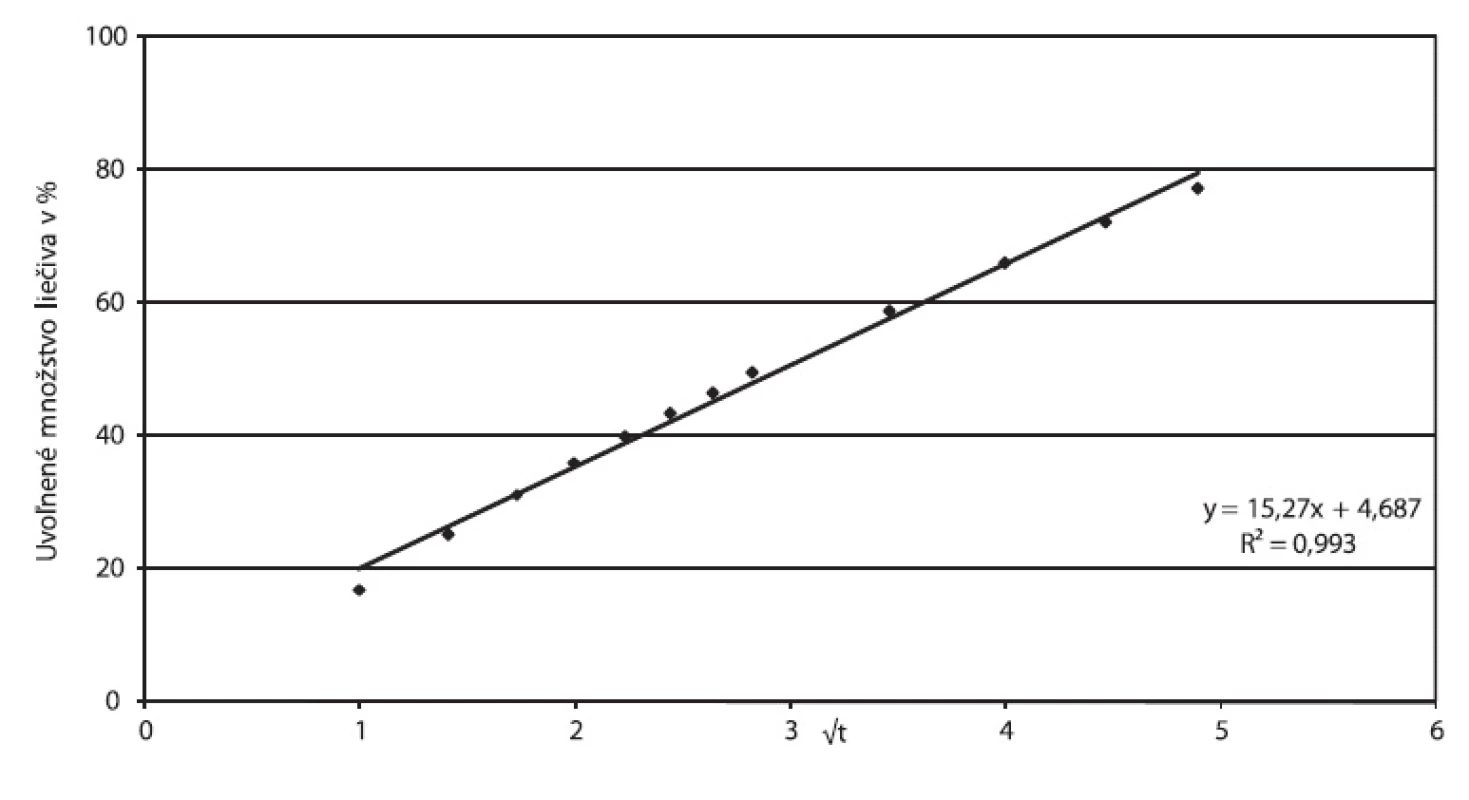
Obr. 5. Zydol XL 200, parametre Korsmeyer-Peppasovho modelu spracované z disolučných údajov in vitro 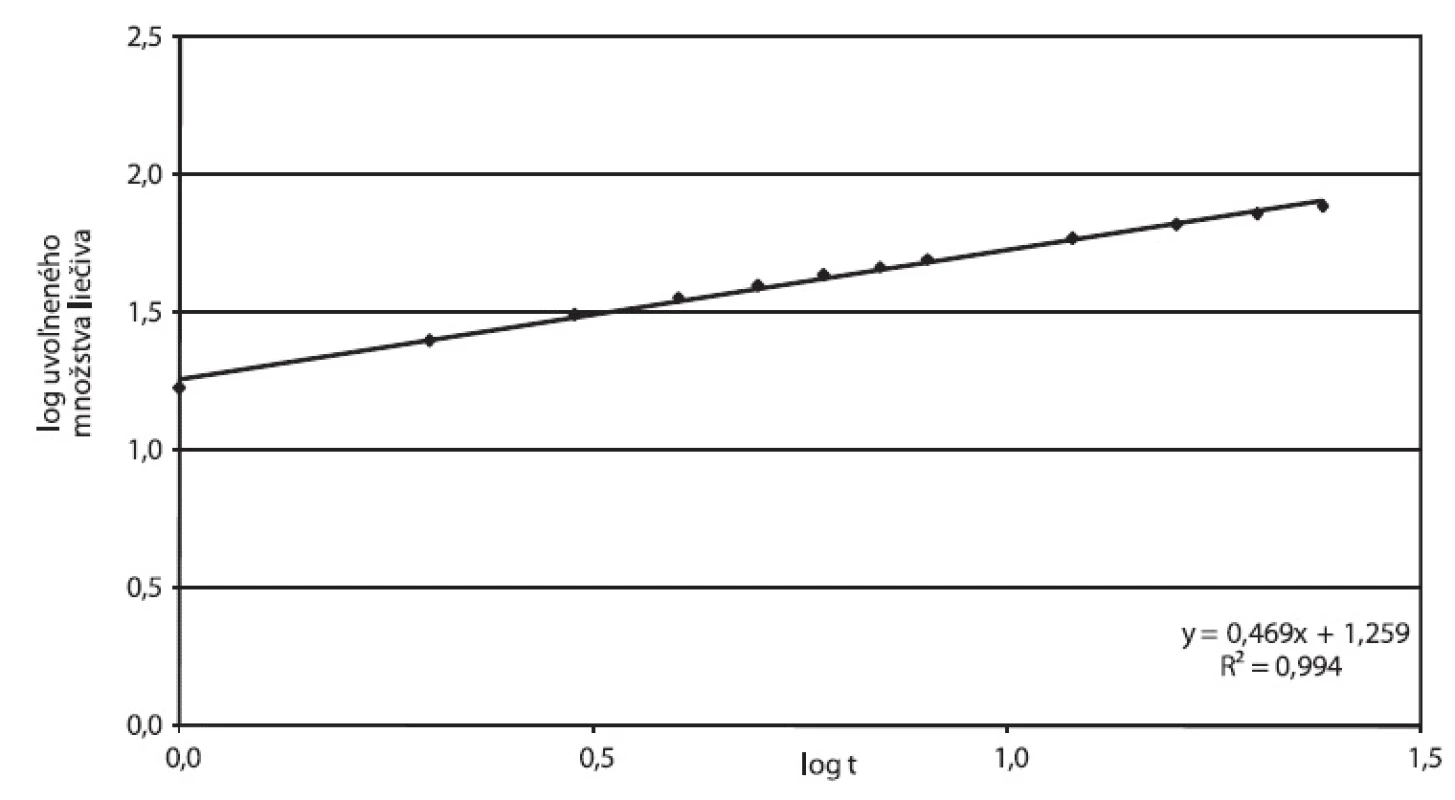
Štúdium mechanizmu uvoľňovania liečiva z matricovej tablety obsahujúcej hydrofilný matricotvorný polymér (Príklad A) za použitia matematických modelov indikuje tiež difúzny mechanizmus uvoľňovania: korelačný koeficient Higuchiho závislosti je 0,9944. Hodnota exponentu n v Korsmeyer-Peppasovom modeli vyššia ako 0,45 (n = 0,5463) naznačuje, že okrem difúzie sa podieľa pri uvoľňovaní aj erózia, mení sa veľkosť a povrch tablety. Túto interpretáciu podporuje aj dosiahnutá korelácia s Hixson-Crowellovým modelom (korelačný koeficient 0,9983). Obrázok 6 prezentuje parametre Higuchiho modelu, obrázok 7 závislosť podľa Korsmeyer-Peppasovho modelu. Zloženie zodpovedajúce Príkladu A nepredstavuje pre tramadoliumchlorid perspektívnu cestu dosiahnutia 24‑hodinovej retardácie. Podobný záver formulovali vo svojej práci Tiwari et al. 14), ktorí porovnávali efektívnosť riadenia uvoľňovania tramadoliumchloridu dosiahnutú v prípade použitia hydrofilnej matrice (hydroxypropylmetylcelulóza HPMC) a hydrofóbnej matrice (hydrogenovaný gáfrový olej, resp. etylcelulóza): Pre dobre rozpustné liečivo je podľa autorov vhodnejším systémom hydrofóbny systém, ktorý dosiahne dvadsaťhodinovú retardáciu, kým hydrofilný maximálne dvanásťhodinovú.
Obr. 6. Príklad A, parametre Higuchiho modelu spracované z disolučných údajov in vitro 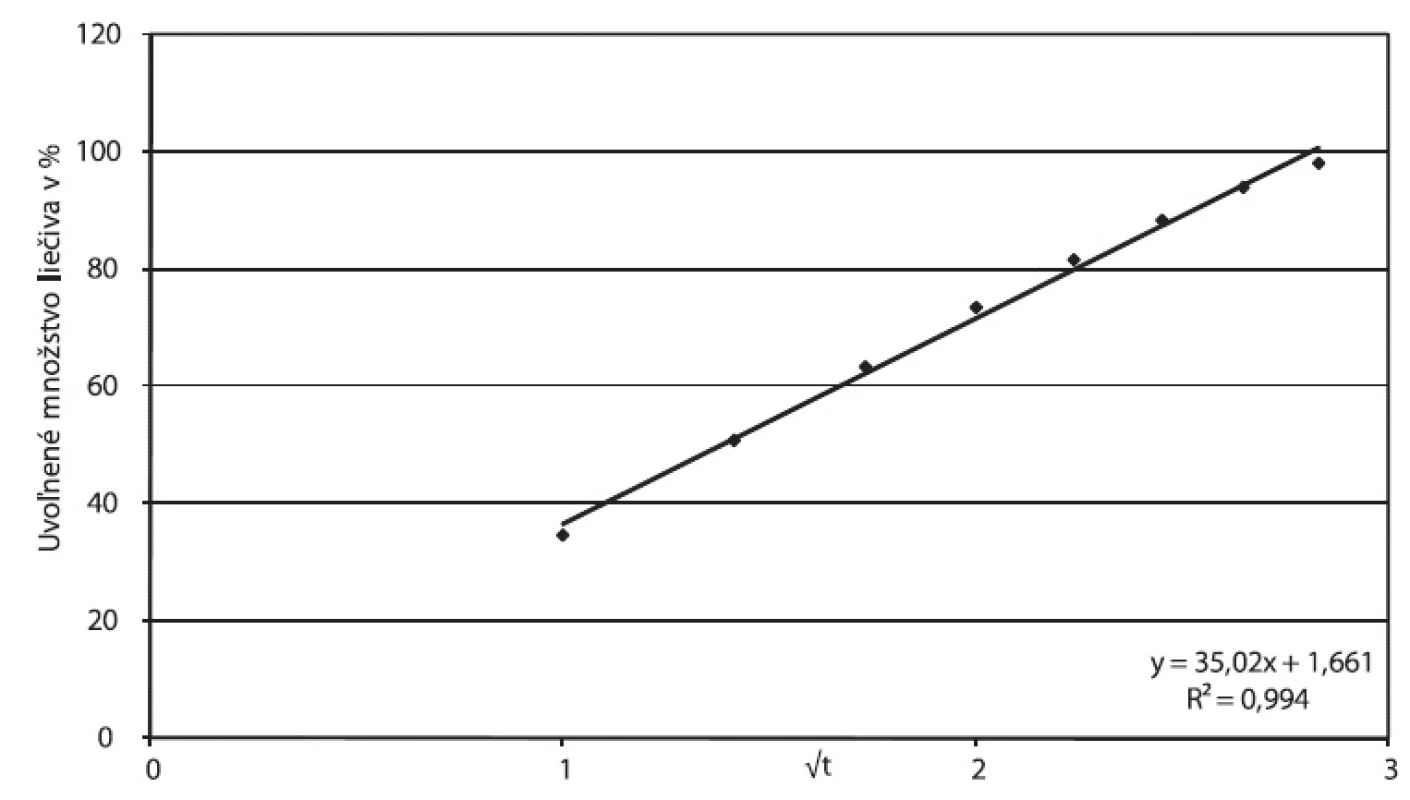
Obr. 7. Príklad A, parametre Korsmeyer-Peppasovho modelu spracované z disolučných údajov in vitro 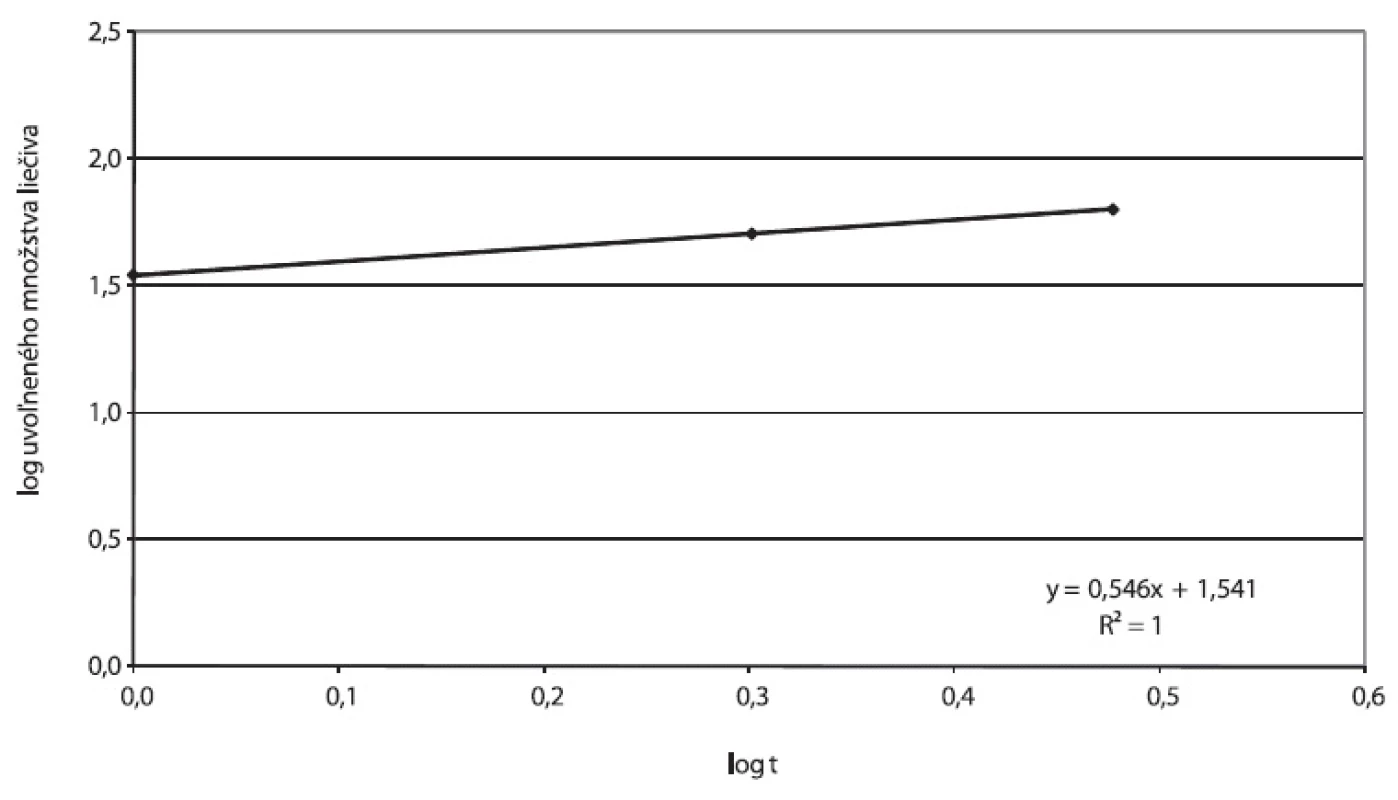
Posúdenie mechanizmu uvoľňovania tabliet s obsahom matricotvorného polyméru Eudragitu NE 30 D a filmotvorného polyméru Kollicoat® SR 30 D (Príklad C) aplikovaním Korsmeyer-Peppasovho modelu naznačuje tzv. „super case-II“ transport (hodnota n = 1,6529). Kombináciu matricového a zásobníkového typu retardácie charakterizuje zmiešaný disolučný mechanizmus. Priebeh disolúcie in vitro však naznačuje možnosť dosiahnutia 24-hodinového účinku liečiva po ďalšej optimalizácii liekovej formy. Z porovnania matricovej tablety Zydol XL 200 a experimentálnej matrice Príklad C vyplýva, že mechanizmus disolúcie je rozdielny. Na rozdiel od v literatúre popísaného farmakokinetického profilu prípravku Zydol XL 200 disolúcia experimentálneho prípravku indikuje nižšiu nástupnú dávku v úvode farmakokinetického profilu a následný rýchlejší nástup maximálnej koncentrácie, t.j. menej vyrovnaný profil uvoľňovania liečiva.
Násobnú liekovú formu Príklad D sme porovnali s prípravkom Tramium 200 mg, ako reprezentantom skupiny rezervoárových násobných formulácií (obr. 8). Difúzna rýchlosť liečiva pre obidve liekové formy závisí od permeability a hrúbky membrány.
Obr. 8. Disolučné profily liekovej formy Tramium 200 mg a experimentálne skúšanej liekovej formy, Príklad D – zásobníková násobná lieková forma 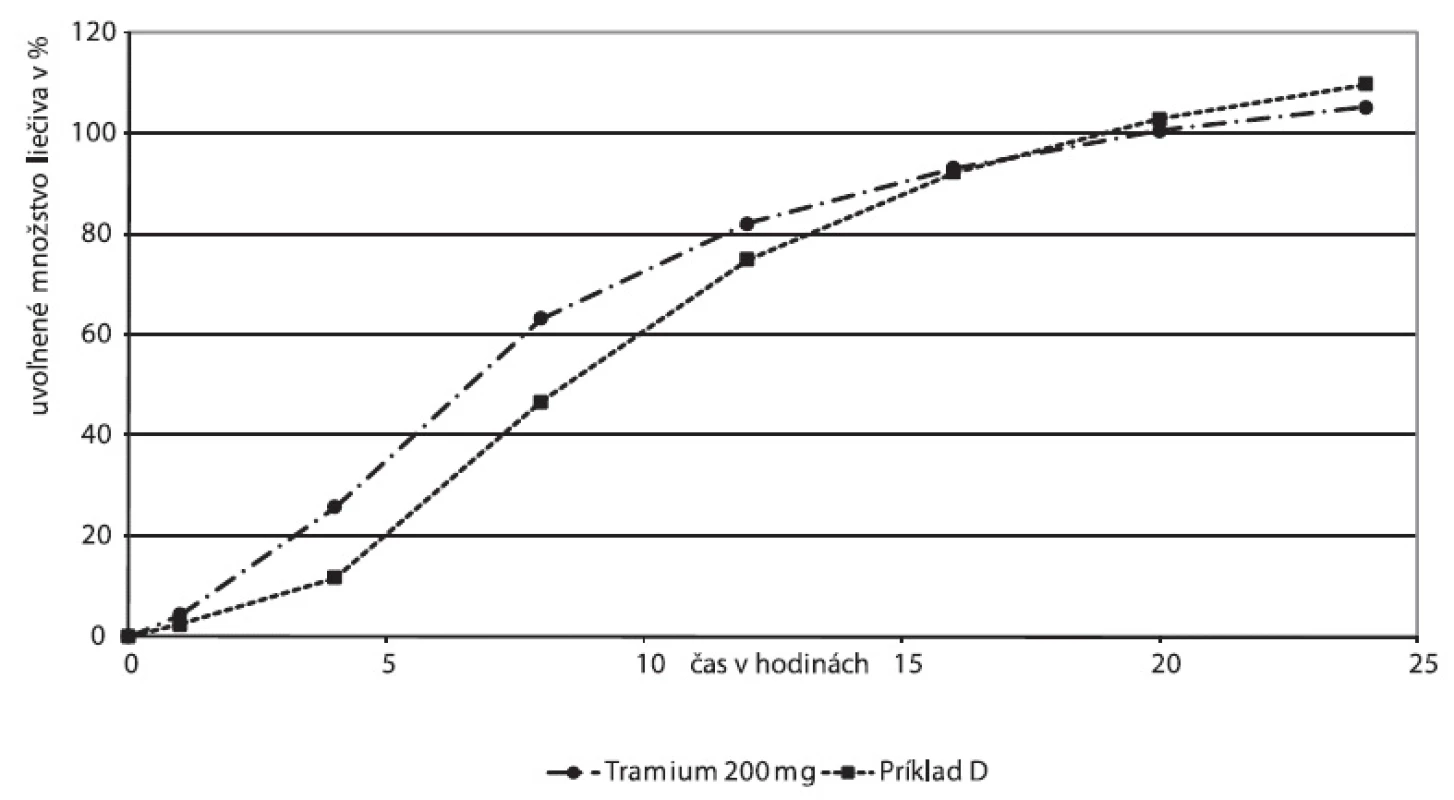
Disolučné krivky násobných liekových foriem Tramium 200 mg a Príkladu D vykazujú podobné charakteristiky: Oneskorenie disolúcie na začiatku disolučnej krivky zodpovedá fáze, počas ktorej dochádza k rozpúšťaniu hydrofilnej látky v obale. Po jej rozpustení vznikajú vo filme póry, t.j. film sa stáva permeabilnejší pre difúziu liečivej látky. Pri obidvoch prípravkoch sme zistili hodnoty exponentu v Korsmeyer-Peppasovom modeli n > 0,89, ktoré môžu zodpovedať postupnej relaxácii polyméru (obr. 9, 10). Tento model bol však odvodený pre matrice, vhodnosť jeho použitia pre zásobníkovú liekovú formu je otázna. Nižšiu priekaznosť výsledku potvrdzujú korelačné koeficienty 0,9512 pre Tramium 200 mg a 0,9671 pre Príklad D.
Obr. 9. Tramium 200 mg, parametre Korsmeyer-Peppasovho modelu spracované z disolučných údajov in vitro 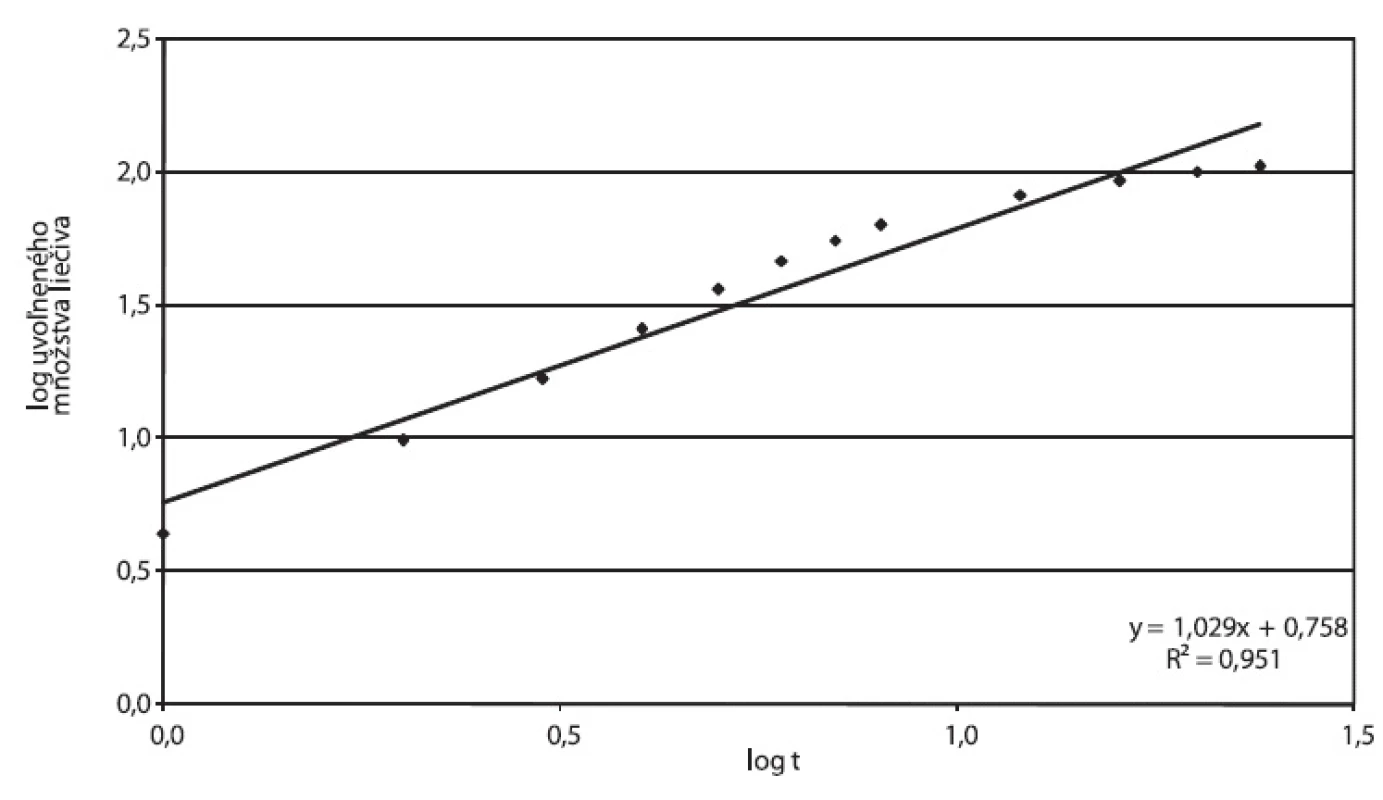
Obr. 10. Príklad D, parametre Korsmeyer-Peppasovho modelu spracované z disolučných údajov in vitro 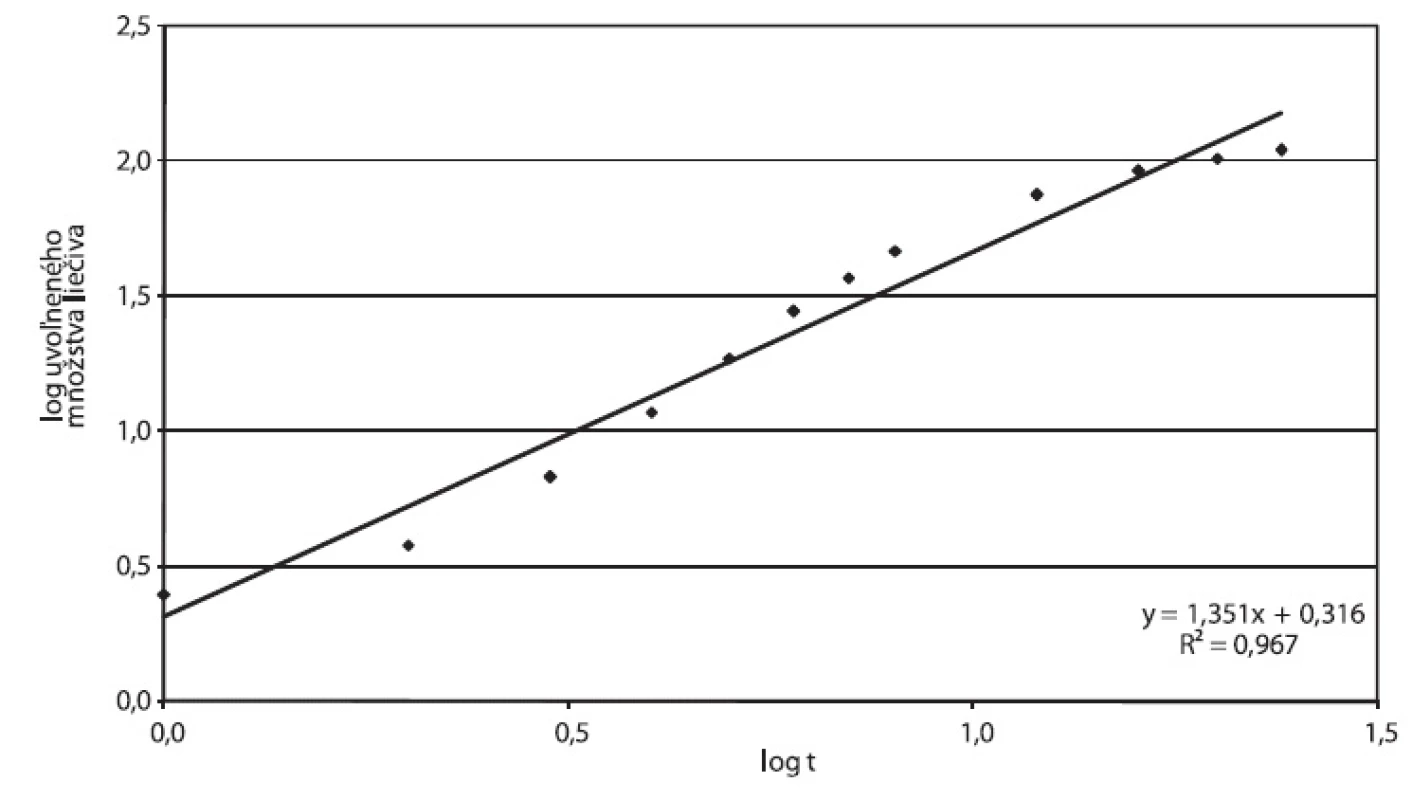
Záver
Na základe porovnania dosiahnutých in vitro výsledkov môžeme konštatovať, že vybrané príklady zloženia matricových tabliet (Príklad C) a peletových zásobníkov (Príklad D), ktoré reprezentujú použitie konkrétnych retardačných polymérov, majú na základe dosiahnutých in vitro disolučných profilov predpoklad dosiahnutia farmakokinetického profilu, ktorý splní požiadavky na liekovú formu tramadoliumchloridu s predĺženým uvoľňovaním zabezpečujúcim 24-hodinový účinok liečiva. Výsledky dosiahnuté použitou disolučnou metódou majú výpovednú hodnotu zodpovedajúcu publikovaným literárnym údajom.
Došlo 14. června 2010
Přijato 24. září 2010
Adresa pro korespondenci:
Ing. Viera Kormanová
Zentiva a.s.,
Nitrianska 100, 920 27 Hlohovec, Slovenská republika
e-mail: viera.kormanova@zentiva.sk
Zdroje
1. Beneš, L., Borovanský, A.: Farmaceutická chemie. Léčiva s účinkem na centrální (2. část) a periferní nervový systém. Veterinárna a farmaceutická univerzita Brno 1999; s. 36–37.
2. Rang, H. P., Dale, M. M., Ritter, J. M., Flower, R. J.: RANG and DALEęS Pharmacology. 6th ed. Elsevier Limited 2007; s. 605 a 607.
3. Lintz, W., Barth, H., Osterloh, G., et al.: Bioavailability of enteral Tramadol formulations: 1 st communication: capsules. Arzneimittelforschung, 1986; 36, 1278–1283.
4. Malonne, H., Sonet, B., Streel, B., et al.: Pharmacokinetic evaluation of a new oral sustained release dosage form of tramadol. Br J Clin Pharmacol., 2004; 257, 270–278.
5. Hernandez-Lopez, C., Martinez-Fanos, L., Karhu, D., Perez-Campos, T., Rovira, S., Encina, G.: Comparative Bioavailability Between Two Tramadol Once – Daily Oral Formulations. Methods Find Exp. Clin. Pharmacol., 2006; 28, 373–378.
6. Traynor, M. J., Brown, M. B., Pannala, A., Beck, P., Martin, G. P.: Influence of Alcohol on the Release of Tramadol from 24-h Controlled-Release Formulations During In Vitro Dissolution Experiments. School of Pharmacy, University of Hertfordshire, Hatfield, Hertfordshire, UK. Drug Dev. Ind. Pharm., 2008; 34, 885–889.
7. Cnota, P. J., Nowak, H., Tagarro, I., Erb, K., Schurer, M., Schulz, H. U., Maus, J.: Tramadol SR Formulations – Pharmacocinetic Comparison of a Multiple-Units Dose (Capsules) versus a Single – Unit Dose (Tablet). Clin. Drug Invest., 2005; 25, 435–443.
8. Aulton, M. E.: Pharmaceutics the science of dosage form design. Edinburgh: Churchill Livingstone 1988; 316.
9. Higuchi, T.: Mechanism of sustained – action medication: theoretical analysis of rate of releaseof solid drugs dispersed in solid matrices. J Pharm Sci., 1963; 52, 1145–1149.
10. Hixson, A. W., Crowell, J. H.: Dependence of reaction velocity uppon surface and agitation (I) theoretical consideration. Ind. Eng. Chem., 1931; 23, 923–931.
11. Korsmeyer, R. W., Lustig, S. R., Peppas, N. A.: Solute and penetrant diffusion in swellable polymers. I. Mathematical modeling. J. Polym. Sci Polym. Phys. Ed., 1986; 24, 395–408.
12. Korsmeyer, R. W., Von Meerwall, E., Peppas, N. A.: Solute and penetrant diffusion in swellable polymers. II. Verification of theoretical models. J. Polym. Sci Polym. Phys. Ed., 1986; 24, 409–434.
13. Európsky liekopis. European Pharmacopeia, 6th edition, 2010 (6.7) Counsel of Europe, Strasbourgh, s. 4344–4346 (13a), s. 3104–3106 (13b), s. 5091–5100 (13c).
14. Tiwari, S. B., Murthy, T. K., Pai, M. R., Metha, P. R., Chowdary, P. B.: Controlled Release Formulation of Tramadol Hydrochloride Using Hydrophilic and Hydrophobic Matrix System. AAPS Pharm SciTech., 2003; 4, article 31.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2010 Číslo 5- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
-
Všechny články tohoto čísla
- Recidivující deprese a spotřeba antidepresiv s dopadem na kvalitu života
-
Štúdium lokálnych anestetík
Časť 191: Využitie umelých neurónových sietí pri štúdiu korelácií medzi vypočítanými a nameranými hodnotami retenčných faktorov k v rôznych separačných systémoch v skupine bázických esterov alkoxysubstituovanej kyseliny fen - Štúdium disolučných profilov tramadoliumchloridu z liekových foriem s riadeným uvoľňovaním matricového a zásobníkového typu
-
Obsahové látky
Philadelphus coronarius L. - Porovnanie metabolického pomeru metoprolol/α-hydroxymetoprolol po jednorázovom a opakovanom užití
-
Léčivé přípravky v Obnoveném pražském dispensatoriu z roku 1750
I. část – úvod a prvních devět tříd lékových forem -
Léčivé přípravky v Obnoveném pražském dispensatoriu z roku 1750
II. část – zbylé lékové formy a vyhodnocení - Ze zasedání Výboru České farmaceutické společnosti
- Doc. RNDr. Magdaléna Fulmeková, CSc., jubiluje
- 60. česko-slovenské Farmakologické dny
- Doc. RNDr. Marie Blešová, CSc. – in memoriam
- Nové Knihy
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Štúdium disolučných profilov tramadoliumchloridu z liekových foriem s riadeným uvoľňovaním matricového a zásobníkového typu
-
Léčivé přípravky v Obnoveném pražském dispensatoriu z roku 1750
I. část – úvod a prvních devět tříd lékových forem -
Obsahové látky
Philadelphus coronarius L. -
Léčivé přípravky v Obnoveném pražském dispensatoriu z roku 1750
II. část – zbylé lékové formy a vyhodnocení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Současné možnosti léčby obezity
nový kurzAutoři: MUDr. Martin Hrubý
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



