-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaHPLC štúdium vplyvu teploty na separáciu niektorých enantiomérov sulfoxidov, stanovenie niektorých enantiomérov sulfoxidov v sére potkana
HPLC study of temperature influence on some enantiomer separations of sulfoxides, determination of some enantiomers of sulfoxides in rat serum
The methylated-teicoplanin aglycone chiral stationary phase (CSP) was used to study the enantioseparation and temperature behaviour of a set of chiral sulfoxides – nine different aryl methyl sulfoxides, 1-methylsulfinylnaphthalene and 1,1-dimethyl-2-phenylethylsulfinylbenzene in polar organic mode. The effect of temperature on the HPLC separation of aromatic sulfoxides was studied between 10 °C and 50 °C in methanol mobile phases with different concentration of the organic modifier in mobile phase composition. The van’t Hoff plots (ln k versus 1/T and ln α versus 1/T, where k is retention factor, T is temperature of chromatographic column, and α is selectivity coefficient) were constructed and thermodynamic data were determined from the slope and the intercept of linear van’t Hoff plots for all 12 racemic compounds under the study. The van’t Hoff plots were linear for all enantiomers. (S) (+) enantiomeric form was eluted as the first one in any case. Solid phase extraction (SPE) was used for the determination of sulfoxides and clean solutions after SPE was injected into a chiral column. The mobile phase was methanol containing acetic acid (17.48 mmol/l) and diethylamine (4.79 mmol/l). The limits of determination (LOQ) were calculated for all compounds under study. The LOQ values were in the range from 7.0 to 24.2 ng/ml, the recovery of extraction was in the range from 82% to 96%.
Key words:
separation of chiral compounds – methylated teicoplanin CSP – sulfoxidies – solid phase extraction – HPLC
Autoři: D. Meričko 1; J. Lehotay 1; J. Čižmárik 2
Působiště autorů: STU v Bratislave, Fakulta chemickej a potravinárskej technológie, Ústav analytickej chémie 1; Univerzita Komenského Bratislava, Farmaceutická fakulta, Katedra farmaceutickej chémie 2
Vyšlo v časopise: Čes. slov. Farm., 2009; 58, 71-77
Kategorie: Přehledy a odborná sdělení
Souhrn
Metylovaný teikoplanín aglykón ako chemicky viazaná chirálna stacionárna fáza (CSP) sa použila na štúdium separácie enantiomérov a štúdium vplyvu teploty na enantioselektivitu niektorých chirálnych sulfoxidov – deväť rôznych aryl metyl sulfoxidov, 1-(metylsulfinyl) naftalén a [(1,1-dimetyl-2-fenyletyl)sulfinyl]benzén v polárnom organickom móde. Vplyv teploty na separáciu enantiomérov sa študoval v rozsahu od 10 °C do 50 °C v metanole ako mobilnej fáze s rozdielnou koncentráciou organického modifikátora v mobilnej fáze. Na základe van’t Hoffových závislostí (grafická závislosť ln k od 1/T a ln α od 1/T, kde k je retenčný faktor, T je teplota a α je selektivitný faktor) sa vypočítali termodynamické parametre pre 12 chirálnych sulfoxidov. Van’t Hoffove závislosti mali lineárny priebeh pre všetky enantioméry. Elučné poradie enantiomérov sa v danom rozsahu teploty nemenili, (S) (+) enantiomér eluoval prvý. Na analýzu sulfoxidov vo vzorke potkanieho séra sa použila extrakcia tuhou fázou, po prečistení vzorky sa číry roztok dávkoval do chirálnej kolóny s mobilnou fázou metanol – kyselina octová (17,48 mmol/l) – dietylamín (4,79 mmol/l). Medza stanovenia sa vypočítala pre všetky študované sulfoxidy a bola v rozsahu od 7,0 do 24,2 ng/ml, účinnosť extrakcie bola v intervale od 82 % do 96 %.
Klúčové slová:
separácia chirálnych látok – metylovaný teikoplanín CSP – sulfoxidy – extrakcia tuhou fázou – HPLCÚvod
Makrocyklické antibiotiká, zvlášť teikoplanín glykopeptidy, sú veľmi vhodnými chirálnymi selektormi na separáciu enantiomérov väčšiny chirálnych látok 1–4). V dôsledku väčšieho počtu stereogénnych centier, pri separácii sa môžu využiť rôzne interakčné stereošpecifické mechanizmy, najčastejšie sa vyskytujú polárne a iónové interakcie 3, 5). Vo všeobecnosti glykopeptidické chirálne selektory využívajú možné interakcie s viacerými funkčnými skupinami naviazaných na skelete aglykónu (napríklad hydroxylová, amínová, amidická, karboxylová skupina), interakcie pomocou π-elektrónov (hlavne benzénové jadrá) a interakcie s hydrofóbnymi centrami. Tieto interakcie umožňujú využiť rozdielne molekulové vlastnosti separovaných látok vrátane hydrofóbnych, iónových, dipól – dipól, π – π a stérických interakcií 6). Glykopeptidické chirálne selektory sa môžu použiť aj v reverzom fázovom systéme, v konvenčnom a polárnom – organickom móde 7). Účinnosť separácie sa niekedy môže zvýšiť použitím metylovaného teikoplanínu (MTAG), čím sa značne obmedzí tvorba interakcií cez vodíkové väzby a v niektorých prípadoch sa môže podstatne zvýšiť enantioselektivita 6, 8).
Chirálne sulfoxidy sa často používajú ako intermediátory pri syntézach, dôležitých bioaktívnych látok 9–12), pri asymmetrických syntézach 13, 14) a zaraďujú sa medzi často používané reagenty pri syntéze liečiv 15). Z tohto hľadiska je potrebné kontrolovať prítomnosť sulfoxidov v biologických vzorkách. Termodynamické štúdie a zhodnotenie vplyvu teploty na selektivitu separácie enantiomérov sulfoxidov môže vysvetliť niektoré interakčné mechanizmy pri chromatografickej separácii.
Zmenu parciálnej mólovej entalpie (ΔHi) a zmenu parciálnej mólovej entropie (ΔSi) pri prechode molekúl separovanej látky z jednej fázy do druhej možno vypočítať podľa van’t Hoffovej rovnici [1]:
kde ki je retenčný faktor, ΔHi je zmena parciálnej mólovej entalpie, ΔSi je zmena parciálnej mólovej entropie, R je plynová konštanta, T je teplota chromatografickej kolóny a φ je pomer fáz definovaný ako pomer objemu stacionárnej fázy Vs, a objemu mobilnej fázy Vm. Uvedená rovnica sa rieši graficky použitím regresnej analýzy tak, že sa zostrojí graf ln k v závislosti od 1/T, potom zo smernice závislosti (–ΔHi/R) možno vypočítať ΔHi a ΔSi, sa vypočíta z úseku na osi y (ΔSi+ ln φ).
Podobným spôsobom možno zistiť vplyv teploty na enantioselektivitu podľa rovnice [2], ktorá sa rieši graficky použitím regresnej analýzy na základe závislosti lnα od 1/T, kde hodnota Δ(ΔH2,1) sa vypočíta zo smerice závislosti a Δ(ΔS2,1) z úseku na osi y.
Hodnota Δ(ΔH2,1) reprezentuje rozdiel v zmene entalpie a hodnota Δ(ΔS2,1) vyjadruje rozdiel v zmene entropie medzi dvojicou enantiomérov. Inými slovami tento rozdiel termodynamických parametrov znázorňuje zmenu uvedených termodynamických parametrov, ktorá je potrebná na enantioseparáciu.
Cieľom tejto práce bolo preskúmať vplyv zloženia mobilnej fázy na selektivitu separácie z hľadiska termodynamických parametrov pri použití MTAG ako chirálnej stacionárnej fázy. Na úpravu biologickej vzorky pred dávkovaním do chirálnej chromatografickej kolóny sa použila extrakcia tuhou fázou (SPE).
POKUSNÁ ČASŤ
Chemikálie
Štruktúra študovaných chirálnych sulfoxidov sa uvádzajú na obrázku 1. Všetky sulfoxidy sa pripravili na Ústave analytickej chémie, Fakulta chemickej a potravinárskej technológie, STU v Bratislave podľa postupu uvedeného v literatúre 16, 17). Chemikálie a rozpúšťadlá pre HPLC (metanol, kyselina octová, dietylamín a voda) sa zakúpili od fy. Merck (Nemecko).
Obr. 1. Štruktúra študovaných sulfoxidov 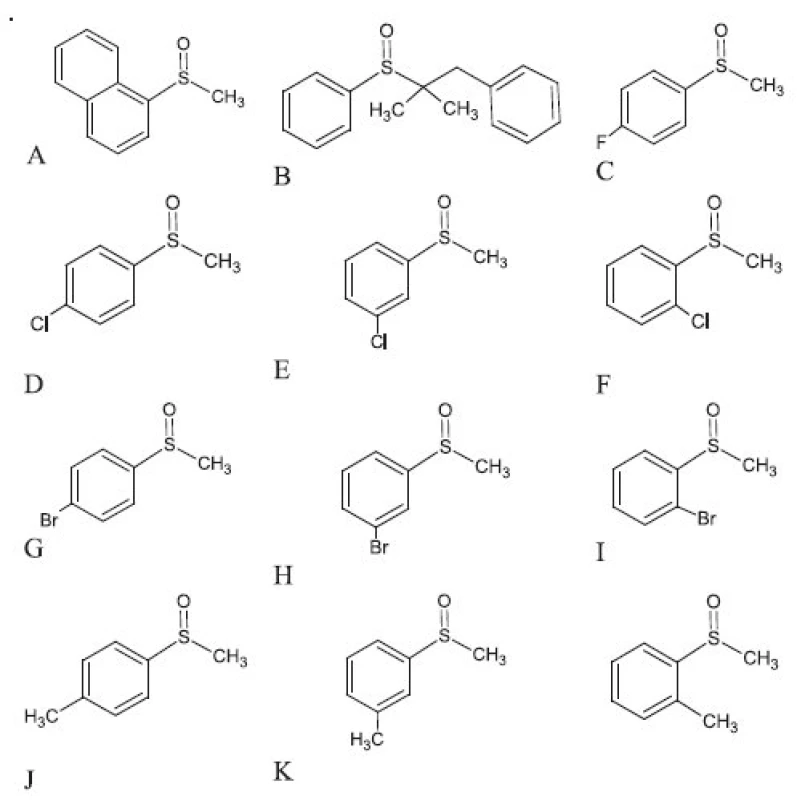
Prístrojová technika
V práci sa použil kvapalinový chromatografický systém Hewlett Packard 1100, ktorý pozostával z vysokotlakového čerpadla, dávkovacieho ventilu (Rheodyne 7724) s 20 μl dávkovacou kapilárou, spektrofotometrický detektor s diódovým poľom a polarimetrický detektor (Chiralyzer, IBZ MESSTECHNIK, Nemecko). Detektory boli zapojené v sérii. Teplota chromatografickej chirálnej kolóny sa kontrolovala termostatom (LCT 5100, INGOS, Česká republika).
Pracovný postup
Chirálna kolóna (150× 4,6 mm I.D., Astec, USA) s metylovaným aglykónom teikoplanínu (MTAG) sa použila na štúdium chirálnych vlastností enantiomérov sulfoxidov. Mobilnou fázou boli čistý metanol (MP1) a metanol so 17,48 mmol/l kyseliny octovej (Hac) a s rozdielnou koncentráciou dietylamínu (Dea). Použili sa nasledujúce koncentrácie Dea: bez prídavku Dea (MP2), ďalej s prídavkami 2,39 mmol/l (MP3), 4,79 mmol/l (MP4), 9,57 mmol/l (MP5) a 14,36 mmol/l (MP6). Termodynamické parametre sa merali pri izotermických podmienkach v rozsahu teplôt od 10 °C do 50 °C pri 10 °C intervaloch. Relatívna smerodajná odchýlka teploty kolóny bola ± 0,1 °C. Analyty sa rozpustili v metanole (koncentrácia 1 mg/ml). Roztoky štandardov sa zriedili na konečné koncentrácie v rozsahu od 2,5 μg/ml do 100 μg/ml (5 roztokov s rôznymi koncentráciami). Roztoky štandardov sa pripravili pre každú racemickú zmes a rovnica kalibračnej priamky sa vypočítala metódou regresnej analýzy. SPE sa použila na prípravu vzoriek potkanieho séra k analýze, ku ktorým sa pridali prídavky štandardu, tak aby koncentrácia štandardov bola 5 μg/ml séra. SPE kolónka OASIS HLB (30 mg, 1ml, Waters, Ireland) sa najprv premyla 1 ml metanolom a 1 ml deionizovanej vody; 0,5 ml vzorky séra sa nadávkovalo do SPE kolónky. Po nadávkovaní sa SPE kolónka premyla 1 ml zmesou deionizovanej vody a metanolu (95/5 v/v). Sorbované analyty sa vymyli zmesou metanolu, 17,48 mmol/l kyseliny octovej a 4,79 mmol/l dietylaminu (MP4) v objeme 0,5 ml. 20 μl eluátu sa potom dávkoval do chirálnej chromatografickej kolóny. Rovnaký pracovný postup sa použil aj pri analýze potkanieho séra bez prídavku štandardu. Na detekciu separovaných látok sa použila vlnová dĺžka 254 nm. Elučné poradie separovaných enantiomérov sulfoxidov sa zistilo polarimetrickým detektorom a pre všetky racemické zmesi študovaných sulfoxidov sa prvý eluoval (S) (+) - enantiomér.
Výsledky a diskusia
Závislosť hodnôt retenčných faktorov jednotlivých enantiomérov od zloženia mobilnej fázy je na obrázku 2. Hodnoty retenčných faktorov klesajú so zvyšovaním koncentrácie Dea v mobilnej fáze. Ak mobilnou fázou je čistý metanol (MP1), potom retenčné faktory nadobúdajú vyššie hodnoty v porovnaní s inými mobilnými fázami s organickými modifikátormi. Možno predpokladať, že acidita alebo bazicita ale aj iónová sila mobilnej fázy má vplyv na retenčný mechanizmus študovaných enantiomérov sulfoxidov. Na druhej strane hodnoty selektivitných faktorov sa zvyšujú so zvyšovaním bázicity mobilnej fázy do určitej hodnoty, kedy zrejme sa mení interakčný mechanizmus (obr. 3).
Obr. 2. Vplyv zloženia mobilnej fázy na hodnoty retenčných faktorov jednotlivých enantiomérov. Chirálna kolóna MTAG, podmienky separácie sa uvádzajú v experimentálnej časti. 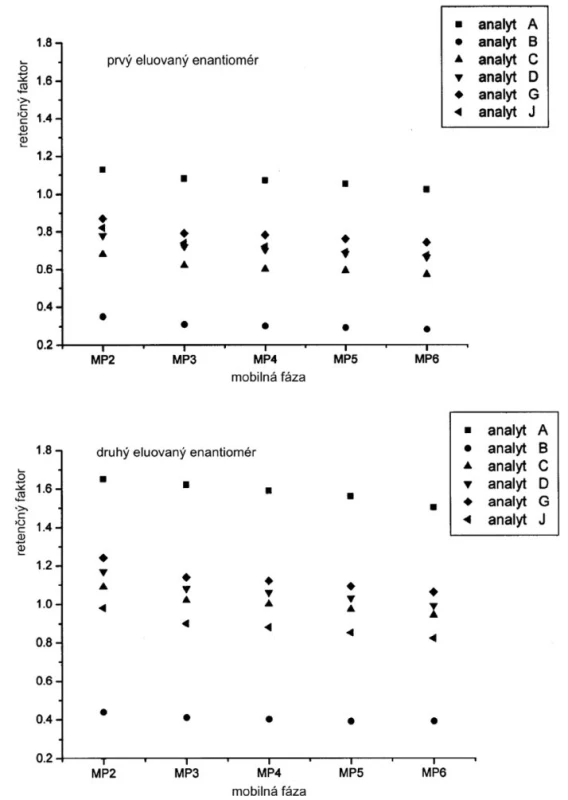
Obr. 3. Vplyv zloženia mobilnej fázy na hodnoty enatioselektivitných rozlišovacích faktorov jednotlivých enantiomérov. Chirálna kolóna MTAG, podmienky separácie sa uvádzajú v experimentálnej časti. 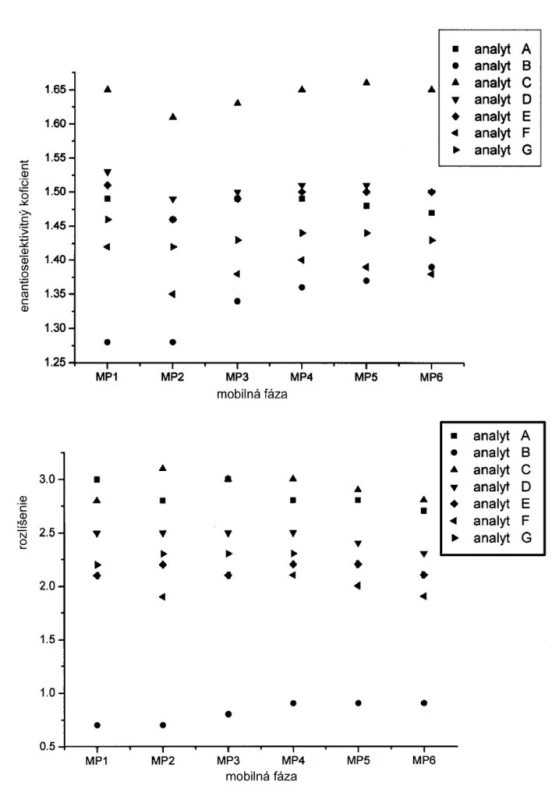
V tabuľkách 1–6 sa uvádzajú termodynamické parametre, ktoré sa vypočítali zo vzťahov 1 a 2. Podmienkou správneho výpočtu týchto parametrov je, aby van’t Hoffove závislosti (ln ki vs. 1/T) boli lineárne v danom rozsahu teplôt. Pre všetky študované sulfoxidy hodnoty korelačných koeficientov van’t Hoffových závislostí boli nad hodnotou 0,99, čo dokumentovalo lineárny priebeh závislostí. Podobne v prípade závislostí enantioselektivity od teploty (obr. 4) boli hodnoty korelačných koeficientov v rozsahu od 0,98 do 0,99. Na základe získaných výsledkov možno konštatovať, že v danom rozsahu teplôt nedochádza k zmene retenčného mechanizmu a k zmene poradia eluovaných enantiomérov, enantiomér (S) (+) mal hodnotu retenčného faktora vždy nižšiu ako enantiomér (R) (-). Závislosť retenčného faktora od teploty čiastočne ovplyvňovala zmena zloženia mobilnej fázy (tab. 1–6).
Obr. 4. Van’t Hoffove závislosti ln k<sub>i</sub> od 1/T pre vybraté analyty. Chirálna kolóna MTAG, mobilná fáza MP6, ďalšie podmienky separácie sa uvádzajú v experimentálnej časti. 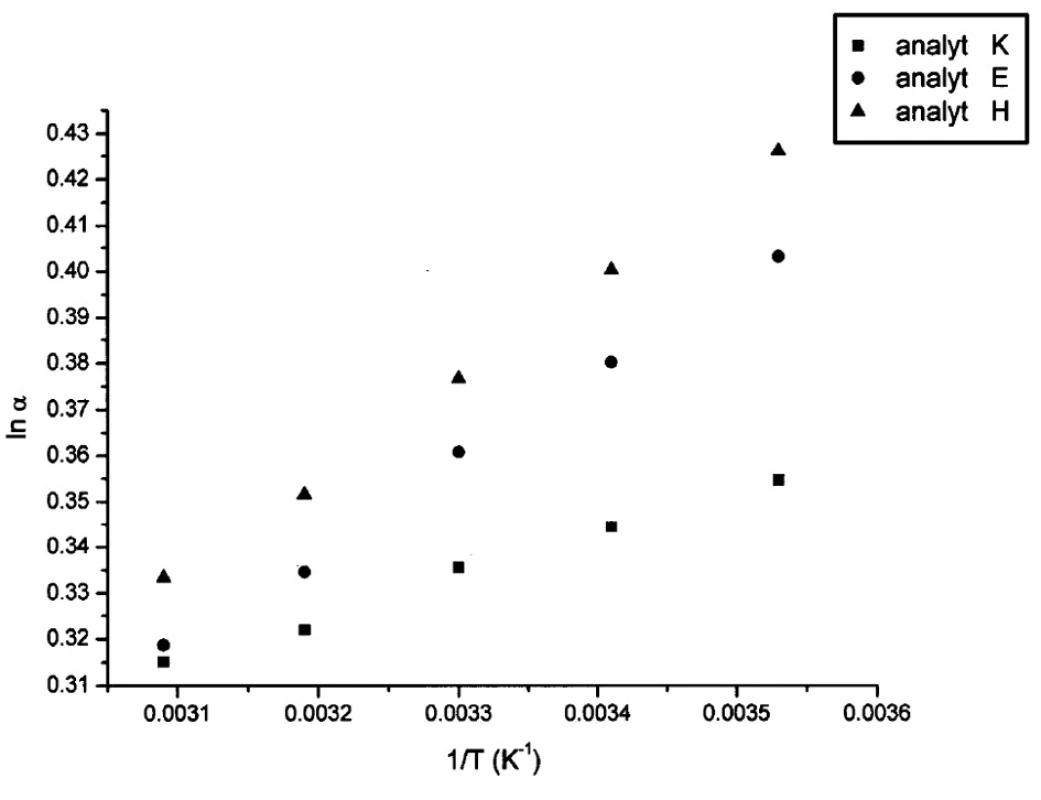
Tab. 1. Termodynamické parametere vypočítané z van’t Hoffových závislostí (ln ki vs 1/T) pre prvý a druhý eluovaný enantiomér. Chirálna kolóna MTAG, mobilná fáza MP1, ďalšie podmienky separácie sa uvádzajú v experimentálnej časti. 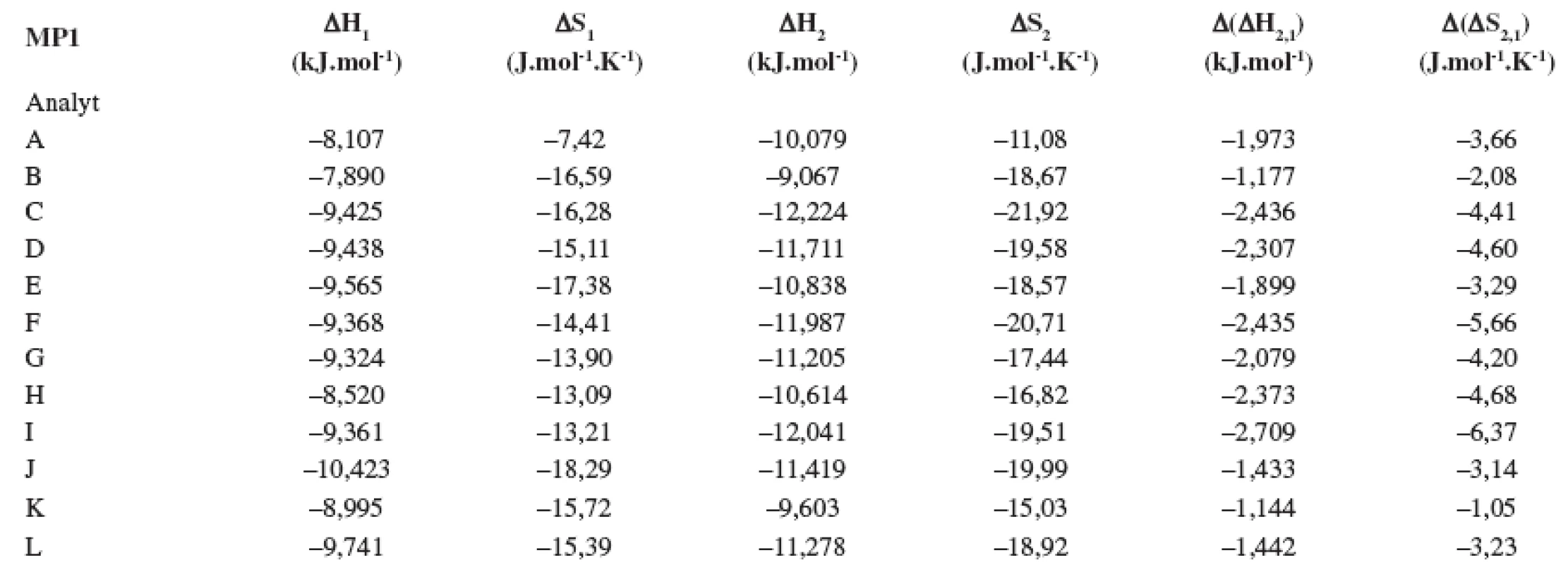
Index 1 a 2 sa vzťahuje na prvý a druhý eluovaný enantiomér. Fázový pomer, ktorý sa použil na výpočet zmeny entropie, bol φ = 0,09. Tab. 2. Termodynamické parametere vypočítané z van’t Hoffových závislostí (ln ki vs 1/T) pre prvý a druhý eluovaný enantiomér. Chirálna kolóna MTAG, mobilná fáza MP2, ďalšie podmienky separácie sa uvádzajú v experimentálnej časti. 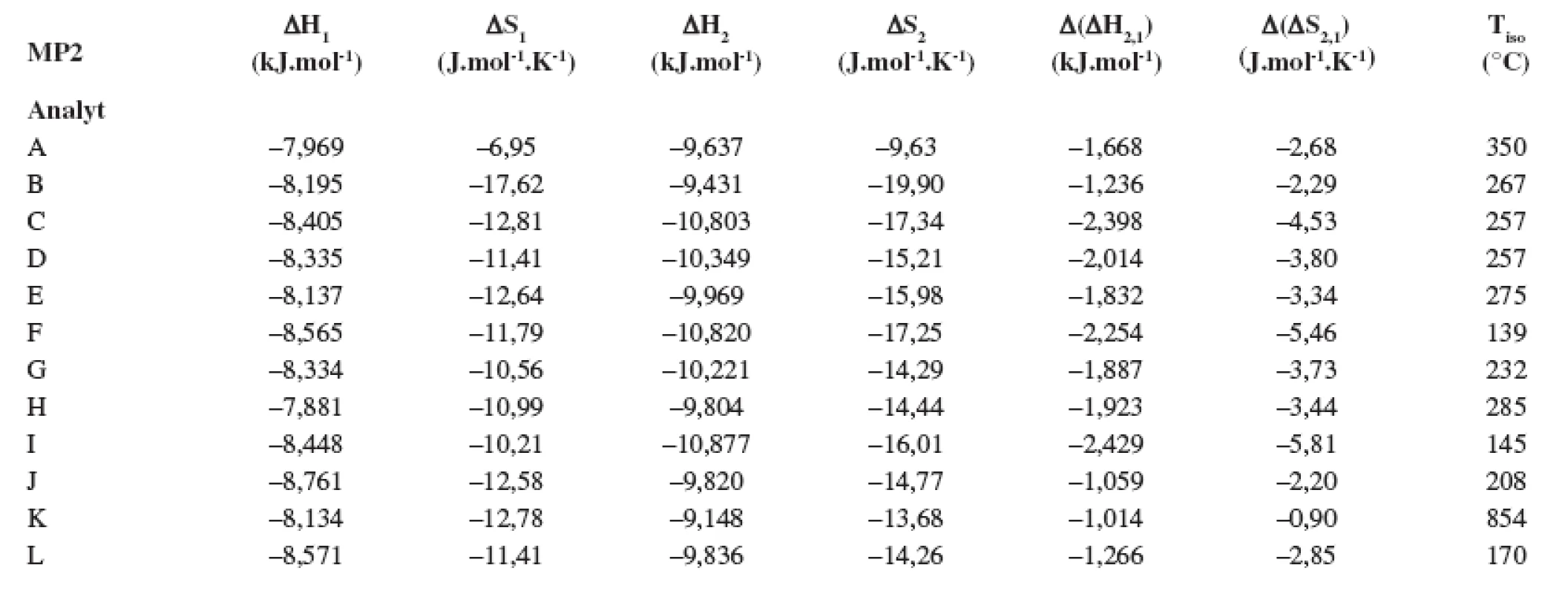
Index 1 a 2 sa vzťahuje na prvý a druhý eluovaný enantiomér. Fázový pomer, ktorý sa použil na výpočet zmeny entropie, bol φ = 0,09. Tab. 3. Termodynamické parametere vypočítané z van’t Hoffových závislostí (ln ki vs 1/T) pre prvý a druhý eluovaný enantiomér. Chirálna kolóna MTAG, mobilná fáza MP3, ďalšie podmienky separácie sa uvádzajú v experimentálnej časti. 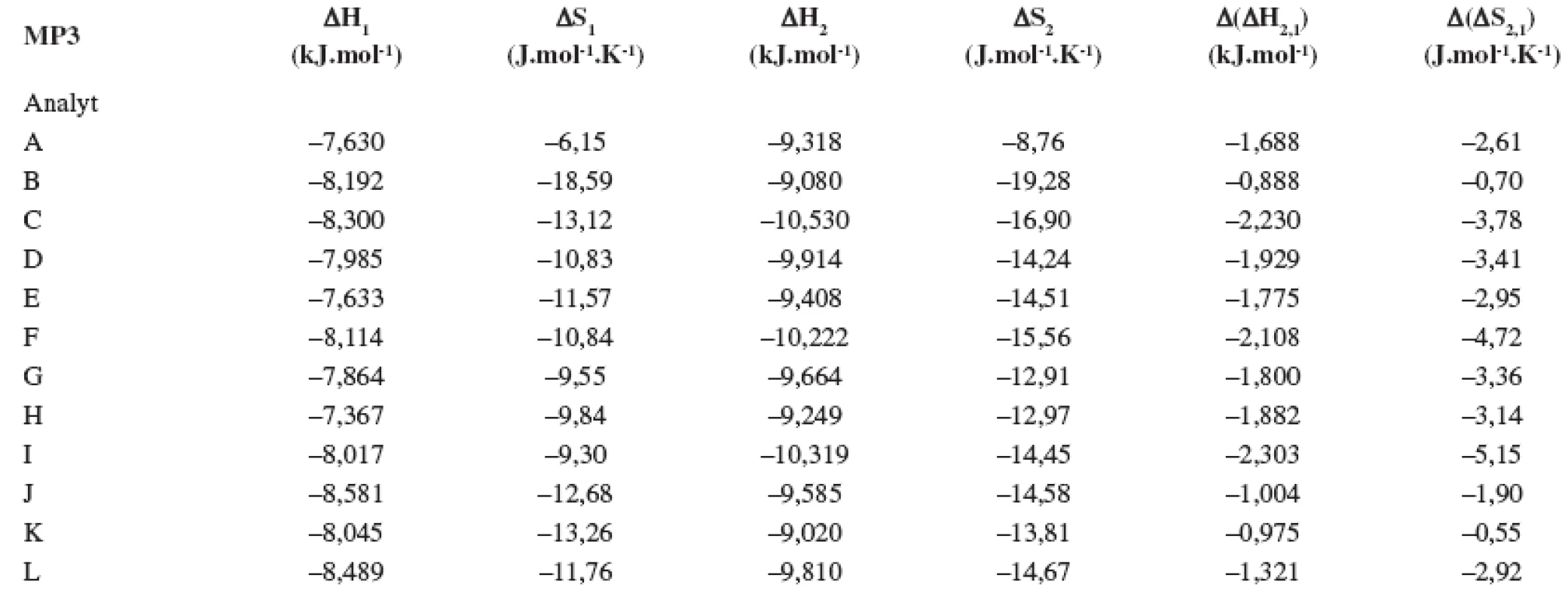
Index 1 a 2 sa vzťahuje na prvý a druhý eluovaný enantiomér. Fázový pomer, ktorý sa použil na výpočet zmeny entropie, bol φ = 0,09. Tab. 4. Termodynamické parametere vypočítané z van’t Hoffových závislostí (ln ki vs 1/T) pre prvý a druhý eluovaný enantiomér. Chirálna kolóna MTAG, mobilná fáza MP4, ďalšie podmienky separácie sa uvádzajú v experimentálnej časti. 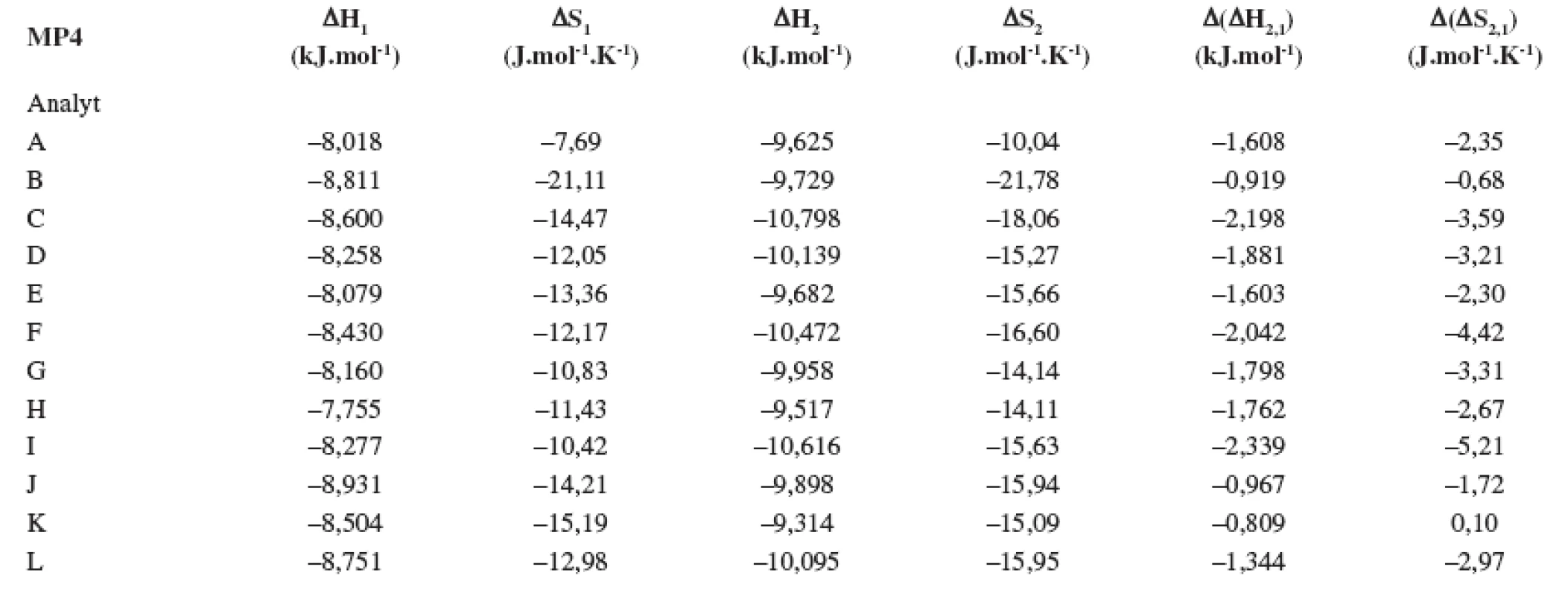
Index 1 a 2 sa vzťahuje na prvý a druhý eluovaný enantiomér. Fázový pomer, ktorý sa použil na výpočet zmeny entropie, bol φ = 0,09. Tab. 5. Termodynamické parametere vypočítané z van’t Hoffových závislostí (ln ki vs 1/T) pre prvý a druhý eluovaný enantiomér. Chirálna kolóna MTAG, mobilná fáza MP5, ďalšie podmienky separácie sa uvádzajú v experimentálnej časti. 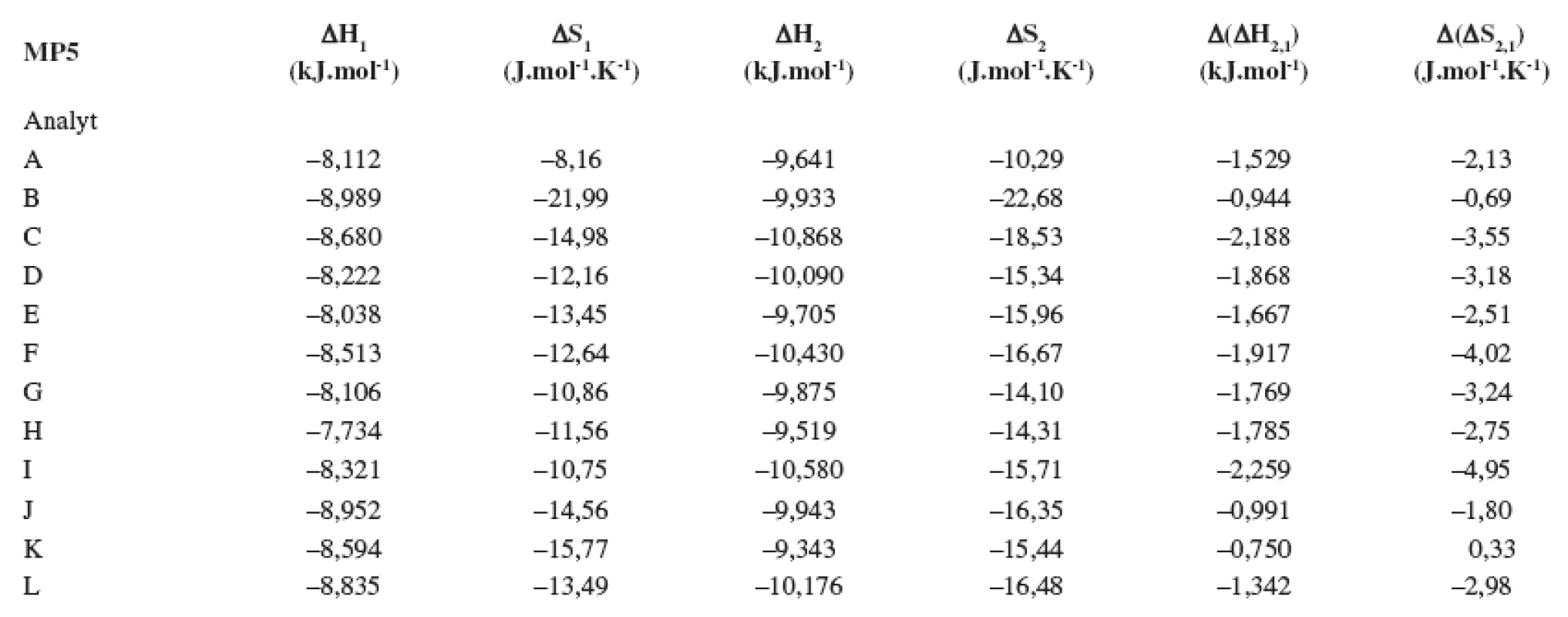
Index 1 a 2 sa vzťahuje na prvý a druhý eluovaný enantiomér. Fázový pomer, ktorý sa použil na výpočet zmeny entropie, bol φ = 0,09. Tab. 6. Termodynamické parametere vypočítané z van’t Hoffových závislostí (ln ki vs 1/T) pre prvý a druhý eluovaný enantiomér. Chirálna kolóna MTAG, mobilná fáza MP6, ďalšie podmienky separácie sa uvádzajú v experimentálnej časti. 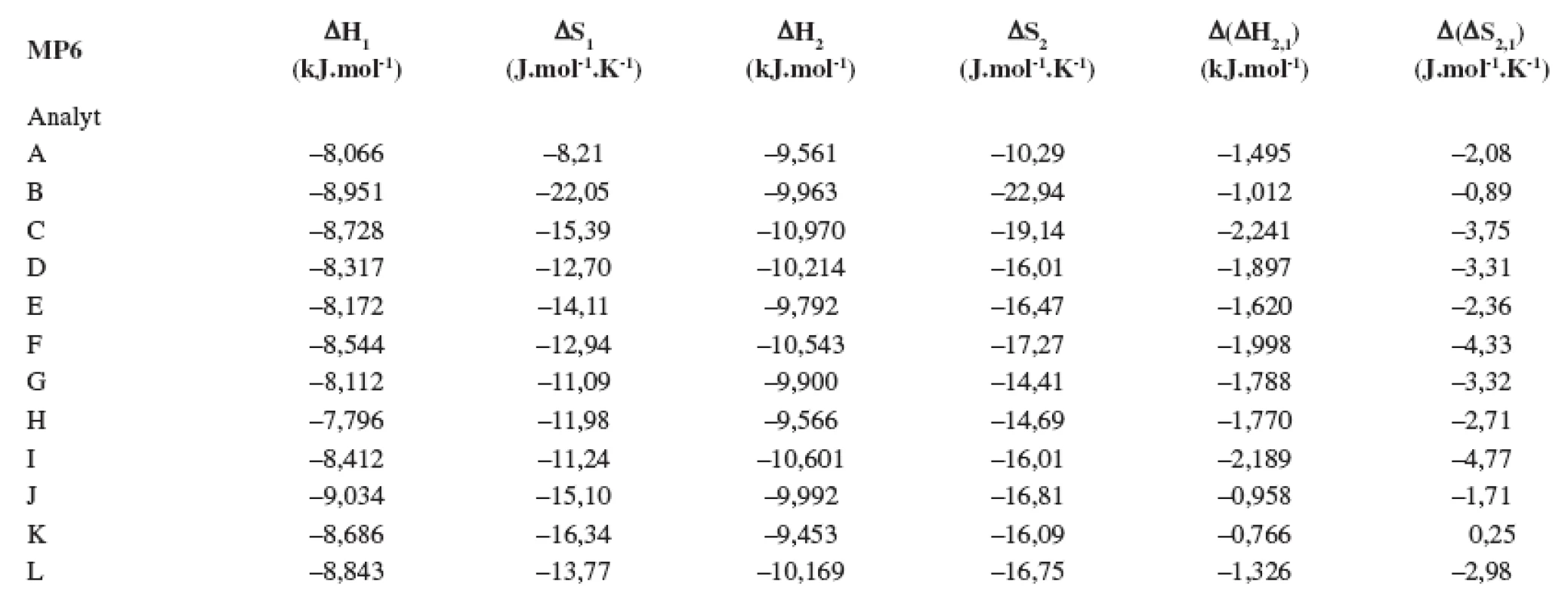
Index 1 a 2 sa vzťahuje na prvý a druhý eluovaný enantiomér. Fázový pomer, ktorý sa použil na výpočet zmeny entropie, bol φ = 0,09. Na stanovenie enantiomérov sulfoxidov v biologických vzorkách sa musela použiť extrakcia tuhou fázou, čím sa dosiahlo skoncentrovanie sulfoxidov v menšom objeme a zabránilo sa možnému znehodnoteniu chirálnej kolóny MTAG v dôsledku ireverzibilnej sorpcie látok z biologickej vzorky. Postup pri extrakcii je opísaný v Experimentálnej časti. Účinnosti extrakcie tuhou fázou s hodnotami medze stanovenia (LOD) pre všetky študované sulfoxidy sa uvádzajú v tabuľke 7. Na obrázku 5 sa prezentujú chromatografické záznamy separácie sulfoxidov v reálnej vzorke. Je zrejmé, že teplota ovplyvňuje hodnoty retenčných faktorov sulfoxidov prítomných v sére potkana. Z obrázku vyplýva, že i pri vyššej teplote chromatografickej kolóny nedochádza k interferencii s ostatnými látkami zo vzorky a týmto spôsobom možno skrátiť čas analýzy.
Tab. 7. Smernice a úseky na osi y regresnej kalibračnej priamky (y = a x + b) s hodnotami korelačných koeficientov daných závislostí, medze stanovenia (LOQ) a účinnosť SPE študovaných sulfoxidov z potkanieho séra. Podmienky separácie sa uvádzajú v experimentálnej časti. 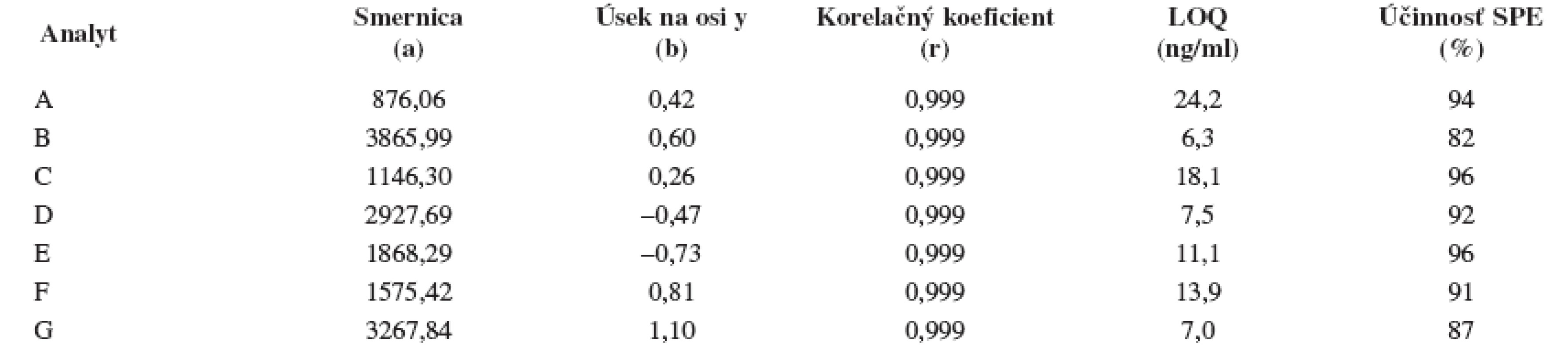
Hodnota relatívnej smerodajnej odchýlky účinnosti SPE bola v rozsahu 2–5% (n = 3). Obr. 5. Chromatografické záznamy analýz extraktu potkanieho séra s prídavkom štandardu enantiomérov sulfoxidov pri rôznych teplotách, podmienky separácie sa uvádzajú v experimentálnej časti. 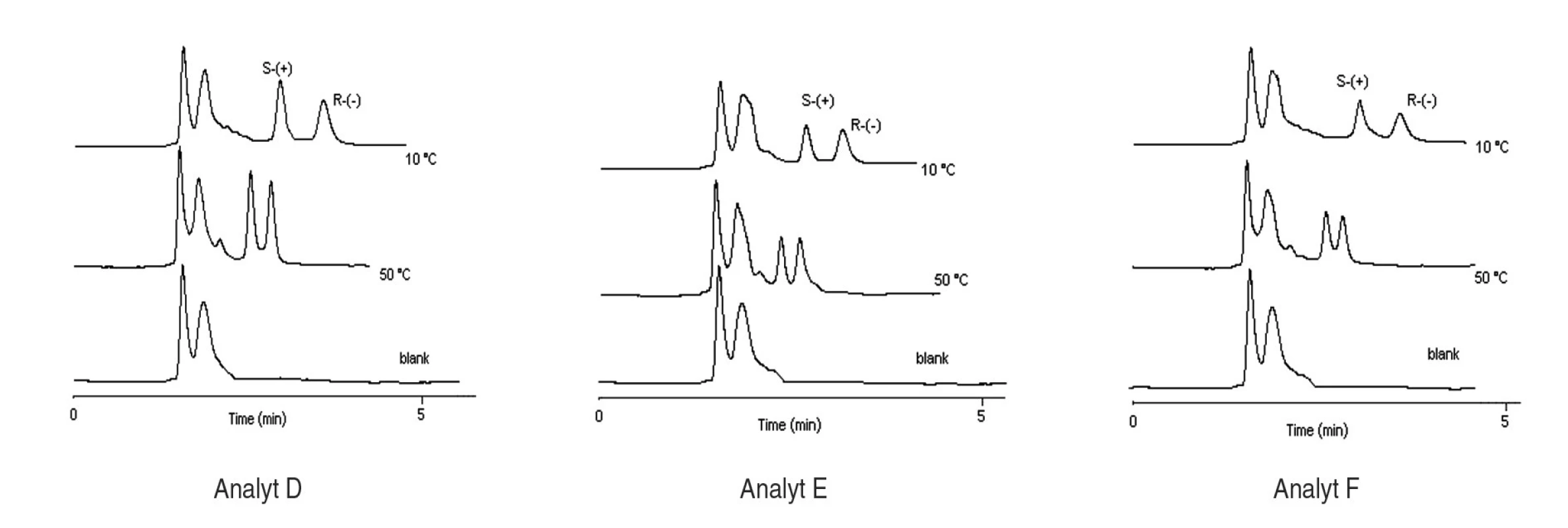
Táto práca sa uskutočnila vďaka finančnej podpore Grantovej agentúry Slovenskej republiky (grant 1/0058/08), APVV projekt No. 20-035-205 and VEGA projekt č. 1/4291/07.
Došlo 23. března 2009 / Přijato 15. dubna 2009
Adresa pre korešpondenciu:
prof. ing. Jozef Lehotay, DrSc.
Ústav analytickej chémie FChPT, STU
Radlinského 9, 812 37 Bratislava, SR
e-mail: jozef.lehotay@stuba.sk
Zdroje
1. Beesley, T. E., Scott R. P. W.: Chiral Chromatography. Chichester: NS Wiley 1998; 242–243.
2. Lämmerhofer, M., Lindner, W. Valkó, K.: Separation Methods in Drug Synthesis and Purification Amsterdam: Elsevier 2000; 381–382.
3. Jandera, P., Bačkovská, V., Felinger, A.: J. Chromatogr. A, 2001; 919, 67–77.
4. Berthod, A., Xiao, T.L., Liu, Y., Jenks, W.S., Armstrong, D.W.: J. Chromatogr. A, 2002; 955, 53–69.
5. Armstrong, D.W., Liu, Y., Ekborg-Ott, K.H.: Chirality, 1995; 7, 474–497.
6. Lokajová, J., Tesařová, E., Armstrong, D.W.: J. Chromatogr. A, 2005; 1088, 57–66.
7. Aboul-Enein, H. Y., Ali, I.: Farmaco, 2002; 57, 513–529.
8. Xiao, T. L., Tesařová, E., Anderson, J. L., Egger, M., Armstrong, D.W.: J. Sep.Sci., 2006; 29, 429–445.
9. Yamanoi, Y., Inamoto, T.: J. Org. Chem., 1997; 62, 8560–8564.
10. Delouvrie, B., Fensterbank, L., Lacote, E., Malacria, M.: J. Am. Chem. Soc., 1999; 121, 11395–11401.
11. Padmanabhan, S., Lavin, R. C., Durant, G. J.: Tetrahedron Asymmetry, 2000; 11, 3455–3457.
12. Cotton, H., Elebring, T., Larsson, M., Li, L., Sorensen, H., von Unge, S.: Tetrahedron Asymmetry, 2000; 11, 3819–3825.
13. Carreno, M. C.: Chem. Rev., 1995; 95, 1717–1760.
14. Walker, A. J.: Tetrahedron Asymmetry, 1992; 3, 961–998.
15. Cass, Q. B., Kohn, C. K., Calafatti, S. A., Aboul-Eneim, H. Y.: J. Pharm. Biomed. Anal., 2001; 26, 123–130.
16. Schuetz, R. D. , Ciporin, L.: J. Org. Chem., 1958; 23, 206–209.
17. Borwell, F. G., Pitt, B. M.: The formation of α-chloro sulfides from sulfides and from sulfoxides. J. Am. Chem. Soc., 1955; 77, 572–578.
Štítky
Farmacie Farmakologie
Článek Beta-blokátoryČlánek Nové knihy
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2009 Číslo 2- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
-
Všechny články tohoto čísla
- Příznivé účinky rutinu, kvercitrinu a kvercetinu na nespecifické střevní záněty
- K pojmům farmaceutická péče, lékárenská péče a správná lékárenská praxe
- Beta-blokátory
- Produkce isoflavonoidů v suspenzní kultuře Trifolium pratense L.
- HPLC štúdium vplyvu teploty na separáciu niektorých enantiomérov sulfoxidov, stanovenie niektorých enantiomérov sulfoxidov v sére potkana
- Štúdium lokálnych anestetík Časť: 187 Extrakcia 1-metyl-2-piperidínoetylesterov alkoxyfenylkarbámových kyselín z ľudskej plazmy polymérmi s odtlačkami molekúl a porovnanie s klasickou extrakciou tuhou fázou*
- Využitie rádionuklidovej röntgenofluorescenčnej analýzy pri stanovení obsahu ťažkých kovov v dextránoch v tuhom a kvapalnom skupenstve
- Ze zasedání Výboru České farmaceutické společnosti
- Významné životní jubileum prof. RNDr. Evy Kvasničkové, CSc.
- Nové knihy
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Beta-blokátory
- K pojmům farmaceutická péče, lékárenská péče a správná lékárenská praxe
- Příznivé účinky rutinu, kvercitrinu a kvercetinu na nespecifické střevní záněty
- Významné životní jubileum prof. RNDr. Evy Kvasničkové, CSc.
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Současné možnosti léčby obezity
nový kurzAutoři: MUDr. Martin Hrubý
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





