-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPelety s obsahem chitosanu připravené metodou extruze-sferonizace
Chitosan pellets produced by extrusion-spheronisation
Chitosan, an intensively studied semisynthetic polymer, has many possible uses due to its special parameters. Chitosan is also presently useful as an excipient in pharmaceutical industry due to its binding, mucoadhesive, viscosity-increasing and film-coating properties which depend on its concentration. Pellets, spherical multiple dosage forms, make possible to solve a lot of problems with oral administration of drugs thanks to its unique properties. In our experiment, matrix pellets containing theophyllin were made by extrusion/spheronisation method. Microcrystalline cellulose and chitosan with 91% degree of deacetylation in concentrations of 25, 35, 45, 55, 65 and 70% were used as matrix-forming excipients. The influence of chitosan concentration on liberation of drug was observed in media with different pH values. The most prolonged theophyllin release (3 hours) was achieved in phosphate buffer of pH 6.8 and chitosan concentration of 25–35%.
Key words:
chitosan – pellets – sustained release – extrusion/spheronisation
Autoři: L. Janovská; G. Škrabáková; D. Vetchý; M. Rabišková
Působiště autorů: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků
Vyšlo v časopise: Čes. slov. Farm., 2009; 58, 21-27
Kategorie: Původní práce
Souhrn
Chitosan, v posledních letech intenzivně zkoumaný polymer polosyntetického původu, svými vlastnostmi poukazuje na řadu možných použití. Také v technologii léků nachází své uplatnění jako pomocná látka vyznačující se v závislosti na koncentraci pojivými, mukoadhezivními, viskozitu zvyšujícími nebo filmotvornými vlastnostmi. Pelety, sférické násobné lékové formy, umožňují díky svým jedinečným vlastnostem řešit řadu technologických i terapeutických problémů spojených s perorálním podáním léčiv. V našem experimentu jsme použili chitosan spolu s mikrokrystalickou celulosou pro přípravu matricových pelet s theofylinem. Peletizační technikou byla extruze-sferonizace. Sledoval se vliv rozdílné koncentrace chitosanu (25, 35, 45, 55, 65 a 70 %) se stupněm deacetylace 91 % na uvolňování léčivé látky v disolučních prostředích s různou hodnotou pH. Nejpomalejšího uvolňování theofylinu po dobu 3 hodin se dosáhlo ve fosforečnanovém pufru o pH 6,8 při použití chitosanu v koncentraci 25–35 %.
Klíčová slova:
chitosan – pelety – prodloužené uvolňování – extruze/sferonizaceÚvod
O výhodách moderní lékové formy pelety byla publikována celá řada prací. Použití chitosanu v peletách ve funkci látky zpomalující uvolňování léčiva je novou možností přípravy násobné lékové formy s řízeným uvolňováním léčivé látky.
Chitosan je lineární polosyntetický polysacharid složený z jednotek D-glukosaminu (2-amino-2-deoxy-D-glukosa) a N-acetyl-D-glukosaminu (2-acetamido-2-deoxy-D-glukosa) spojených β-1→4 glykosidovými vazbami (obr. 1). Jedná se o bílý nebo béžový prášek, který se získává částečnou deacetylací chitinu. Je dostupný jako báze nebo jako sůl kyseliny chlorovodíkové, jablečné nebo glutamové 1, 2).
Obr. 1. Vzorec chitosanu <sup>3)</sup> 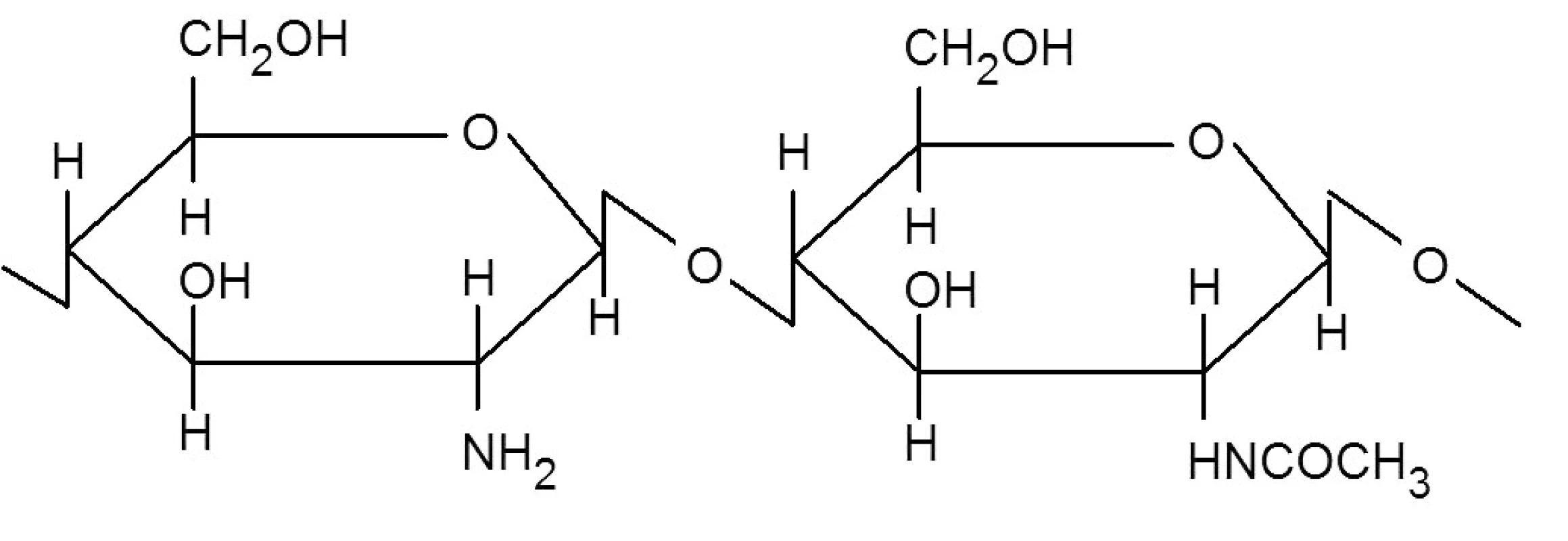
Hlavním zdrojem suroviny jsou schránky korýšů, konkrétně krabů a krevet. Protože surový materiál obsahuje kromě chitinu velké množství proteinů a minerálů, zejména uhličitanu vápenatého, je nutné chitin ještě před samotnou deacetylací izolovat 3, 4, 5).
Chitosan nemá přesně definované složení ani strukturu a jednotlivé typy se liší stupněm deacetylace, molekulovou hmotností, viskozitou roztoků ve zředěných kyselinách a krystalinitou 3, 4, 5).
Stupeň deacetylace (DD = Degree of Deacetylation) se definuje jako procentuální zastoupení primárních aminoskupin ve skeletu polymeru 6). Jelikož deacetylace neprobíhá téměř nikdy kompletně, pohybuje se DD obvykle mezi 70 a 95 %, může však být i jiný. Dosud není, s ohledem na DD, přesně definován rozdíl mezi chitinem a chitosanem, protože se i u chitinu vyskytuje určité procento primárních aminoskupin. U přírodního chitinu se stupeň deacetylace pohybuje kolem 10%. K určení přesného stupně je možné použít některé analytické metody, např. IR spektroskopii, 1H-NMR spektroskopii, gelovou permeační chromatografii a další 6, 7).
Rozpustnost chitosanu ve vodných roztocích je ovlivněna nejen stupněm deacetylace, ale také distribucí zbylých acetylových skupin v molekule, molekulovou hmotností, intramolekulárními interakcemi (vodíkové můstky, hydrofobní charakter acetylových skupin) a pH roztoku. Obecně platí, že je chitosan rozpustný v kyselém prostředí a téměř nerozpustný ve slabě alkalickém prostředí. Chitosany s nízkým DD (přibližně 40 %) jsou rozpustné až do pH 9, zatímco chitosany s vysokým DD (nad 80 %) jsou rozpustné jen do pH 6,5 4).
Molekulová hmotnost se obvykle pohybuje v rozmezí mezi 10 a 1400 kDa a má vliv na míru uvolňování léčivé látky: Čím je molekulová hmotnost vyšší, tím je uvolňování léčiva pomalejší. Pokud však léčivá látka ochotně vstupuje do interakce s aminoskupinami polymeru, je tato závislost opačná: S nižší molekulovou hmotností chitosanu se rychlost uvolňování léčivé látky zpomaluje, protože menší molekuly chitosanu mají přístupnější aminoskupiny vstupující do interakce s léčivou látkou 2, 8).
Důležitou vlastností chitosanu je schopnost tvořit gely při nízkém pH (obr. 2). Při těchto hodnotách pH dochází k protonaci aminoskupiny, vlákna polymeru získávají souhlasný kladný náboj a odpuzují se – polymer bobtná. Viskozita roztoku chitosanu roste se zvyšující se koncentrací polymeru a stupněm deacetylace 4, 7). V alkalickém pH se struktura polymeru nemění, polymer se nerozpouští ani nebobtná.
Obr. 2. Model bobtnání pozitivně nabitého polymeru (např. chitosanu) v závislosti na ionizaci přítomných vazeb při měnících se hodnotách pH <sup>11)</sup> 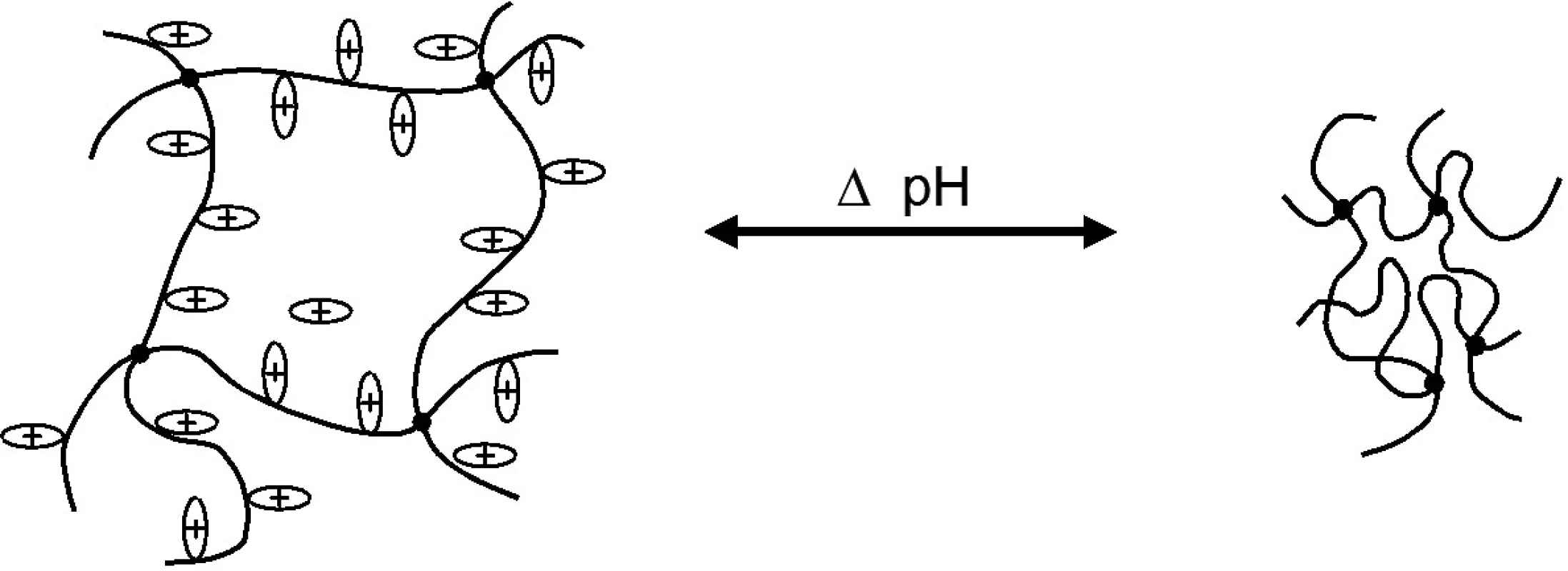
Chitosan má zásaditý charakter, čímž se liší od celulosy, dextranu, pektinu a dalších přírodních polysacharidů, které jsou neutrální nebo kyselé 9, 10). Díky své primární alifatické aminoskupině je tento polymer schopen vstupovat do četných reakcí a tvořit deriváty 5, 7).
Chitosan má řadu cenných biologických vlastností. Vykazuje antibakteriální a antimykotické působení, má hypolipidemické, antioxidační a antikoagulační vlastnosti. Chitosanu je připisována také vlastnost imunostimulační. Velkou výhodou je jeho biokompatibilita. Toxikologické studie prokázaly absenci toxických, dráždivých nebo alergizujících vlastností, což je pro užití v humánní medicíně velice důležité. Toxicita perorálně podané dávky se stanovila na 16 g . kg-1 tělesné váhy 2, 12).
Význam chitosanu je uznáván světovými i národními normami. Byl zařazen do Evropského i Českého lékopisu, kde je uveden ve formě soli s kyselinou chlorovodíkovou 1). Ve farmaceutickém průmyslu má potenciální využití jako rozvolňovadlo, pojivo, látka modifikující uvolňování léčivé látky, urychlovač absorpce, gelotvorná a filmotvorná látka nebo mukoadhezivní polymer a prostředek na hojení ran. Optimalizuje disoluční profily těžce rozpustných léčiv, je možno jej využít také pro formování mikrosfér a mikrotobolek, při formulaci vakcín, systémů s místně specifickým uvolňováním léčivé látky a pro genovou terapii 2, 4).
V literatuře se uvádí, že chitosan vytváří systém hydrofilní gelové matrice. V tom případě je funkce systému se zpomaleným uvolňováním léčivé látky podmíněna tvorbou gelu 9, 13). Chitosan tvoří gel při styku s kyselým vodným prostředím a uvolňování léčiva se pak děje kombinací dvou mechanizmů: pomalou difuzí viskózním gelem a erozí matrice 2). Také v zásaditém prostředí zpomaluje chitosan uvolňování léčivé látky. Mechanismus je však odlišný. Protože se chitosan s vysokým DD v tomto prostředí nerozpouští, vytváří po technologickém zpracování (granulaci, lisování) nerozpustnou matrici, z níž léčivá látka difunduje póry. In vitro liberace léčiva je ve fosforečnanových tlumivých roztocích (pH 6,8 a vyšších) pomalejší než v kyselém prostředí (při pH 1,2), protože chitosan se v kyselém prostředí matrice velice rychle rozpouští 4, 14).
Faktory ovlivňující uvolňování léčivé látky zahrnují vlastnosti léčiva, hlavně jeho rozpustnost, molekulovou hmotnost a náboj; vlastnosti a koncentraci chitosanu – rozhodující jsou stupeň deacetylace, molekulová hmotnost a krystalinita chitosanu, a další faktory, např. pH prostředí, přítomnost další pomocné látky nebo úprava chitosanu zesíťováním 2, 4).
Cílem experimentu bylo připravit matricové pelety s chitosanem ve funkci nosné pomocné látky dobře popsanou metodou extruze-sferonizace. Pro úspěšnou přípravu chitosanových pelet bylo nutné vybrat vhodné procesní parametry (umístění, tloušťku a velikost otvorů extruzní přepážky, rychlost a dobu sferonizace, teplotu a dobu sušení) a formulační parametry (druh a množství vlhčiva). Experiment sledoval vliv koncentrace chitosanu na jakostní parametry připravených pelet, zejména na disoluční profil modelové léčivé látky, kterou byl theofylin.
Pokusná část
Příprava pelet metodou extruze-sferonizace
Pro přípravu pelet se jako modelová léčivá látka použil theofylin (Lehmann & Voss, Německo), jako pomocné látky chitosan (Zhejiang Jiande Biochemical Industry Plant, China), mikrokrystalická celulosa (dále MCC, typ Avicel® PH 101, FMC, USA) a jako vlhčivo 0,25% vodný roztok kyseliny octové. Léčivo a pomocné látky měly lékopisnou kvalitu. Obsah theofylinu byl konstantní, obsah polymerních látek se měnil v různých poměrech a obsah vlhčiva se určil experimentálně. Příprava jednotlivých vzorků probíhala za stejných podmínek ve čtyřech krocích:
1. příprava plastické hmoty:
Prášková směs léčivé a pomocných látek (100 g) se zhomogenizovala ve vysokoobrátkovém mixeru (Tefal Kaleo, Francie) a ve stejném zařízení se postupně vlhčila rychlostí 25 ml/min po dobu 5 minut. Složení jednotlivých vzorků pelet uvádí tabulka 1.
2. extruze:
Vzorky pelet se ze zvlhčené hmoty vyrobily v jednošnekovém extruderu Pharmex 35T (Wyss & Probst Eng., Švýcarsko). Rychlost šneku extruderu byla 110 ot./min, extruzní přepážka tloušťky 1 mm byla umístěna axiálně. Zvolila se přepážka s otvory o průměru 1,25 mm.
3. sferonizace:
Extrudát získaný v předešlém kroku se vložil na rotující talíř sferonizeru Pharmex 35T (Wyss & Probst Eng., Švýcarsko). Talíř se šrafovaným vzorem a průměrem 23 cm měl rychlost 640 ot./min. Doba sferonizace byla 15 minut.
4. sušení:
Získané pelety se sušily v horkovzdušné sušárně Horo (Dr. Ing. Hofman, Německo) při teplotě 60°C po dobu 3 hodin.
Hodnocení pelet
U peletových vzorků se hodnotila velikost částic, její distribuce a k dalšímu hodnocení se použila většinová frakce pelet o průměru částic 1,0–1,25 mm. Z jakostních parametrů se sledovaly: sypná a setřesná hustota, pórovitost (inter - a intrapartikulární), tvar (kulatost), pevnost, oděr a hustota pelet, obsah léčivé látky a její uvolňování z lékové formy disolučním testem.
Velikost pelet se hodnotila sítovou analýzou (přístroj pro sítovou analýzu, Retsch GmbH & Co. KG, Německo) se síty o velikosti ok 0,25; 0,50; 0,80; 1,00; 1,25; 2,00 mm. Z naměřených hodnot se vypočítal střední průměr d podle vztahu:
kde xi udává aritmetický průměr velikosti ok horního a dolního síta (mm) a di je hmotnostní zastoupení částic stejné velikosti i ve vzorku (%) 15).
Sypná a setřesná hustota se určila v přístroji ERWEKA (typ SVM 102, ERWEKA GmbH, Německo), počet sklepnutí byl 1250 16). Z hodnot setřesné (ρ1250) a sypné (ρ) hustoty se vypočetl Hausnerův poměr (HR) dle vzorce:
Kulatost pelet S, jako parametr tvaru částic, se vypočítala z povrchu A (mm2) a obvodu p (mm) stanoveného obrazovou analýzou 100 ks pelet (Leco IA 32, Leco Instruments, USA) podle vzorce 17, 18):
Pevnost pelet se měřila v čelisťovém přístroji (C5 Pellet Hardness and Compression Tester, Engineering System, Nottingham, Velká Británie). Zjišťovala se hodnota destrukční síly, která jednotlivé pelety rozdrtila (N). Hodnotilo se 10 ks pelet, zaznamenala se průměrná pevnost se směrodatnou odchylkou 19).
Mechanická odolnost pelet v oděru se stanovila v přístroji ERWEKA (typ TAR 10, ERWEKA GmbH, Německo) s upraveným bubínkem z nerezové oceli z důvodu vyloučení ovlivnění výsledků zkoušky statickou elektřinou. Hodnotilo se 10,0 g pelet zbavených prachových částic, přesně odvážených, spolu s 25 skleněnými kuličkami o průměru 4 mm po dobu 10 minut při 20 ot./min. Za oděr se považovaly částice menší než 250 μm. Hodnota oděru, hmotnostního úbytku, se vyjádřila v % 19).
Hustota pelet se měřila heliovým pyknometrem (Pycnomatic – ATC, Porotec GmbH., Německo). Objem vzorku o známé hmotnosti se stanovil po naplnění nádobky pyknometru plynem pod tlakem podle vzorce:
kde Vp je objem vzorku, Vc je objem nádobky, Vr srovnávací objem, Pi je počáteční tlak, Pr je srovnávací tlak a Pf je konečný tlak 1). Hustota pelet ρp (g.cm-3) je dána rovnicí:
mp je hmotnost pelet v pyknometru (g), Vp je objem pelet v pyknometru (cm3). Výsledky byly průměrem pěti stanovení.
Vnitřní pórovitost (intrapartikulární, pórovitost jednotlivých pelet – volný prostor vyplněný vzduchem uvnitř pelety) se vypočetla z hustoty pelet a pravé hustoty práškových směsí podle vzorce 20):
kde Pintraje intrapartikulární pórovitost, ρt je hustota práškové směsi (g.cm-3) a ρp je hustota pelet (g.cm-3). Hustota práškové směsi se stanovila heliovým pyknometrem shodným postupem jako při stanovení hustoty pelet. Výsledky hustoty práškové směsi byly průměrem pěti stanovení.
Interpartikulární pórovitost (pórovitost pelet jako soustavy) se určila podle vzorce 21):
kde Pinter je interpartikulární pórovitost, ρp je hustota pelet (g.cm-3) a ρ0 je sypná hustota (g.cm-3).
Ke stanovení obsahu theofylinu se použily rozdrcené pelety, vzorek se 24 hodin míchal v čištěné vodě a po filtraci se množství rozpuštěného léčiva hodnotilo spektrofotometricky (spektrofotometr – UV/VIS, Perkin Elmer Instruments, USA) při vlnové délce 273 nm.
Zkouškou disoluce se stanovilo množství uvolněné léčivé látky z pelet v předepsané kapalině v definovaném čase. Disoluce se prováděla míchadlovou metodou v přístroji Sotax AT 7 Smart on-line (Donaulab, Švýcarsko). Disolučním prostředím byly umělá žaludeční šťáva (pH 1,2) a fosforečnanový tlumivý roztok (pH 6,8, 1000 ml, 37 °C); míchadla se otáčela rychlostí 50 ot./min. Odběr disoluční tekutiny se prováděl v 30minutových intervalech po dobu 180 minut, uvolněné množství léčiva se měřilo spektrofotometricky při vlnové délce 273 nm.
VÝSLEDKY A DISKUZE
Cílem práce byla formulace matricových pelet metodou extruze-sferonizace, optimalizace přípravy jednotlivých vzorků a hodnocení jejich vlastností. Za úspěšné se považovaly pokusy, kterými se podařilo připravit kulaté pelety s většinovým zastoupením pelet v požadované velikostní frakci 1,0–1,25 mm. Záměrem experimentu bylo také zjistit nejvyšší koncentraci chitosanu, při které je ještě možno připravit pelety s theofylinem. Pelety s koncentrací 75 % chitosanu se připravit nepodařilo z důvodu příliš malého množství MCC, která slouží jako látka podporující sferonizaci 18). MCC přítomná v práškové směsi v 5% koncentraci nestačila pro vznik kulatých a pevných pelet.
Porovnáním připravených vzorků pelet se získala závislost množství potřebného vlhčiva na obsahu chitosanu (tab. 1). Zjistilo se, že s rostoucím obsahem chitosanu je zapotřebí menšího množství vlhčiva. Příčinu je možno vidět v rozdílných rozpustnostech mikrokrystalické celulosy a chitosanu. Mikrokrystalická celulosa je ve zředěných kyselinách prakticky nerozpustná, naopak chitosan se v kyselém prostředí rozpouští. Potenciometricky se zjistilo, že pH zvoleného vlhčiva bylo 2,98.
Tab. 1. Složení pelet a množství vlhčiva 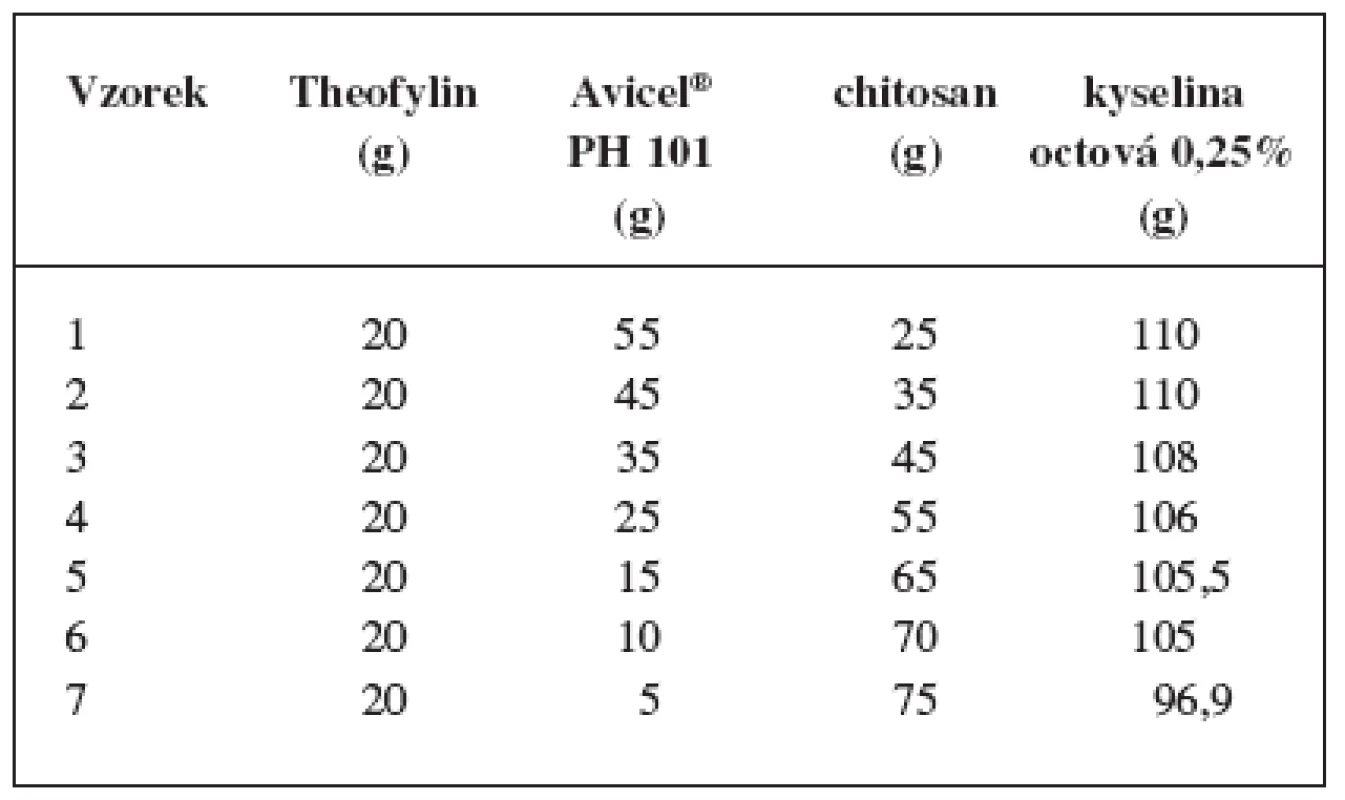
Jedním z cílů pokusné části bylo získat pelety s většinovým zastoupením ve velikostní frakci 1,00–1,25 mm. Tabulka 2 shrnuje získané výsledky: největší výtěžek pelet se získal u vzorku 3 (64,83 %), nejmenší u vzorku 6 (28,0 %). Pelety vzorku 6 bylo poměrně obtížné připravit z důvodu nízké koncentrace MCC, která je v procesu extruze-sferonizace nezbytnou pomocnou látkou. Částice měly rozbrázděný povrch a při procesu vznikalo větší množství malých částic. Celkově lze říci, že vzorky 1–3 měly srovnatelnou distribuci velikosti pelet; počínaje vzorkem 4 se výtěžek požadované frakce pelet snižoval a u vzorků 5 a 6 se distribuce velikosti částic rozšířila, tj., vykazovala vyšší podíly jak větších, tak i menších částic. To se projevilo i v hodnotách středního průměru pelet. Získané výsledky jsou v souladu s našimi předchozími pokusy 18), které ukázaly koncentraci MCC nad 30 % optimální pro vznik pravidelných a sférických pelet.
Tab. 2. Velikosti pelet, jejich distribuce a hodnoty středního průměru pelet 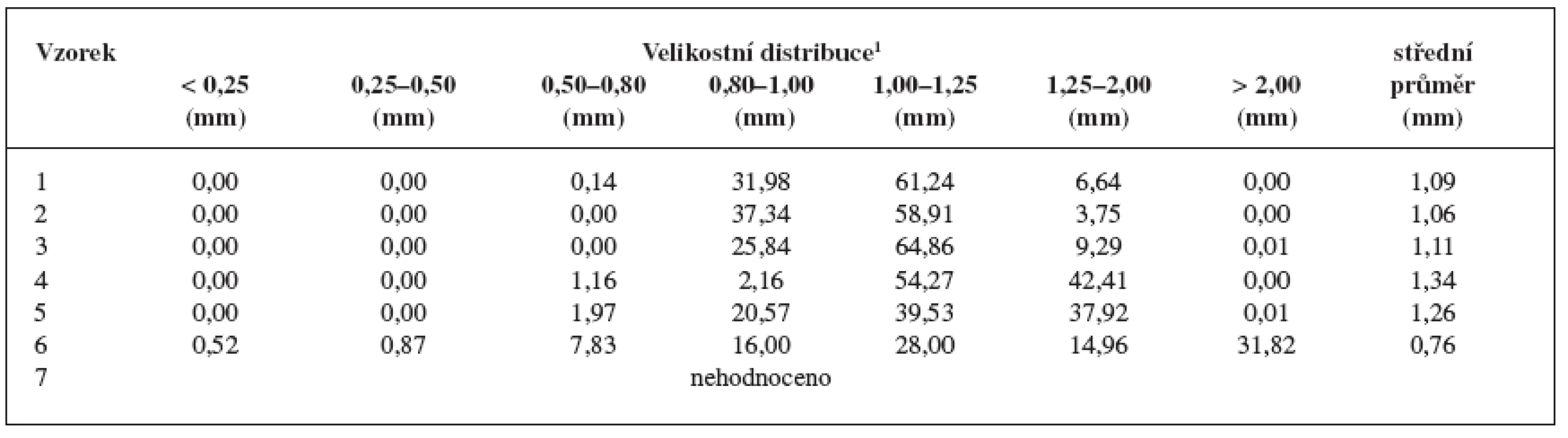
1 Jednotlivé velikostní frakce jsou uvedeny v hmotnostních procentech. Připravené pelety měly velmi nízké hodnoty Hausnerova poměru (1,03–1,09) (tab. 3). Vzhledem k tomu, že jsou hodnoty Hausnerova poměru lékopisně akceptovatelnými mezemi toku prášků jako souboru částic 16) a HR do 1,11 je přiřazen práškům s výborným tokem, lze také peletám připsat výborné tokové vlastnosti. Interpartikulární pórovitost byla u všech vzorků podobná: nejvyšší u vzorku 1 (45,73 %) a nejmenší u vzorku 3 (41,65 %). Výsledné hodnoty se nacházejí v rozpětí pórovitosti 26–48 % stanoveném pro kulovité částice se stejným průměrem. Hodnota kulatosti pelet vzorků 1–5 přesáhla hodnotu 0,88, což svědčí o stejnoměrném, sférickém tvaru částic 22). Výjimkou byly pelety vzorku č. 6 (hodnota kulatosti 0,7911), u kterých hodnocený parametr poukazuje na nevhodný tvar. To dokládá obrázek 3, ze kterého je patrný také hrubý povrch pelet.
Tab. 3. Stanovení sypné a setřesné hustoty, interpartikulární pórovitosti, Hausnerova poměru a kulatosti 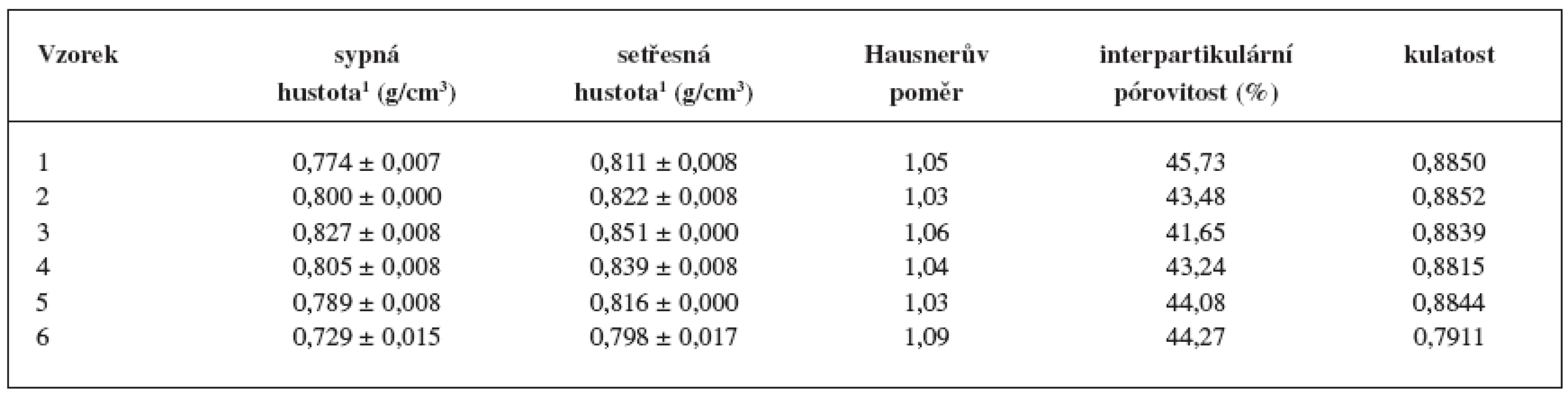
1 Hodnota je výsledkem 3 měření. U připravených pelet se změřila pevnost a oděr (tab.4). Zjistilo se, že pevnost pelet nevýznamně rostla do koncentrace chitosanu 55 % (vzorky 1–4) a poté poklesla na hodnotu 14,08 a 14,33 N. Oděr byl u všech vzorků srovnatelný a nepřesáhl hodnotu 0,1 %, pouze u nejvyšší koncentrace chitosanu (vzorek 6) byl výrazně vyšší (1,57 %), pravděpodobně z důvodu přítomnosti jemných částic na povrchu pelet, které se v průběhu zkoušky oddělily. Oděr pelet do 1,7 % je považován za přijatelný pro další manipulaci, tj. obalování, plnění a transport 23). Srovnatelné hodnoty pevnosti a oděru u vzorků 1–4 jsou v souladu s tvrzením o potřebné minimální koncentraci MCC a jejím pozitivním vlivu při formování pelet 18). Celkově výsledky svědčí o dobré mechanické odolnosti pelet, které lze obalovat, případně s nimi jinak manipulovat, aniž by došlo k jejich poškození.
Tab. 4. Stanovení mechanických vlastností, hustot a obsahu theofylinu 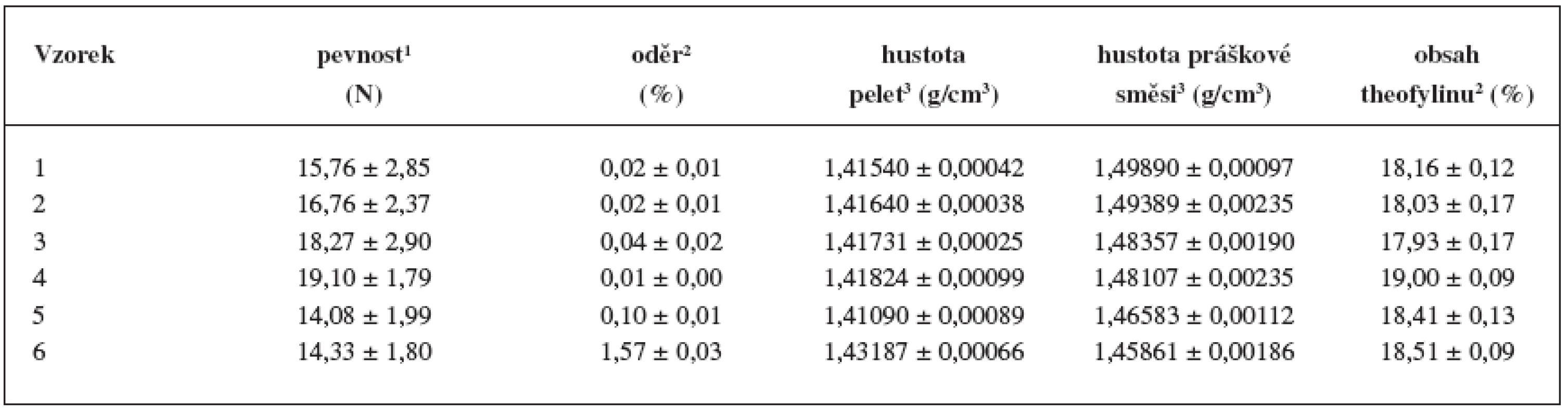
1 Hodnota je výsledkem 10 měření. 2 Hodnota je výsledkem 3 měření. 3 Hodnota je výsledkem 5 měření. Obsah theofylinu se u jednotlivých vzorků příliš nelišil (17,93–19,00 %), jeho nižší hodnota oproti teoretickému předpokladu (20,00 %) byla pravděpodobně způsobena zbytkovou vlhkostí pelet.
Porovnáním hustot zkoušených vzorků (tab. 4) se zjistilo, že hustota pelet se vzrůstající koncentrací chitosanu roste, zatímco hustota jejich odpovídajících práškových směsí klesá. Intrapartikulární (vnitřní) pórovitost pelet (obr. 4) dosáhla maximální hodnoty 5,57 % u vzorku 1, poté postupně klesala až ke vzorku 6 (1,87 %). Vznik pelet s menší vnitřní pórovitostí a vyšší hustotou souvisí se stoupající koncentrací chitosanu (rozpustného v použitém vlhčivu) v plastické hmotě pro extruzi. Čím větší podíl plastické hmoty se rozpouští, tím méně pórů se tvoří během vzniku pelet.
Obr. 4. Intrapartikulární pórovitost 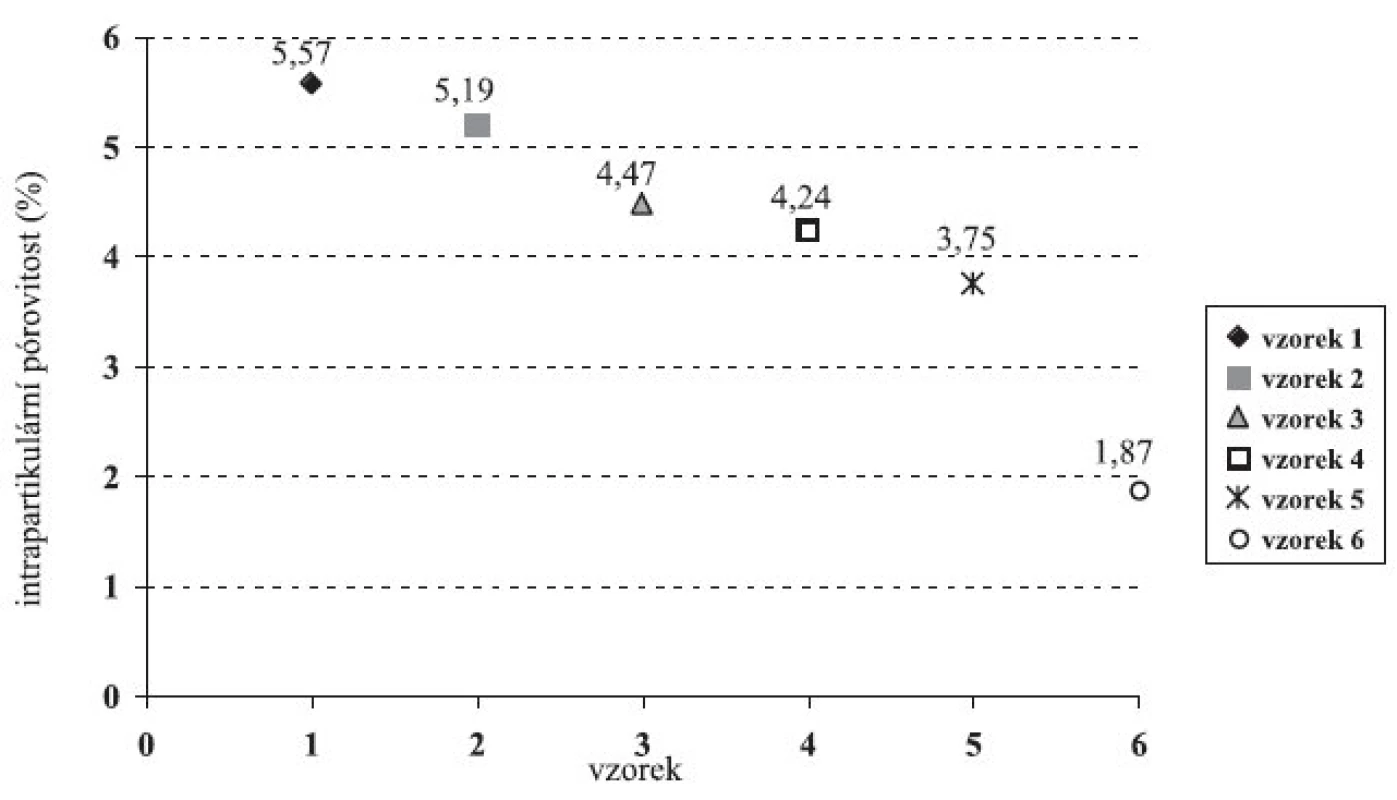
Zkouškou disoluce se určily disoluční profily pelet. Cílem práce bylo zjistit, za jakých podmínek se chitosan chová jako látka řídící uvolňování léčiva. Z disolučních profilů námi připravených pelet vyplývá, že u všech šarží pelet došlo v prostředí fosforečnanového tlumivého roztoku k uvolnění veškeré léčivé látky do tří hodin (tab.5). V zásaditém prostředí se nemohl vytvořit systém hydrofilní gelové matrice, léčivá látka se uvolňovala z nerozpustné polymerové (skeletové) matrice 24). Tuto matrici vytvořila nerozpustná mikrokrystalická celulosa spolu s částečně rozpuštěným chitosanem během výroby pelet. Protože s klesajícím množstvím použitého vlhčiva a s rostoucí koncentrací chitosanu se zvyšovala rychlost uvolňování léčivé látky, nepůsobil nerozpuštěný chitosan jako látka řídící uvolňování.
Tab. 5. Disoluční profily pelet v prostředí tlumivého roztoku o pH 6,8 (fosforečnanový tlumivý roztok) 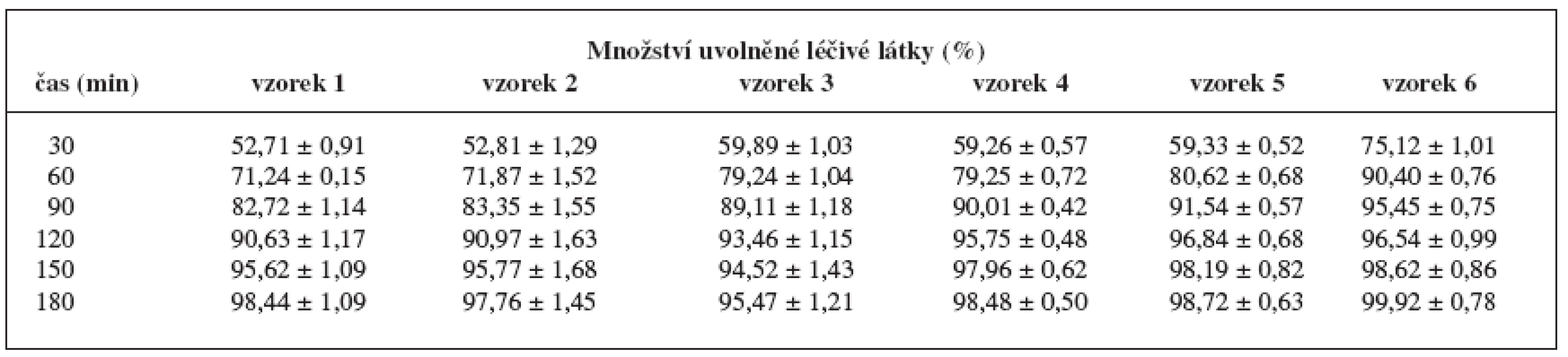
V prostředí umělé žaludeční šťávy se veškerý theofylin uvolnil do dvou hodin (tab. 6). V kyselém prostředí jsou sice vhodné podmínky pro tvorbu hydrofilní gelové matrice, avšak v prostředí umělé žaludeční šťávy s pH 1,2 se chitosan rozpouští příliš rychle, gelová vrstva se nestihne vytvořit a léčivá látka se proto uvolní. Přispívá k tomu i velký povrch pelet a jejich malá velikost.
Tab. 6. Disoluční profily pelet v prostředí umělé žaludeční šťávy o pH 1,2 
ZÁVĚR
Metodou extruze/sferonizace se připravily pelety s chitosanem o koncentraci 25–65 %. Připravené pelety vykazovaly dobré mechanické a tokové vlastnosti, což je předurčuje k optimalizaci disolučního profilu léčiva vhodným obalem. Samotnou matricí tvořenou MCC a částečně rozpuštěným chitosanem se pro velký povrch pelet podařilo prodloužit uvolňování léčiva po dobu 3hodin.
Tato práce byla realizovaná za finanční podpory grantu IGA VFU Brno 74/2007/FaF.
Došlo 8. ledna 2009 / Přijato 20. ledna 2009
Adresa pro korespondenci:
PharmDr. Lucie Janovská
Ústav technologie léků FaF VFU
Palackého 1/3, 612 42 Brno
e-mail: l.janovska@seznam.cz
Zdroje
1. Kolektiv autorů: Český lékopis 2002. Praha: Grada Publishing 2002; 460–462, 1934–1936.
2. Säkkinen, M.: Academic Dissertation, University of Helsinki 2003; 3–8.
3. www.unige.ch/sciences/pharm/fagal/of-these.htm., 10. 1. 2007
4. Illum, L.: Pharm. Res., 1998; 15(9), 1326–1331.
5. Kumar, M. N. V. R.: React. Funct. Polym., 2002; 46, 1–27.
6. Säkkinen, M., Seppälä, U., Henänen, P. et al.: Eur. J. Pharm. Biopharm., 2002; 54, 33–40.
7. Rinaudo, M.: Prog. Polym. Sci., 2006; 31, 603–632.
8. Sabnis, S., Block, L. H.: Int. J. Biol. Macromol., 2000; 27, 181–186.
9. Bajerová, M., Gajdziok, J., Dvořáčková, K. et al.: Čes. slov. Farm., 2008; 57, 63–69.
10. Kollár, P., Suchý, P., Muselík, J. et al.: Čes. slov. Farm., 2008; 57, 11–16.
11. Lowman, A. M., Peppas, N. A.: In: Encyclopedia of controlled drug delivery, Mathowitz E., Volume 1, 1999, s. 397–415.
12. Dodane, V., Vilivalam ,V. D.: Pharm. Sci. Tech. To., 1998; 4 (6), 246–253.
13. Masteiková, R., Chalupová, Z., Šklubalová, Z.: Medicina, 2003; 39 (Suppl. 2), 19–24.
14. Chandy, T., Sharma, Ch. P.: Biomaterials, 1993; 14 (12), 939–944.
15. Haznos, L., Langer, I., Gyamathy, M.: Drug Dev. Ind. Pharm., 1992; 18, 409–412.
16. Kolektiv autorů: Český lékopis 2005, Doplněk 2006. Praha: Grada Publishing 2006; 3361–3362.
17. Sienkiewicz, G., Pereira, R., Rudnic, E. M.: Drug Dev. Ind. Pharm., 1997; 23, 173–177.
18. Rabišková, M., Häring, A., Minczingerová, K. et al.: Chem. Listy, 2007; 101, 70–77.
19. Krejčová, K., Rabišková, M., Vetchý, D. et al.: Drug Dev. Ind. Pharm., 2006; 32, 585–593.
20. El Saleh, F., Kleinebudde, P.: Pharm. Tech. Europe, 1998; 10, 18–22.
21. Rodrigues, E. C., Torrado, J. J., Nikolakakis, I. et al.: Drug Dev. Ind. Pharm., 2001; 27, 847–855.
22. Sienkiewicz, G., Pereira, R., Rudnic, E. M. et al.: Drug Dev. Ind. Pharm., 1997; 23, 173–182.
23. Vertommen J., Kinget R.: Drug Dev. Ind. Pharm., 1997; 23, 39–46.
24. Robinson, J. R., Lee, V. H.: In: Controlled Drug Delivery. New York and Basel: Marcel Dekker 1987; 388–396.
Štítky
Farmacie Farmakologie
Článek Hodnocení oděru peletČlánek NOVÉ KNIHY
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2009 Číslo 1- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
-
Všechny články tohoto čísla
- Studium vlastností výlisků z přímo lisovatelné fruktosy
- Pelety s obsahem chitosanu připravené metodou extruze-sferonizace
- Farmakoterapie kardiovaskulárních chorob u populace v České republice
- Časopis Česká a slovenská farmacie při vstupu do roku 2009
- Pokroky v lékových formách pracovní den sekce technologie léků České farmaceutické společnosti ČLS JEP
- Ze zasedání Výboru České farmaceutické společnosti
- Standardní receptura pro přípravu léčivých přípravků v lékárnách II. Náměty k inovaci a sjednocení receptury dalších přípravků k ošetření kůže
- Životní výročí prof. RNDr. PhMr. Karla Paláta, CSc.
- NOVÉ KNIHY
- Hodnocení oděru pelet
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Standardní receptura pro přípravu léčivých přípravků v lékárnách II. Náměty k inovaci a sjednocení receptury dalších přípravků k ošetření kůže
- Farmakoterapie kardiovaskulárních chorob u populace v České republice
- Pelety s obsahem chitosanu připravené metodou extruze-sferonizace
- Hodnocení oděru pelet
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Současné možnosti léčby obezity
nový kurzAutoři: MUDr. Martin Hrubý
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání











