-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaInterakcia 1,4-dihydropyridínov s iónovými kanálmi
Interaction of 1,4-dihydropyridines with ion channels
The pharmacology of dihydropyridines in the cardiovascular system is widely known and the effects on L-type channels are well researched. There is far less information about the action of dihydropyridines on other classes of voltage-gated calcium channels. This article aims to bring more information about dihydropyridine derivates action on voltage-gated calcium channels or on Na⁺ a K⁺channels.
Key words:
Ca²⁺ channels – N-channel blockers – T-channel blockers – 1,4-dihydropyridines
Autoři: L. Veizerová; J. Světlík; V. Kettmann
Působiště autorů: Univerzita Komenského, Farmaceutická fakulta, Katedra farmaceutickej analýzy a nukleárnej farmácie, Bratislava
Vyšlo v časopise: Čes. slov. Farm., 2008; 57, 58-62
Kategorie: Přehledy a odborná sdělení
Souhrn
Farmakológia dihydropyridínov v oblasti kardiovaskulárneho systému je podrobne prebádaná a účinky na Ca²⁺ kanál L-typu sú dobre zmapované a detailne spracované. Menej známych údajov existuje o pôsobení dihydropyridínov na ďalších typoch vápnikových kanálov. Cieľom tohto článku je priniesť informácie o pôsobení dihydropyridínových derivátov na iné typy napäťovo riadených vápnikových kanálov a tiež na Na⁺ a K⁺ kanály.
Kľúčové slová:
Ca²⁺ kanály – blokátory N-kanálov – blokátory T-kanálov – 1,4-dihydropyridínyNapäťovo riadené vápnikové kanály sú zodpovedné za spriahnutie elektrického signálu na povrchu buniek s fyziologickými dejmi vo vnútri buniek 1). Tento typ kanálov reaguje na zmenu membránového potenciálu a je otváraný depolarizáciou bunkovej membrány 2).
1,4-dihydropyridíny predstavujú jednu z hlavných skupín blokátorov vápnikových kanálov, ktorá okrem nifedipínu zahŕňa veľké množstvo zlúčenín druhej a tretej generácie. Tieto zlúčeniny sú využívané v klinickej praxi pri terapii chorôb kardiovaskulárneho systému, ako napr. hypertenzia a angína pectoris. Ich účinok spočíva v inhibícii L-typu napäťovo riadených vápnikových kanálov v srdci a v hladkej svalovine ciev. L-typ napäťovo riadených vápnikových kanálov je však len jedným podtypom veľkej skupiny, ktorú na základe funkčných a farmakologických charakteristík rozdeľujeme do viacerých tried (L, T, P/Q a R-typ) 3, 4). Vápnikové kanály sú ďalej súčasťou veľkej skupiny napäťovo riadených kanálov, zahrňujúcej sodíkové a draslíkové kanály zdieľajúce štruktúrnu a funkčnú homológiu 5, 6).
Keďže účinky 1,4-dihydropyridínov na L-typ vápnikových kanáloch sú známe a detailne spracované, výskum sa v súčasnosti orientuje na hľadanie a aplikáciu 1,4-dihydropyridínových zlúčenín aktívnych na inom ako L-type vápnikových kanálov.
Účinok 1,4-dihydropyridínov na T-typ kanály
Nízkovoltážne napäťovo riadené vápnikové kanály T typu (transient channel), aktivované malou depolarizáciou buniek, sú prítomné v kardiovaskulárnom, neuronálnom a endokrinnom systéme 7). Sprostredkúvajú dôležité procesy v excitabilných a neexcitabilných bunkách ako napríklad rast neuritov, reguláciu srdcovej pacemakerovej aktivity, fertilizáciu, reguláciu krvného tlaku a transmisiu signálov bolesti 8, 9). Ich zlá funkcia je príčinou viacerých porúch ako napr. absenčná epilepsia v detstve a autistické poruchy 10, 11). V súčasnosti sa dostávajú do pozornosti ako nové terapeutické ciele v liečbe rôznych kardiovaskulárnych ochorení (arytmia, zlyhanie srdca) alebo neuronálnych porúch (epilepsia, bolesť). Inhibícia T-kanálov taktiež môže viesť k dlhodobej ochrane orgánov zlepšením lokálnej mikrocirkulácie a redukciou vedľajších hormonálnych efektov 7).
Okrem 1,4-dihydropyridínov existuje veľké množstvo zlúčenín, ktoré blokujú T-typ kanály in situ. Patria sem divalentné a trivalentné katióny, najmä Ni2+ a Cd2+, malé peptidy (ω-agatoxín IIIA), deriváty sukcínimidu (ethosuximid), deriváty difenylbutylpiperidínu (penfluridol), anestetiká (isoflurane), barbituráty (pentobarbital), benzodiazepíny, fenylalkylamíny (verapamil), pyrazínové diuretikum amilorid, tetrazolový derivát mibefradil a sulfónamidový derivát zonisamid 12). Žiadna z týchto zlúčenín však nie je absolútne selektívna pre diskutovaný T-typ a väčšina z nich ovplyvňuje aj iné iónové kanály a transportéry.
Účinok 1,4-dihydropyridínov na T-typ kanálov bol skúmaný v mnohých štúdiách 13). 1,4-dihydropyridínové inhibítory vápnikových kanálov pôsobiace na L kanály väčšinou neinhibujú T-kanály okrem niektorých dihydropyridínov majúcich duálne inhibičné vlastnosti na L - aj T-kanáloch 14). Efonidipín (I) je antihypertenzívna a antianginózna látka s dihydropyridínovou štruktúrou, ktorá inhibuje L i T kanály.
Blokáda T-kanálov je zodpovedná za jeho lepší klinický profil, t.j. minimálnu reflexnú tachykardiu a renálnu protekciu. Efonidipín má v porovnaní s ostatnými dihydropyridínovými zlúčeninami objemný bočný reťazec v polohách C3 a C5 dihydropyridínového kruhu. V polohe C5 je fosfátová skupina na rozdiel od karboxymetylesterového bočného reťazca prítomného vo väčšine dihydropyridínových vápnikových blokátorov. Bolo dokázané, že fosfátová skupina v C5 je dôležitá pre charakteristický farmakologický profil efonidipínu, t.j. inhibíciu T-kanálov, predĺženie plateau sinoatriálneho akčného potenciálu a vysokú negatívnu chronotropnú potenciu 15, 16).
Niektoré dihydropyridíny využívané v klinickej praxi majú chirálne centrum na C4 atóme dihydropyridínového kruhu, ktorého konfigurácia môže týmto ovplyvniť farmakologické vlastnosti zlúčeniny. Furukawa et al. 17) nedávno na rekombinantných T kanáloch exprimovaných v Xenopus oocytes dokázali, že R(-)enantiomér efonidipínu selektívne inhibuje T kanály, zatiaľ čo racemát efonidipínu nevykazuje antagonistickú aktivitu voči N, P a Q typu. Tanaka et al.18) neskôr dokázali inhibíciu T-kanálov aj v natívnom myokarde guinejského morčaťa a zistili, že blokáda L kanálu efonidipínom môže byť priradená S(+)enantioméru. R(-)efonidipín sa teda zdá byť špecifickým inhibítorom T-typu vápnikových kanálov, čo by mohlo byť využité v ich ďalších štúdiách a pri vývoji efektívnejších a bezpečnejších liečiv 7).
Ďalšou významnou skupinou vykazujúcou inhibičné účinky na T-type vápnikových kanáloch sú nové 1,4 dihydropyridíny obsahujúce 2,6-disubstituované fenylové skupiny s pentadecylovou skupinou v polohe 6 benzénového jadra, ktoré sa vyznačujú významnou T : L selektivitou 19). Napr. PPK 5 (II) je 40 násobne selektívnejší voči T-kanálom.
Predpokladá sa, že aromatické časti slúžia na včlenenie zlúčeniny do kanálového proteínu, zatiaľ čo dlhý pentadecylový reťazec je zodpovedný za inhibičný efekt (fyzikálna inhibícia iónového prúdenia). Dialkyl 1,4-dihydro-4-(2’alkoxy-6’-pentadecylphenyl)-2,6--dimetyl-3,5-pyridín dikarboxyláty tak môžu byť vhodnými kandidátmi pre vývoj špecifických blokátorov T-kanálov a môžu prispieť k vývoju nových terapeutík na liečbu ochorení ako napr. epilepsia 20).
Účinok 1,4-dihydropyridínov na N-typ kanály
N-typ (neuronálne) kanály patria do skupiny vysokovoltážnych napäťovo riadených vápnikových kanálov, ktorých výskyt je rozšírený v sympatických nervových zakončeniach. Ich funkcia úzko súvisí s neuroprotekciou a neuropatickou bolesťou 21, 22). Viaceré štúdie na zvieracích modeloch dokázali, že blokádou týchto kanálov možu byť potlačené patologické procesy pri poraneniach mozgu a následnej ischémii 23, 24). Medzi selektívne blokátory N-typu kanálov nedihydropyridínového typu patria malé peptidické zlúčeniny ω-conotoxín GVIA, MVIIC, CVID (v klinickom výskume v Austrálii), MVIIA a jeho syntetická verzia Ziconotid 25). N-kanály sú tiež účinne blokované derivátmi difenylbutylpiperidínov, najmä piperidínovými derivátmi s orálnou analgetickou aktivitou 26), ďalej molekulami s dlhým alkylovým reťazcom (farnesol) 27) a zlúčeninou PD173212 (vyrobená spojením N,N disubstituovaného leucínu a tyrozínamínu) 26).
Skoršie štúdie skúmajúce účinok 1,4-dihydropyridínov na N-typ kanáloch potvrdili, že tieto látky sa vyznačujú veľmi malou alebo žiadnou selektivitou voči tomuto typu kanálov 28–30). V komparatívnej analýze účinku desiatich 1,4-dihydropyridínov (amlodipín, benidipín, nifedipín, nitrendipín, manidipín, nimodipín, nisoldipín, nilvadipín, nikardipín a cilnidipín) (obr. 1) na kardiálne L - a sympatické neuronálne N-kanály iba cilnidipín vykazuje určitý druh selektivity voči N-typu 31).
Obr. 1. 1,4-dihydropyridínové blokátory vápnikových kanálov 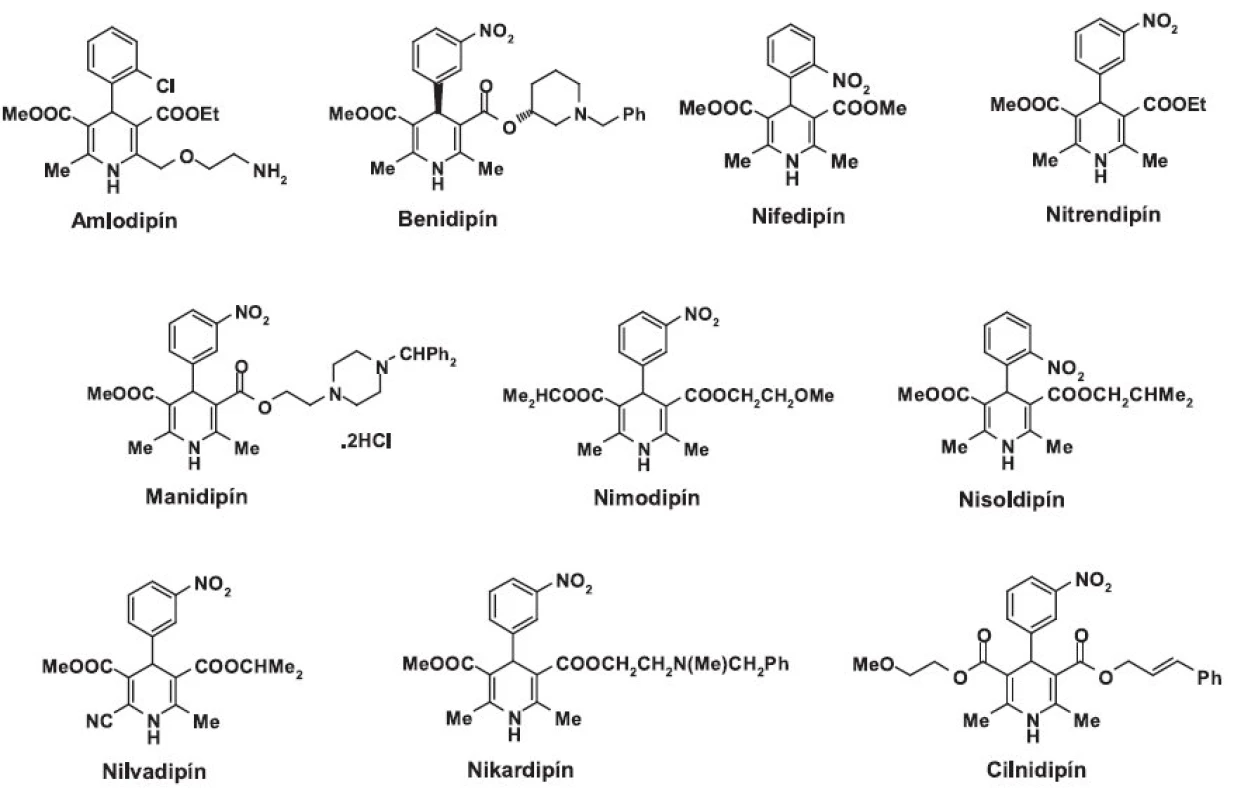

Cilnidipín, duálny blokátor L/N-kanálov, je bežne požívaný na liečbu esenciálnej hypertenzie. Okrem kardiovaskulárneho pôsobenia vykazuje aj neuroprotektívne a analgetické účinky, ktoré vyplývajú z inhibície N-kanálov 32). Cilnidipín predstavuje primárnu molekulu pri vývoji selektívnejších a účinnejších antagonistov N typu vápnikových kanálov. Bolo dokázané, že jeho karboxylový derivát APJ 2708 (III) s analgetickým účinkom in vivo vykazuje v porovnaní s cilnidipínom rovnakú aktivitu voči N-kanálom, ale menšiu aktivitu voči L-kanálom 21).
Obmieňanie 1,4-dihydropyridínu APJ 2708 v polohách 4,5 a 6 viedlo k objaveniu nových blokátorov N kanálov, ktoré sa prejavujú v menšej miere účinkami na kardiovaskulárny systém ako cilnidipín a APJ 2708. Najsľubnejším z nich je 5-(3,3-difenylpropylester) kyseliny 4-(3-chlorofenyl)-2-metyl-6-trifluorometyl-1,4--dihydropyridín-3,5 dikarboxylovej (IV), ktorý má ekvipotentnú aktivitu voči N-kanálom a 1600× nižšiu aktivitu voči L-kanálom ako cilnidipín. Vykazuje rovnakú orálnu analgetickú aktivitu ako cilnidipín 21).
5-(3,3-difenylpropylester) kyseliny 4-(3-chlorofenyl)-2-metyl-6- -trifluorometyl-1,4-dihydropyridín-3,5 dikarboxylovej 
N-kanály sú potenciálnou cieľovou skupinou pre vývoj analgetík. Inhibítory N-kanálov teda predstavujú dôležitú skupinu látok, ktorá može byť využitá pri terapii neuropatickej bolesti. Na ich vývoji sa v súčasnosti intenzívne pracuje 32a).
Účinok 1,4-dihydropyridínov na iné typy napäťovo riadených vápnikových kanálov
V súčasnosti nie sú známe deriváty dihydropyridínov, ktoré by blokovali P/Q - a R-typ kanálov. Jediným doposiaľ známym selektívnym blokátorom P/Q-kanálov je peptidická zlúčenina ω-agatoxín IVA pozostávajúca zo 48 aminokyselín izolovaná z pavučiny pavúka Agenelopsis aperta 33). Za selektívny inhibítor R-kanálov bol spočiatku považovaný toxín SNX-482 izolovaný z jedu tarantule Hysterocrates gigas34). Neskoršie štúdie však dokázali, že táto zlúčenina inhibuje aj L-typ vápnikové kanály 35).
Účinok 1,4-dihydropyridínov na draslíkových napäťovo riadených kanáloch
Draslíkové kanály predstavujú veľkú štrukturálne a funkčne rôznorodú skupinu. Ich farmakológia je veľmi komplexná. 1,4 dihydropyridíny vykazujú aktivitu voči viacerým podskupinám draslíkových kanálov. Najviac preskúmanou skupinou je skupina dihydropyridínov pôsobiacich na vápnikom aktivované K+ kanály, pre ktorú je známy vzťah štruktúry a účinku, pričom aktivita je pozorovaná už na submikromolárnej úrovni 36). Ellory dokázal, že ním študovaná skupina 1,4-dihydropyridínov je účinnejšia na Ca2+ aktivovaných K+ kanáloch v ľudských erytrocytoch ako na L-kanáloch v hladkom svale 37). Ďalej bolo dokázané, že niguldipín, v praxi používaný ako vazorelaxans, vykazuje antagonistické účinky na L-type Ca2+ kanáloch a agonistické účinky na Ca2+ aktivovaných K+ kanáloch 38). Aktivita na draslíkových kanáloch je stereoselektívna, to znamená, že (+)-enantiomér funguje ako agonista, zatiaľ čo (-) enantiomér ako antagonista.
Zvlášť zaujímavou je skupina 1,4-dihydropyridínov s agonistickým účinkom na ATP-senzitívnych draslíkových kanáloch. Aktivátory draslíkových kanálov predstavujú nové a užitočné liečivá pre terapiu inkontinencie moču 39). Zlúčenina ZM 244085 (V) je účinnejšia na tomto type kanálov ako na L-type vápnikových kanáloch v hladkom svale 40). Hybridy 1,4 dihydropyridínového jadra a pinacidilu podobnej jednotke tiež vykazujú Ca2+ antagonistické vlastnosti a K+ATP aktivačné vlastnosti 41).
Účinok 1,4-dihydropyridínov na sodíkových kanáloch
Viacero skorších štúdií dokázalo, že 1,4-dihydropyridíny možu blokovať napäťovo riadené Na+ kanály 42). Yatani a Brown zistili, že nitrendipín interaguje s napäťovo riadenými Na+ kanálmi v srdcovom svale potkana. Interakcia podobná pre L-typ Ca2+ kanálov v srdci sa však deje s 1000× menšou účinnosťou 43).
Zaujímavou dihydropyridínovou zlúčeninou je PD 122860 (VI) vyznačujúci sa duálnym účinkom. Vedľa antagonistického účinku na Ca2+ kanáloch pôsobí aj ako aktivátor na Na+ kanáloch. Zatiaľ čo oba enantioméry tejto zlúčeniny sú aktivátormi sodíkových kanálov, za antagonistický účinok na vápnikových kanáloch je zodpovedný (+)-enantiomér tejto zlúčeniny 44).
Záver
V súčasnosti disponujeme poznatkami, ktoré dokazujú, že účinok 1,4-dihydropyridínov nie je obmedzený len na L-typ napäťovo riadené vápnikové kanály, pretože ako bolo vyššie diskutované, tieto zlúčeniny pôsobia nielen na N - a T-typ tejto skupiny kanálov, ale sú tiež aktívne na sodíkových i draslíkových kanáloch. Špecifické inhibítory N - a T-typu napäťovo riadených vápnikových kanálov môžu významne prispieť k vývoju nových terapeutík pre liečbu neuropatickej bolesti, resp. epilepsie.
Práca bola realizovaná v rámci grantových projektov 1/4298/07 a 1/4299/07 VEGA Ministerstva školstva SR a grantu UK 45/2007.
Došlo: 3. prosince 2007
Přijato: 14. ledna 2008
Adresa pro korespondenci:
Mgr. Lucia Veizerová
Katedra farmaceutickej analýzy a nukleárnej farmácie FaF UK
Odbojárov 10, 832 32, Bratislava, Slovenská republika
e-mail: veizerova@fpharm.uniba.sk
Zdroje
1. Caterrall, W. A.: Pharmacol. Rev., 2005; 57, 411–425.
2. Josephson, I. R. et al.: Biophys. J., 2002; 83, 2575–2586.
3. Triggle, D. J.: Drug. Dev. Res., 2003; 58, 5–17.
4. Ertel, E. A. et al.: Neuron, 2000; 25, 533–535.
5. Hofmann, F. et al.: Rev. Biochem. Physiol., 1999; 139, 33–88.
6. Yu, F. H., Catterall, W. A.: Sci. STKE, 2004; 253, 15.
7. Tanaka, H., Shigenobu, K.: J. Pharmacol. Sci., 2005; 99, 214–220.
8. Hamid, J. et al.: Neuroscience, 2006; 143, 717–728.
9. Ono, K., Iijima, T.: J. Pharmacol. Sci., 2005; 99, 197–204.
10. Vitko, I. et al.: J. Neurosci., 2005; 25, 4844–4855.
11. Splawski, I. et al.: J. Biol. Chem., 2006; 281 (31), 22085–22091.
12. Yunker, A. M. R.: J. Bioenerg. Biomembr., 2003; 35, 6, 577–598.
13. Hagivara, N. et al.: J. Physiol., 1988; 395, 233–253.
14. Heady, T. N. et al.: Jpn. J. Pharmacol., 2001; 85, 339–350.
15. Masuda, Y. et al.: Cardiovasc. Drug Rev., 1994; 12, 123–135.
16. Masumiya, H. et al.: Eur. J. Pharmacol., 1998; 349, 351–357.
17. Furukawa, T. et al.: Br. J. Pharmacol., 2004; 143, 1050–1057.
18. Tanaka, H. et al.: J. Pharmacol. Sci., 2004; 96, 499–501.
19. Kumar, P. H. et al.: Mol. Pharmacol., 2002; 61, 649–658.
20. Triggle, D. J.: Mini Rev. Med. Chem, 2003; 3, 215–223.
21. Yamamoto, T. et al.: Bioorg. Med. Chem. Lett., 2006; 16, 798–802.
22. Mori, Y. et al.: Trends Cardiovasc. Med., 2002; 12, 270–275.
23. Saegusa, H. et al.: T. EMBO J., 2001; 20, 2349–2354.
24. Perez-Pinzon, M. A. et al.: J. Neurol. Sci., 1997; 153, 22–28.
25. Doering, C. J., Zamponi, G. W.: J. Bioenerg. Biomembr., 2003; 35 (6), 491–505.
26. Hu, L. Y. et al.: J. Med. Chem., 1999; 42, 4239–4249.
27. Roullet, J. B. et al.: J. Biol. Chem., 1999; 274, 25439–25446.
28. Murai, Y. et al.: Brain Res., 2000; 854, 6–10.
29. Murakami, M. et al.: Eur. J. Pharmacol., 2000; 419, 175–181.
30. Hu, W. Y. et al.: J. Cardiovas. Pharmacol., 2001; 38, 450–459.
31. Uneyama, H. et al.: Eur. J. Pharmacol., 1999; 373, 93–100.
32. Takahara, A. et al.: Hypertens. Res., 2003; 26, 741–752.
32a. Altier, Ch., Zamponi, G. W.: Trends Pharmacol. Sci., 2004; 29, 465–470.
33. Mintz, I. M. et al.: Nature, 1992; 355, 827–829.
34. Newcomb, N. et al.: Biochemistry, 1998; 37, 15353–15362.
35. Bourinet, E. et al.: Biophys. J., 2001; 81, 79–88.
36. Ellory, J. C. et al.: FEBS Letts., 1992; 296, 219–221.
37. Ellory, J. C. et al.: Brit. J. Pharmacol., 1994; 111, 903–905.
38. Klockner, U. et al.: Brit. J. Pharmacol., 1989; 97, 957–967.
39. Longman, S. D. et al.: Med. Res. Rev., 1992; 35, 2327–2340.
40. Li, J. H.: Cardiovascular Drug Reviews, 1997; 15, 220–231.
41. Yagupolskii, L. M. et al.: J. Med. Chem., 1999; 42, 5266–5271.
42. Kohlhardt, M. et al.: Naunyn–Schmied. Arch. Pharmacol., 1989; 340, 210–218.
43. Yatani, A. et al.: Circ. Res., 1985; 57, 868–875.
44. Haleen, S. J. et al.: J. Pharmacol. Exp. Therap., 1989; 250, 22–30.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2008 Číslo 2- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
-
Všechny články tohoto čísla
- Sedmdesátka doc. RNDr. Jiřího Hartla, CSc.
- K životnímu jubileu prof. RNDr. Rolfa Karlíčka, DrSc.
- Standardní receptura pro přípravu léčivých přípravků v lékárnách I. Suspenze k aplikaci na kůži
- Interakcia 1,4-dihydropyridínov s iónovými kanálmi
- Nové knihy
- Polosyntetické deriváty celulosy jako základ hydrofilních gelových systémů
- Radioaktivně značené peptidy v diagnostice a terapii nádorů
- Léčivé rostliny a diabetes mellitus
- NOVÉ KNIHY
- Moderní instrumentální metody studia isoflavonů
- Ze zasedání Výboru České farmaceutické společnosti
- Laktobacily a ich probiotické vlastnosti
- Přínos alergenové imunoterapie Phostalem v léčbě sezonní alergické rýmy (dva roky aplikace)
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Polosyntetické deriváty celulosy jako základ hydrofilních gelových systémů
- Laktobacily a ich probiotické vlastnosti
- Standardní receptura pro přípravu léčivých přípravků v lékárnách I. Suspenze k aplikaci na kůži
- Léčivé rostliny a diabetes mellitus
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Současné možnosti léčby obezity
nový kurzAutoři: MUDr. Martin Hrubý
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání








