-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaGenerika, generická substituce a generická preskripce: S jakými úskalími je třeba počítat?
1. 4. 2019
Generika bývají považována za stejně účinné a levnější varianty originálních přípravků. Procedura vývoje a registrace generik je zaměřena na jejich urychlený vstup na trh, nicméně její relativní jednoduchost může přinášet řadu skrytých problémů. Bioekvivalenční studie zaručují podobnost dvou léčivých přípravků, nikoli však jejich shodnost. Lékaři vnímají pojem terapeutické zaměnitelnosti obvykle velmi zjednodušeně: Pokud léčivý přípravek obsahuje totožnou léčivou látku, je automaticky terapeuticky zaměnitelný. Potenciální rizika či nevýhody generické preskripce se přitom často zohledňují jen okrajově.
Generika bývají považována za stejně účinné a levnější varianty originálních přípravků. Procedura vývoje a registrace generik je zaměřena na jejich urychlený vstup na trh, nicméně její relativní jednoduchost může přinášet řadu skrytých problémů. Bioekvivalenční studie zaručují podobnost dvou léčivých přípravků, nikoli však jejich shodnost. Lékaři vnímají pojem terapeutické zaměnitelnosti obvykle velmi zjednodušeně: Pokud léčivý přípravek obsahuje totožnou léčivou látku, je automaticky terapeuticky zaměnitelný. Potenciální rizika či nevýhody generické preskripce se přitom často zohledňují jen okrajově.
Generická substituce a generická preskripce
Při generické preskripci lékař místo komerčního názvu léčivého přípravku předepíše mezinárodní nechráněný název účinné látky (INN) a výběr konkrétního léku s danou účinnou látkou je přenesen na lékárníka. Generická substituce je postup, při němž v lékárně není vydán předepsaný přípravek, ale přípravek jiný, což za definovaných podmínek zákonná úprava umožňuje.
Co je to generikum?
Generikem se dle Zákona o léčivech (č. 378/2007 Sb) rozumí léčivý přípravek, který má shodné kvalitativní a kvantitativní složení, pokud jde o léčivé látky, a shodnou lékovou formu s referenčním léčivým přípravkem. Musí u něj být (s výjimkou případů, kdy lze doložit, že generikum splňuje příslušná kritéria) prokázána bioekvivalence s referenčním léčivým přípravkem příslušnými studiemi biologické dostupnosti (jako referenční přípravek může sloužit jak originální přípravek, tak eventuálně i jiné generikum). Různé soli, estery, ethery, izomery, směsi izomerů, komplexy nebo deriváty léčivé látky se považují za tutéž léčivou látku, pokud se významně neodlišují vlastnostmi týkajícími se bezpečnosti, popřípadě účinnosti. Různé perorální lékové formy s okamžitým uvolňováním se považují za jednu a tutéž lékovou formu.
Požadavky při uvádění generik na trh
Generika mohou být uváděna na trh po uplynutí patentové ochrany, případně po uplynutí lhůty ochrany dat. Zjednodušeně je možné konstatovat že pro jejich vstup na trh je (vedle řady různých administrativních povinností) za dostatečnou považována studie prokazující bioekvivalenci, která se většinou provádí na zdravých dobrovolnících, zatímco originální přípravky užívají ve studiích nemocní lidé, často vyššího věku a s řadou komorbidit. Generikum tak může vstoupit na trh, aniž by jej užíval jediný pacient. Generika jsou registrována buď prostřednictvím národní registrace, nebo procedurou vzájemného uznávání (MRP − mutual recognition procedure), eventuálně postupem decentralizované registrace; v některých je možná i centralizovaná registrace platná pro celou EU.
Ceny generických léčiv musejí pokrýt náklady na výrobu a distribuci, ale neobsahují náklady na výzkum a vývoj nové léčivé látky. Náklady spojené s vývojem generického léčiva a s procesem jeho registrace (včetně nákladů spojených s prováděním bioekvivalenčních studií) jsou nesrovnatelně nižší než náklady spojené s vývojem originální léčivé látky. Vývoj generika trvá v průměru 2–3 roky a náklady se pohybují kolem 2–3 milionů dolarů, v případě originálního přípravku je to 15 i více let a náklady dosahují průměrně 2,6 miliardy dolarů.
Bioekvivalenční studie
Výrobce generického přípravku tedy během registračního řízení musí předložit výsledky tzv. bioekvivalenční studie, kdy musí být prokázána bioekvivalence s referenčním léčivým přípravkem. Během této studie jsou testovány stejné dávky téže lékové formy se stejnou aplikační cestou pouze u zdravých dobrovolníků (nejméně 12, obvykle kolem 24–48). Při vývoji nových originálních léků jsou do studií zahrnuty tisíce pacientů (obvykle 5–10 tisíc osob). Bioekvivalenční studie jsou většinou koncipované jako jednodávkové, protože ty jsou citlivější na posouzení uvolňování léčivé látky z přípravku do systémového oběhu.
Bioekvivalence je pak prokázána, jestliže 90% interval spolehlivosti poměru průměrných logaritmických hodnot plochy pod křivkou plazmatické koncentrace léčiva v čase (AUC) a maximální koncentrace léčiva v plazmě (cmax) leží v intervalu 0,80–1,25; tedy pokud je z 90 % zaručeno, že celkové vstřebané množství léčiva z generického přípravku a jeho maximální koncentrace dosahují 80–125 % hodnot referenčního přípravku. U látek s nízkým terapeutickým indexem je akceptační interval AUC snížen (90–111,11 %), naopak v případě vysoce variabilních léčivých přípravků je interval cmax v určitých případech rozšířen.
Úskalí bioekvivalenčních studií
Zdánlivě velmi malé rozdíly v plazmatických profilech v bioekvivalenčních studiích však mohou nabýt na významu zejména u léčiv s úzkým terapeutickým rozmezím, jestliže je v rámci výše uvedené generické substituce nahrazen originální přípravek generickým (popřípadě i naopak). Ještě větší riziko ovšem představuje situace, kdy je nahrazováno jedno generické léčivo jiným, neboť zatímco v prvním případě mohla být plazmatická koncentrace ve srovnání s referenčním přípravkem o 20 % nižší, ve druhém případě může být naopak až o 25 % vyšší. Teoreticky se tedy, pokud nahradíme jedno generikum druhým, mohou tato generika navzájem lišit v plazmatické koncentraci až o více než 40 %! To může mít za následek riziko nežádoucích účinků či lékových interakcí nebo může být nemocný naopak vystaven riziku podléčení, komplikací choroby atd.
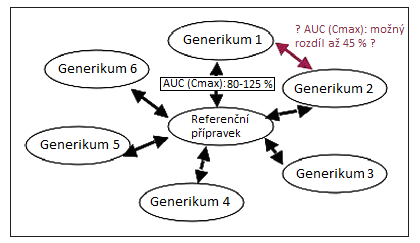
Obr. Substituce originálního přípravku generikem a substituce generik navzájem (upraveno dle: Al-Jazairi et al., 2008)
Zjištěná farmakokinetika generického léku u zdravých jedinců nemusí přesně předpovědět farmakokinetiku u pacientů (zejména starších). Ta může být ovlivněna řadou souběžných onemocnění, rozdílem v metabolismu, interakcemi se současně podávanými léky, se stravou, gastrointestinálními faktory, jako jsou žaludeční pH, průtok krve a bakteriální flóra.
Bioekvivalenčním studiím je možné vytknout i poměrně malý soubor probandů, kterými jsou navíc vždy jinak zdraví dobrovolníci neužívající jakoukoliv jinou léčbu, a mimo jiné i to, že testované léčivo je podáno pouze jednorázově, což jistě neodpovídá běžné klinické praxi. Vícedávkové studie se provádějí jen v určitých specifických případech (například jedná-li se o lékovou formu s řízeným uvolňováním léčiva). Výsledky jednodávkových studií se tak používají k predikci výsledků po opakovaném užití léku.
Problémem může být rovněž čistota substance a její stabilita, schopnost výrobce udržet standardní podmínky výroby a přítomnost různých stereoizomerů, protože jednotlivé stereoizomery téže látky mohou být méně účinné, nebo dokonce mohou vykazovat i zcela odlišný farmakodynamický účinek. Pomocné látky použité v generické formulaci mohou mít vliv na distribuci léčivé látky, její metabolismus nebo absorpci v ustáleném stavu, aniž by se tyto rozdíly zjistily po 1 dávce.
V klinické praxi se většina léků nepodává jako 1 dávka, ale opakovaně a pro dosažení terapeutického účinku je třeba dosáhnout ustálené plazmatické koncentrace. V mnoha případech je tato koncentrace vyšší, než jaká je získána po jediné dávce u zdravých dobrovolníků. Dále je třeba připomenout, že důsledkem generické substituce je také odlišnost v barvě, tvaru či velikosti léčiva (popřípadě i chuti a zápachu) oproti dosavadní léčbě a jakákoliv takováto změna může zvýšit pravděpodobnost pacientovy non-compliance.
Závěr
Účinnost a bezpečnost generik je extrapolována na základě doložené chemické a farmaceutické ekvivalence a studie bioekvivalence. Bioekvivalenční studie mají svá úskalí a omezení, navíc při registraci léčivého přípravku není požadováno demonstrovat bioekvivalenci s ostatními generiky obsahujícími stejnou látku. V běžné praxi může docházet k následným − často lékařem nekontrolovaným − substitucím jednoho generika za druhé. Tyto substituce mohou vést k odchylkám od cílových terapeutických koncentrací nebo narušit compliance a přispět ke zmatení pacienta a chybám, jež mohou ovlivnit terapeutický výsledek.
Při generické substituci může nastat problém s terapeutickou zaměnitelností zejména u látek s úzkým terapeutickým oknem, nelineární kinetikou nebo u přípravků s řízeným uvolňováním, jak ukázaly například studie s originálním přípravkem s metforminem v lékové formě s prodlouženým uvolňováním v porovnání s jeho generickým léčivem. U pacientů se zvýšeným rizikem či kriticky nemocných, epileptiků, velmi starých osob, diabetiků, astmatiků a osob s alergií na konkrétní pomocné látky je generická substituce doporučována jen s opatrností, případně není doporučována vůbec.
(blu)
Zdroje:
- Al-Jazairi A. S., Bhareth S., Eqtefan I. S., Al-Suwayeh S. A. Brand and generic medications: are they interchangeable? Ann Saudi Med 2008; 28 (1): 33−41.
- Evaluation of clinical trial costs and barriers to drug development. IgeaHub, 2018 Aug 28. Dostupné na: www.igeahub.com/2018/08/28/evaluation-of-clinical-trial-costs-and-barriers-to-drug-development
- Generické léčivé přípravky. Farmakoterapeutické informace 2012; 1. SÚKL, 2012. Dostupné na: www.sukl.cz/sukl/obsah-2012
- Jak zlepšit adherenci při léčbě metforminem? Medical Tribune 2015; 14. Dostupné na: www.tribune.cz/clanek/36593-jak-zlepsit-adherenci-pri-lecbe-metforminem
- Mayer O. jr. Ekonomické aspekty a potenciální rizika generické substituce. Farmakoterapie 2016; 12 (1): 78−81.
- Slíva J., Hakl M. Rizika generické substituce v širších souvislostech. Farmakoterapie 2013; 9 (2): 215−218.
- Suchopár J. Originální a generické léčivé přípravky, biologická a biologickým lékům podobná léčiva (biosimilars) a nebiologická komplexní léčiva. Remedia 2015; 25 (5): 364–369.
- Suchopár J. Terapeutická zaměnitelnost – příklad anagrelidu. Remedia 2017; 27 (4): 401–407.
- Van Gelder T. Why bioequivalence and unconditional interchangeability of generic drugs are not the same. Generics and Biosimilars Initiative (GaBI) Journal 2013; 2 (2): 83–85.
- Vetchý D., Vetchá M. Generická substituce antimikrobiálních látek. Farmakoterapie 2016; 12 (5): 631–634.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Farmacie Farmakologie Farmaceutický asistent
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



