-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaO aktivitách PRAC a budoucnosti farmakovigilance i role lékárníků s předsedkyní výboru při EMA dr. Ullou Wändel Liminga
14. 3. 2025
Zkušená farmaceutka a vědecká ředitelka pro farmakovigilanci ve Švédské agentuře pro léčivé přípravky v září převzala mandát předsedkyně Farmakovigilančního výboru pro posuzování rizik léčiv (PRAC) při Evropské lékové agentuře (EMA). V exkluzivním rozhovoru pro náš portál dr. Ulla Wändel Liminga popisuje kompetence výboru, sdílí své vize, zdůrazňuje klíčovou úlohu lékárníků v monitorování bezpečnosti léčiv a nabízí cenné rady pro odborníky v oblasti farmacie.
Na úvod něco málo o vás: Co vás po absolvování studia farmacie inspirovalo ke kariéře ve farmakologii a toxikologii?
Jsem vystudovaná farmaceutka, doktorát jsem získala na Uppsalské univerzitě ve Švédsku. Cílem mé disertační práce bylo prostřednictvím preklinického výzkumu lépe porozumět potenciálním mechanismům, které jsou základem motorických nežádoucích účinků některých antipsychotických léků. V roce 1994, krátce po absolutoriu, jsem začala pracovat jako neklinická posuzovatelka ve Švédské agentuře pro léčivé přípravky (MPA). Tato pozice mi také dala možnost pokračovat ve vědecké práci ve vztahu k farmacii. Od té doby se věnuji neklinickým i klinickým hodnocením účinnosti a bezpečnosti a farmakovigilanci. Většina těchto hodnocení byla provedena v rámci postupů Evropské unie a díky tomu jsem získala rozsáhlé zkušenosti s regulačním systémem EU.
V roce 2007 jsem se stala vědeckou ředitelkou oddělení farmakologie a toxikologie MPA. Od roku 2012, kdy byl zřízen Farmakovigilanční výbor pro posuzování rizik léčiv (PRAC – Pharmacovigilance Risk Assessment Committee) při EMA, jsem byla jedním ze švédských členů. V roce 2020 jsem přešla na pozici vědecké ředitelky oddělení farmakovigilance a od té doby se věnuji výhradně této problematice. V září 2024 jsem nastoupila na pozici předsedkyně PRAC.
Jaké jsou vaše hlavní povinnosti jakožto předsedkyně PRAC a jak se tato role liší od vašich předchozích funkcí?
V rámci systému pro schvalování a postmarketingové sledování léčiv v EU máme dobře zavedený systém sdílení práce. Například jeden členský stát nese odpovědnost za primární posouzení všech postupů pro konkrétní léčivý přípravek (LP) nebo látku, přičemž působí jako takzvaný zpravodaj nebo vedoucí členský stát. U jiných léčivých přípravků, kde má primární odpovědnost jiný členský stát, působí při hodnocení především jako odborný posuzovatel.
Vědecká hodnocení provádějí hodnotitelé příslušných vnitrostátních orgánů. Jako jeden ze švédských delegátů PRAC jsem byla zpravodajem nebo vedoucím pro velké množství produktů, u kterých jsme provedli širokou škálu hodnocení. Interně to znamená podporovat hodnotitele a zajišťovat kvalitu různých hodnocení. Některá z těchto hodnocení pak byla projednána na PRAC – v takovém případě jsem téma prezentovala výboru a vedla interakce s ostatními členy PRAC a se zaměstnanci EMA pro tyto specifické produkty. Spolu s interními posuzovateli jsem také provedla vzájemné hodnocení a poskytla komentáře k hodnocením od ostatních členů PRAC.
Jako předsedkyně výboru se již na podrobných hodnoceních nepodílím, ale musím dobře rozumět všem tématům projednávaným na zasedáních. Tato nová role také znamená zaujetí zastřešující perspektivy a poskytování vstupů pro různé další související aktivity.
Mohla byste našim čtenářům popsat zařazení PRAC v rámci hodnocení léčiv na evropské úrovni a jeho poslání?
PRAC je jedním z vědeckých výborů EMA. Jsme zodpovědní za posouzení všech aspektů řízení rizik humánních léčiv, včetně detekce, hodnocení, minimalizace a komunikace rizik nežádoucích účinků při zohlednění terapeutického přínosu. Výbor se rovněž podílí na posuzování návrhů a výsledků poregistračních studií bezpečnosti. Klíčovým úkolem PRAC je monitorování bezpečnosti léčiv a ochrana veřejného zdraví.
Na základě provedených hodnocení může PRAC vydat doporučení pro regulační opatření. Pokud byl například identifikován nový nežádoucí účinek, informace o LP budou aktualizovány a mohou zahrnovat rady pro zdravotníky a pacienty ohledně opatření k minimalizaci rizika. Ve výjimečných případech může nová obava o bezpečnost vést k závěru, že rovnováha mezi přínosy a riziky daného léčivého přípravku při jeho schváleném použití již není pozitivní a lze zavést velká omezení, včetně stažení z trhu.
Obr. Postavení PRAC v regulačním procesu humánních léčiv
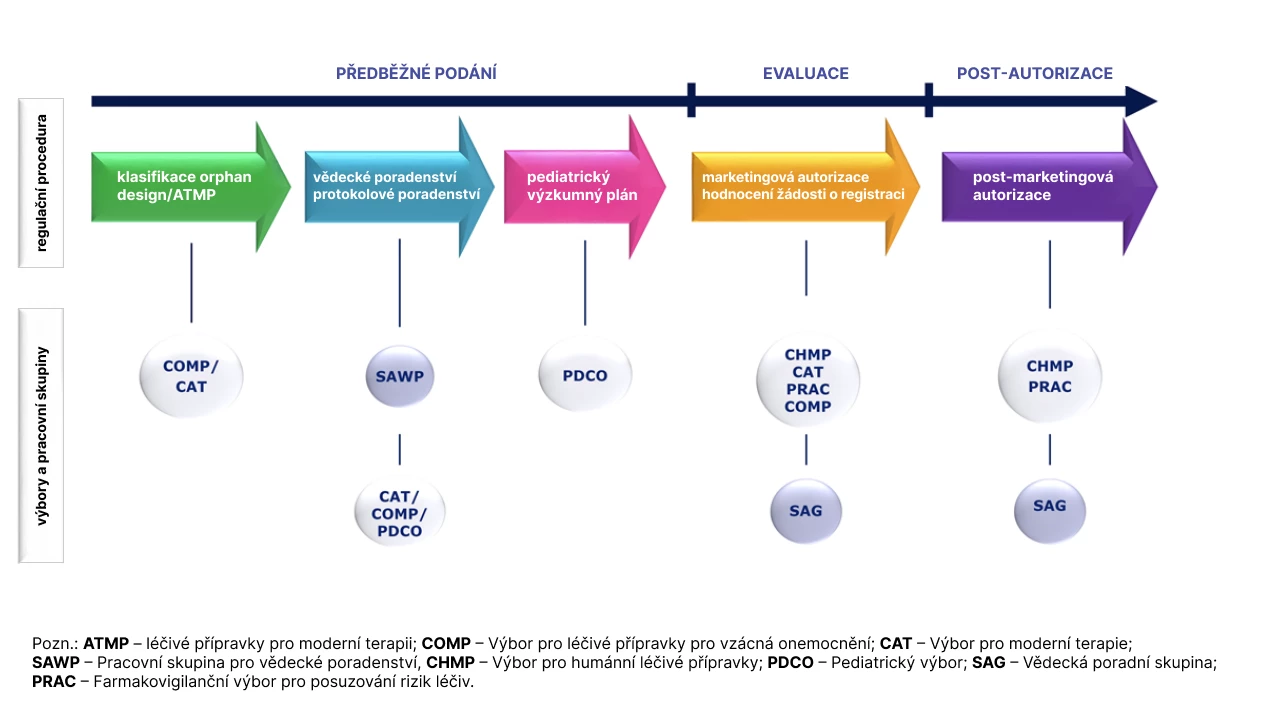
Jaká je struktura výboru a jak jeho členové spolupracují při posuzování bezpečnosti léčiv v celé EU?
PRAC se skládá z členů jmenovaných každým z členských států EU a EHP (Evropský hospodářský prostor)/EFTA (Evropské sdružení volného obchodu), nezávislých vědeckých odborníků a zástupců organizací pacientů a zdravotnických pracovníků. Pro většinu léčivých přípravků je mezi členy PRAC jmenován zpravodaj (rapporteur) nebo zástupce vedoucího členského státu (lead member state representative), který má hlavní odpovědnost za posouzení bezpečnosti, jež je pro daný LP potřebné.
Výsledky těchto hodnocení mohou diskutovány na měsíčních plenárních zasedáních PRAC, jejich výsledkem je přijetí doporučení nebo rady určené dalším výborům či pracovním skupinám v rámci sítě. Rozhodnutí nakonec přijímá Evropská komise. Síť EU je založena na spolupráci mezi EMA, vnitrostátními orgány a nominovanými odborníky uvedenými na webových stránkách EMA. Podněty získáváme také od zdravotnických pracovníků a pacientů.
Jak jste zmínila, jste také jedním ze švédských národních členů PRAC. Jak tato zkušenost ovlivnila vaše chápání farmakovigilance?
Členství v PRAC od jeho založení v roce 2012 mi dalo rozsáhlé zkušenosti v oblasti farmakovigilance z hlediska regulace. Aktivně jsem se podílela na rozvoji farmakovigilanční práce v rámci sítě EU, a to s ohledem jak na pracovní postupy, tak i na formování regulačních pokynů. V průběhu let jsem se zúčastnila mnohých hodnocení, včetně několika rozsáhlých doporučení, jež se týkají široké škály léčivých přípravků a otázek bezpečnosti.
Mým hlavním cílem je, aby výstupy PRAC byly i nadále úměrné riziku a vyvážené, podpořené vysoce kvalitními vědeckými hodnoceními se zaměřením na bezpečnost pacientů a veřejné zdraví.
Mohla byste zmínit některé z klíčových problémů, kterým jste ve své kariéře čelila v souvislosti s hodnocením účinnosti a bezpečnosti léčiv?
Především pandemie COVID-19 pro nás byla velkou výzvou jak na úrovni EU, tak na národní úrovni. Během podzimu prvního roku pandemie (2020), kdy byly rychle vyvíjeny první vakcíny, bylo nejvyšší prioritou jejich schválení, jakmile byly k dispozici dostatečné informace pro vyvození závěru o pozitivním poměru přínosů a rizik.
V roce 2021, kdy byly vakcíny zavedeny, byla práce na dohledu nad bezpečností v národních agenturách, v EMA a v rámci PRAC velmi intenzivní a časově náročná. Obvyklé časové plány neplatily, ale bezpečnostní standardy zůstaly na nejvyšší úrovni. Byla jsem zpravodajkou PRAC pro jednu ze čtyř prvních schválených vakcín, což znamenalo opakovaně provádět rozsáhlá hodnocení bezpečnosti během velmi krátkých časových období. U této vakcíny několik našich hodnocení vyústilo v doporučení pro regulační opatření.
Síť EU, včetně výboru PRAC, navíc považovala plnou transparenci v kontextu probíhajících hodnocení bezpečnosti a možných nebo již identifikovaných rizik vakcín za zásadní. Klíčovou prioritou bylo informovat veřejnost i zdravotníky o výhodách a rizicích vakcín, aby mohli činit informovaná rozhodnutí. Například mezi lety 2021 a 2022 bylo zveřejněno více než 50 bezpečnostních aktualizací o probíhajících a uzavřených hodnoceních bezpečnosti pro registrované vakcíny COVID-19, zdůrazňujících změny a konkrétní doporučení k minimalizaci určitých rizik. V napjatých termínech jsme řešili řadu komplikovaných záležitostí, což bylo náročné, ale také obohacující.
Jak motivovat pacienty, aby hlásili podezření na nežádoucí účinky přímo vnitrostátním orgánům (tedy v Česku na SÚKL) nebo je sdíleli se zdravotnickými pracovníky v první linii, jako jsou například lékárníci?
Podporou a zvyšováním povědomí o hodnotě hlášení podezření na nežádoucí účinky. Tyto zprávy jsou důležitou součástí monitorování bezpečnosti léčiv.
Jaké jsou vaše krátkodobé a dlouhodobé cíle jakožto předsedkyně PRAC a jak plánujete zvýšit dopad výboru na veřejné zdraví?
Chci stavět na společných zkušenostech a nadále zajišťovat, aby naše výstupy byly přiměřené a robustní a aby bezpečnost pacientů a veřejné zdraví zůstaly naší prioritou.
Rozhodujícími faktory pro pokračující úspěch ve stále se vyvíjejícím vnitřním a vnějším prostředí bude neustálé zaměření na vysoce kvalitní vědecká hodnocení a úzká spolupráce v rámci PRAC, s EMA a jejími výbory a s regulační sítí EU.
Lékárníci a farmaceutičtí asistenti hrají v péči o pacienty zásadní roli. Jak lze posílit spolupráci mezi PRAC a zdravotníky na úrovni lékáren?
PRAC má stanovené zástupce zdravotnického personálu (HCP), mimochodem, v současné době jsou oba farmaceuti. Aktivně se zapojují do práce PRAC a přinášejí svou perspektivu. Dále existují různé další aktivity, do nichž se zdravotničtí profesionálové včetně lékárníků aktivně zapojují, jako je vývoj pokynů pro řízení rizik a opatření k minimalizaci rizik – viz například pracovní plán PRAC na rok 2024 a pracovní plán pro Pracovní skupinu pacientů a spotřebitelů (PCWP) a Pracovní skupinu zdravotnických pracovníků (HCPWP).
Jaké pokroky a inovace ve farmakovigilanci očekáváte a jak se může PRAC přizpůsobit novým výzvám v oblasti bezpečnosti léčiv?
Tempo a komplexnost inovací ve farmaceutické oblasti neustále roste. Hlavní prvky farmakovigilance zůstávají zachovány, protože při hodnocení platí stejné zásady, je však nutné vzít v úvahu specifické vlastnosti některých LP. Síť EU pro regulaci LP poskytuje potřebné odborné znalosti, ale existuje kolektivní potřeba sledovat vývoj, aby bylo zajištěno dlouhodobé řešení potřeb.
Setkáváme se také s novými metodami a způsoby práce – jedním z horkých témat je samozřejmě využití strojového učení a umělé inteligence (AI). EMA a ředitelé lékových agentur mají víceletý pracovní plán pro AI s vizí umožnit bezpečné a odpovědné používání AI ve prospěch veřejného zdraví a zdraví zvířat. PRAC sleduje tento vývoj a bude zapojen do jakýchkoliv pokynů, které budou vypracovány v oblasti farmakovigilance.
Co byste na závěr poradila začínajícím odborníkům v oblasti farmakovigilance a hodnocení rizik, kteří se chtějí vydat na profesní dráhu podobnou té vaší?
Vzdělávejte se v příslušné oblasti a své vzdělání doplňte vědeckými dovednostmi. Získejte praktické zkušenosti a pracujte v oblasti farmakovigilance, například u příslušného národního orgánu. Zapojte se do hodnocení, buďte otevření a učte se od zkušených kolegů. Tvrdě pracujte a bavte se!
Alexandra Izraelová
redakce proLékárníky.czZdroj grafiky a foto: EMA
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
KongresyOdborné události ze světa medicíny
Všechny kongresy
Nejčtenější tento týden- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Vakcinace stojí díky inovativním technologiím na prahu nové éry
- Návykové látky a prekurzory v magistraliter receptuře
- Prof. Jan Škrha: Metformin je bezpečný, ale je třeba jej bezpečně užívat a léčbu kontrolovat
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



