-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKotevní lana a motýlí křídla – průlom v genové terapii epidermolysis bullosa
18. 7. 2023
Křehké kůži pacientů s nemocí motýlích křídel chybí kolagen typu VII, jehož vlákna kotví pokožku ke škáře. Američtí výzkumníci publikovali na konci roku 2022 přelomovou studii, v níž pacienty s tímto onemocněním léčili topickou genovou terapií.
Když chybí kotevní lano
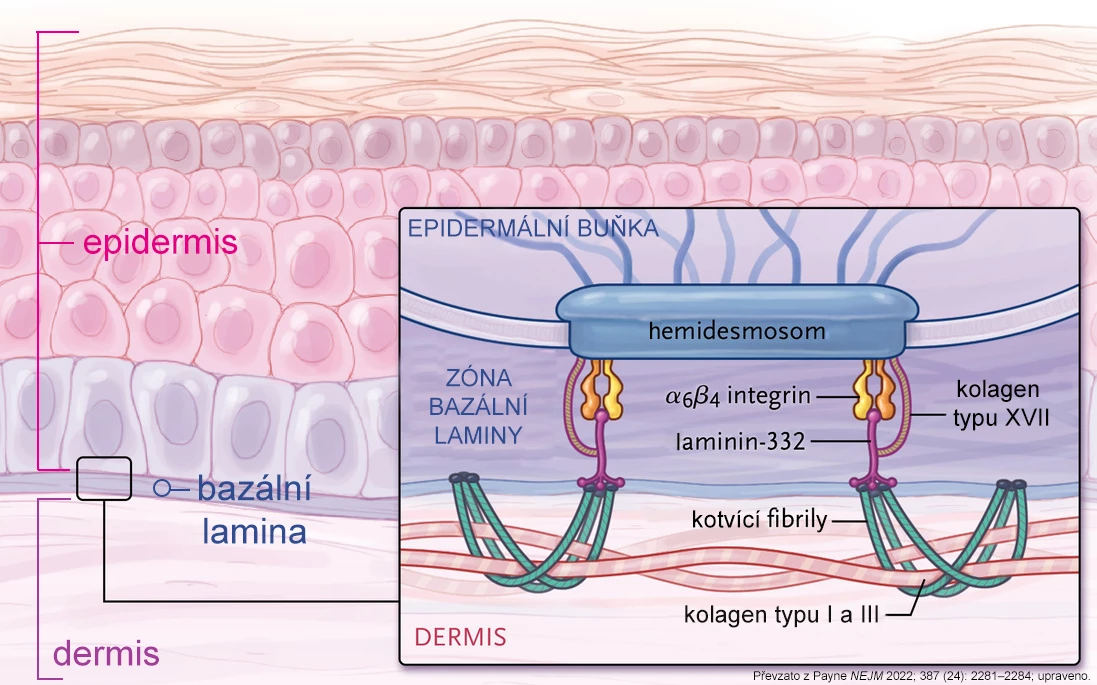
Dystrofická forma epidermolysis bullosa (EB) je způsobena mutací v genu COL7A1, který kóduje řetězec α1 kolagenu typu VII (C7). Dlouhé vlákno C7 se stáčí do trojitého helixu, kovalentně se váže k dalšímu helixu C7 a společně se shlukují do fibril ve tvaru písmene U. Fibrily se řadí na bazální lamině a interagují s okolními proteiny, čímž kotví epitel k pojivové tkáni (viz obr. 1).
Obr. 1 Fyziologická situace na bazální lamině. Kotvicí fibrily kolagenu VII jsou zobrazeny zeleně.
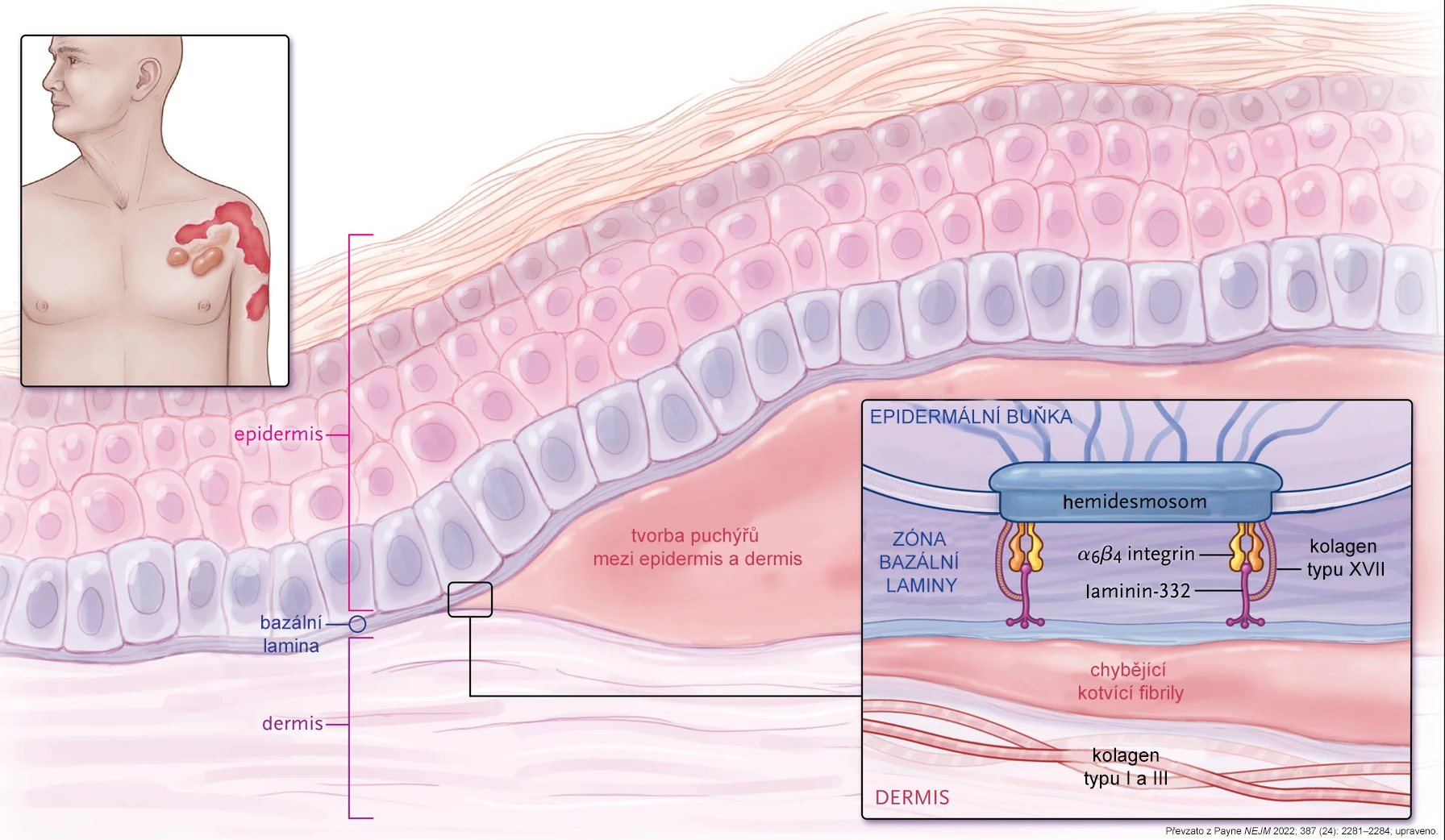
Pokud je tato struktura porušena vlivem chybějících nebo špatně složených kolagenových fibril, stává se kůže extrémně citlivou vůči mechanickému poranění. I malá zranění navozená běžnými aktivitami způsobují puchýře mezi pokožkou a škárou (viz obr. 2). Dochází k jizvení vedoucí k adhezi prstů, zúžení jícnu či genitourinárního traktu a tvoří se chronické rány náchylné k infekci. Tíže onemocnění EB koreluje s vlivem mutací na množství a funkčnost kotvicích fibril.1
Obr. 2 Při dystrofické epidermolysis bullosa není epidermis řádně ukotvena ke škáře vlivem chybějícího kolagenu VII.
Jak opravit vadný gen?
V posledních letech byly zaznamenány velké pokroky na poli buněčné a genové terapie. V klinických hodnoceních byly s různým úspěchem zkoušeny transplantace kostní dřeně, kožní štěpy nebo injekce autologních keratinocytů či fibroblastů s transdukovaným COL7A. Jako nejúspěšnější se zatím jeví topické podání rekombinantního vektoru odvozeného z viru herpes simplex typu 1 kódujícího kolagen typu VII.2
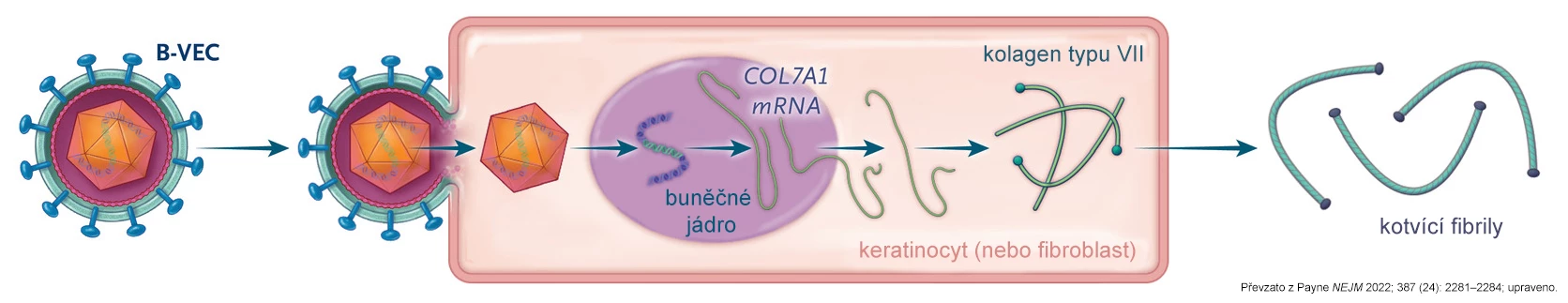
Beremagen geperpavek (B-VEC) obsahuje 2 kopie kódující sekvence COL7A1 uzavřené ve vektoru odvozeném od herpesviru HSV-1, jenž byl modifikován pro potlačení zánětlivé odpovědi a není schopen se replikovat. Proteiny na vnější obálce vektoru HSV-1 interagují s povrchem kožních buněk hostitele a usnadňují vstup nukleokapsidy do nitra buňky. Virová DNA poté podléhá transkripci a translaci do proteinu C7, který je secernován do extracelulárního prostoru, kde se skládá do kotvicích fibril (viz obr. 3). Virový genom HSV-1 se do hostitelských buněk neintegruje, zůstává mimo hostitelské chromosomy a s každým buněčným dělením jeho koncentrace klesá. Terapeutická účinnost tohoto přístupu je tedy přechodná a pro dlouhodobou kontrolu onemocnění je nutné opakované podávání.1
Obr. 3 Zjednodušené schéma mechanismu účinku beremagen geperpaveku
K čemu se může hodit herpesvirus...
Na druhou stranu je vektor založený na HSV-1 schopen nést velké inzerty (COL71A s délkou 9 kb přesahuje kapacitu mnoha jiných vektorů používaných v genové terapii), nezpůsobuje inzerční mutagenezi a je formulován v methylcelulózovém gelu, který pacientům umožňuje snadnou topickou aplikaci.1 Autoři práce nedávno publikované v New England Journal of Medicine hodnotili jeho účinnost v klinické studii fáze III.3
Klinická studie fáze III
Metodika a průběh
Dvojitě zaslepené placebem kontrolované studie se účastnilo celkem 31 pacientů ve věku od 6 měsíců s geneticky potvrzenou dystrofickou EB. U každého byly zvoleny 2 kožní léze odpovídající velikosti, vzhledu a ve shodné tělesné oblasti. Každé z páru ran byla poté náhodně přidělena aplikace placeba nebo experimentálního přípravku, jež probíhala 1× týdně.
Primárním cílem studie bylo úplné zhojení léčené rány po 6 měsících terapie. V rámci sekundárních cílů byly hodnoceny úplné zahojení po 3 měsících léčby a změny v intenzitě bolesti při převazech na základě 10bodové vizuální analogové škály (VAS).
Výsledky
Po 6 měsících léčby bylo pozorováno úplné zhojení 67 % ran léčených B-VEC a 22 % ran ošetřovaných placebem. Úplné zhojení po 3 měsících léčby nastalo u 71 % ran ošetřovaných B-VEC a 20 % ran s aplikovaným placebem. Po 22 týdnech terapie byl pozorovaný pokles intenzity bolesti při převazech –0,88 pro B-VEC a –0,71 pro placebo, obdobné výsledky byly zaznamenány i ve 24. a 26. týdnu. Nejčastěji hlášenými nežádoucími příhodami byly svědění a zimnice.
Závěr
Topická aplikace virového vektoru nesoucího gen pro podjednotku α1 kolagenu VII byla u pacientů s dystrofickou EB v průběhu 6 měsíců léčby spojená s vyšší pravděpodobností úplného zhojení ošetřované rány než podání placeba. Pro zhodnocení dlouhodobého trvání odpovědi a rizik spojených s léčbou je třeba provést déle trvající klinická hodnocení s větším počtem účastníků.
(este)
Zdroje:
1. Payne A. S. Topical gene therapy for epidermolysis bullosa. N Engl J Med 2022; 387 (24): 2281–2284, doi: 10.1056/NEJMe2213203.
2. Schaffer D. V. The coming of age of topical gene therapy for dystrophic epidermolysis bullosa. N Engl J Med 2022; 387 (24): 2279–2280, doi: 10.1056/NEJMe2212899.
3. Guide S. V., Gonzalez M. E., Bağcı I. S. et al. Trial of beremagene geperpavec (B-VEC) for dystrophic epidermolysis bullosa. N Engl J Med 2022 Dec 15; 387 (24): 2211–2219, doi: 10.1056/NEJMoa2206663.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
KongresyOdborné události ze světa medicíny
Všechny kongresy
Nejčtenější tento týden- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Vakcinace stojí díky inovativním technologiím na prahu nové éry
- Návykové látky a prekurzory v magistraliter receptuře
- Prof. Jan Škrha: Metformin je bezpečný, ale je třeba jej bezpečně užívat a léčbu kontrolovat
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



