-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Rizikové faktory Alzheimerovy choroby: „Dostanu Alzheimerovu nemoc?“
Datum publikace: 21. 12. 2015
Přesná příčina AD není známa, jedná se o multifaktoriální a heterogenní onemocnění, jehož patogeneze je ovlivňována genetickými a environmentálními faktory. Z toho důvodu je obtížné jasně stanovit jak přesná rizika, tak profylaxi. Sledujeme spíše jednotlivé trendy vyššího či nižšího rizika pro vznik klinických projevů nemoci. AD je klinická diagnóza dnes stanovovaná za života nemocného s větší či menší jistotou, klinickopatologický nesoulad může být až v 15–20 % případů. Naší současnou snahou je s pomocí kombinace genetických faktorů a biomarkerů spolehlivě identifikovat jedince s rizikem AD pro účely léčby i dalšího klinického výzkumu.
Úvod
Tento kurz slouží jako úvod do problematiky rizika vzniku Alzheimerovy nemoci (AD). Zahrnuje současnou úroveň poznání rizik pro AD, včetně genetických faktorů. Shrneme současné znalosti o rizicích AD a rámcově odpovíme na následující otázky:
- Je AD dědičná, či nikoliv?
- Jaká jsou typická a méně typická rizika, mimo věk, pro vznik AD?
- Má AD společná rizika s jinými nemocemi?
- Jak je možné se těchto rizik vyvarovat a existuje profylaxe?
Když hodnotíme rizikové faktory pro Alzheimerovu nemoc, bude vhodné oddělit rizika, která předvídají neuropatologické změny, od těch, která mohou předcházet vlastnímu klinickému projevu a vyjádření nemoci. Tento přístup zohledňuje současnou hypotézu tzv. kognitivní rezervy. Jedná se o zdánlivě protektivní účinek vyššího dosaženého vzdělání pro oddálení klinických příznaků AD navzdory již současně probíhajícím neuropatologickým změnám typickým pro diagnózu AD. Prospektivní klinická hodnocení potvrdila vyšší riziko vzniku AD u populace s nižším formálním vzděláním. Jestliže je však již klinická diagnóza pravděpodobné AD stanovena, u nemocných s více lety formálního vzdělání dochází k rychlejší progresi nemoci, neboť v této fázi onemocnění je již kognitivní rezerva vyčerpána.
Modifikátory rizika klinického vyjádření nemoci mohou být vysledovány již od dětství. Hodnotí například obvod hlavy v prvé dekádě života, rychlost růstu ve druhé dekádě života a socioekonomický a nutriční status. Rizikové faktory zahrnují úrazy hlavy, obezitu, inzulinovou rezistenci a další známé vaskulární rizikové faktory, včetně hypertenze, hyperlipidémie a obstrukční spánkové apnoe.
Epidemiologické studie naznačují, že riziko vzniku AD zásadně ovlivňují místní stravovací návyky a sklon k fyzické aktivitě. Dieta složená z olivového oleje, luštěnin, zeleniny a ovoce je spojována s nižším rizikem vzniku AD. Výsledky intervenčních studií jsou rozporuplné, co se týká suplementace vitamínů C, E, B6, B12 a kyseliny listové. Naopak epidemiologické studie a prospektivní znáhodněná klinická hodnocení se shodují na redukci rizika při vyšší fyzické aktivitě v období středního věku. To samé se vztahuje na kognitivní trénink a některé specifické formy meditace (mindfulness, awareness). Také se ukazuje, že sociálně více izolovaní jedinci mají vyšší riziko výraznějšího kognitivního deficitu během stárnutí. Existuje vyšší riziko pro ženy v menopauze vlivem úbytku estrogenů, které mají protektivní účinek.
AD může ve vyšším věku napodobovat depresi (někdy se používá označení „depresivní pseudodemence“). Nicméně deprese je také běžnou součástí prodromálního stadia AD. Těžší formy deprese jsou diagnosticky obtížně odlišitelné od demence při AD.
Diagnóza AD
AD je historicky definována duálně, jako klinickopatologická jednotka. Současný rozvoj biomarkerů, tedy strukturálních a biochemických známek spolu s typickým klinickým vzorcem kognitivních poruch, však směřuje ke spolehlivé diagnostice už za života nemocného.
Klinicky se jedná o známky progredující demence včetně postižení epizodické paměti a dalších kognitivních domén nebo dovedností. Neuropatologicky nacházíme extracelulární parenchymální amyloidové (neuritické) plaky (ukládání beta-amyloidu) a intraneuronální neurofibrilární klubka (depozita hyperfosforylovaného tau-proteinu). Tyto změny jsou doprovázeny numerickou atrofií neuronů, ztrátou synapsí a také vaskulárními depozity amyloidu.
AD se zprvu projevuje drobnými poruchami paměti, kterých si někteří jedinci nemusí být sami vědomi. Postižena je především epizodická paměť s horším ukládáním nových informací i vybavováním již uložených paměťových stop. Postupně se přidává postižení řeči, zrakově-prostorových a frontálních funkcí s pozvolným horšením soběstačnosti. Nekognitivní neuropsychiatrické příznaky (BPSD, behaviorální a psychologické symptomy při demenci) jsou velice časté a někdy mohou předcházet kognitivnímu postižení. Jde o deprese, úzkost, vztahovačnost, neklid anebo paranoidní percepce.
Pro diagnózu nejčastěji používané biomarkery jsou následující:
- Strukturální: MRI, CT.
- Funkční: PET scan s fluorodeoxyglukózou a s jinými traséry; nově je možno i v ČR přímo in vivo zobrazit depozita beta-amyloidu v mozkové tkáni (amyloidové plaky) s použitím specifických radiofarmak (fluorbetaben a flutemetamol).
- Molekulární a biochemické: vyšetření mozkomíšního moku na tau-protein a beta-amyloid.
Příčiny vzniku AD jsou nejspíše heterogenní a pravděpodobně multifaktoriální.
Rizika můžeme rozdělit na 3 základní skupiny:
- demografická;
- genetická;
- negenetická.
1. Demografická rizika:
- Nejsilnějším nezávislým rizikem pro vznik AD je věk. V populaci 60letých jedinců je riziko jejího výskytu kolem tří procent. Toto riziko se každých pět let zdvojnásobuje. Ke konci 8. dekády dosahuje téměř 50 %. Riziko AD se však zvyšuje nejenom s přibývajícím věkem, ale celkově v populaci jako takové. Je předpoklad, že za 50 let bude prevalence této nemoci u jedinců stejného věku asi o jednu třetinu vyšší, nežli je dnes (obr. 1, 2). Do roku 2050 se očekává postižení asi 100 milionů lidí na celém světě.
- Ženy mají pro rozvoj AD lehce vyšší riziko.
- Dalším samostatným rizikem je mírná kognitivní porucha (mild cognitive impairment, MCI). MCI reprezentuje postižení kognice na rozmezí normálního stárnutí a AD. Zhruba pouze 1 procento populace nevykazuje vůbec žádné známky změn kognitivních schopností vlivem stárnutí. Ostatní stárnoucí populace bez AD vykazuje během stárnutí menší úbytek kognitivních schopností. Je to okolnost, která může a nemusí předcházet vzniku AD. Jedinci s MCI mají 50% riziko rozvoje AD. K tomu může dojít mezi necelým jedním rokem a deseti lety. U některých pacientů je MCI již počátečním stadiem AD (tito pacienti mají zpravidla pozitivní nález biomarkerů, např. v mozkomíšním moku nebo PET)
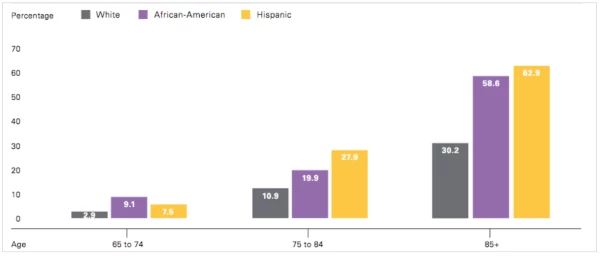
Obr. 1
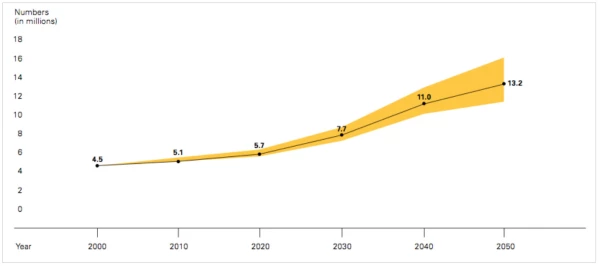
Obr. 2
2. Genetická rizika:
- Genetická architektura AD je velmi komplexní a stále se rozvíjí. Obsahuje mnoho tzv. susceptibility genů a také mnoho negenetických faktorů. Studium drah, skrze které se geny uplatňují na projevech AD, je cestou k nalezení nových typů léků. Vzácné, ale vysoce penetrující autozomálně dominantní mutace přinášejí obohacení zásadních faktů v genetice AD. Co nejpřesnější genetická znalost je potřeba ke zlepšení současné léčebné strategie a také pomůže lépe určit nemocné s vysokým rizikem nemoci.
- AD je dnes nejčastějším typem demence a může být rozdělena do dvou podskupin: jednak familiární AD s časným vznikem (FAD) a jednak nemoc s pozdním vznikem, která je nejčastější variantou a zahrnuje 95 % případů.
- FAD je charakterizován genetickou mutací 3 různých genů: PSEN1, PSEN2 a APPAPP, který je důležitý u všech forem AD, neboť se podílí nejenom na rozvoji FAD, ale je také prekurzorem pro beta-amyloid, který agreguje a vytváří tím amyloidové fibrilární plaky. FAD se typicky projevuje před 60. rokem života, ale to neznamená, že všechny případy AD se začátkem v mladším věku jsou formou FAD. Skutečně familiární je jen asi polovina těchto případů a zhruba u 10 % z nich lze hovořit o autozomálně dominantním způsobu dědičnosti. Gen pro amyloidový prekurzorový protein (APP) je umístěn na 21. chromozomu a byl prvním genem, který byl pro AD rozpoznán. Jeho funkce se patrně vztahuje k synapsím.
- Pozdní forma se objevuje po 65. roce života. Jedná se o sporadickou formu, neboť není známa její jasná genetická etiologie.
- Doposud se počítá s tzv. amyloidovou hypotézou, která je postavena na projevech a nálezech ukládání beta-amyloidu a tau-proteinu do neuronů, vzniku neuritických plaků a neurofibrilárních klubek s následným zánikem synapsí a mozkových buněk. Jednoduše řečeno, pravděpodobně zvýšená produkce a snížená eliminace amyloidu-beta je spouštěcím faktorem řady událostí, které posléze vedou k typické AD patologii a klinickým projevům různých forem AD. To je způsobeno katabolismem APP. Tuto hypotézu podporuje znalost stejné patologie u jedinců s Downovým syndromem, tedy trizomií 21. chromozomu.
- Ukládání amyloidu do mozkové tkáně je tak rozpoznáno jako další z rizik pro vznik AD. Toto pozorujeme nejvíce u nemocných s tzv. apolipoprotein E genotypem (ApoE). Riziková je forma ε4, která zvyšuje v homozygotní formě riziko AD až 8× ve srovnání s běžnou populací. Je to rizikový faktor, nikoliv genetický marker, proto není v současné době stanovení genotypu ApoE součástí klinických diagnostických kritérií AD.
- ApoE lokus se nalézá na chromozomu 19, na kterém se kóduje celá řada dalších bílkovin a nemocí, například familiární hemiplegická migréna. Byl také nalezen v placích tvořených beta-amyloidem. ApoE je protein zodpovědný za lipidový transport v případě HDL molekul. Je vyjádřen v játrech a v CNS, kde jej tvoří mikroglie a astrocyty. Mimo transport částic HDL je také zodpovědný za transport různých forem beta-amyloidu.
- Ukládání beta-amyloidu nemusí vždy vést k demenci. Beta-amyloid se u 10 % kognitivně normálních jedinců začíná ukládat do mozku už ve věku 50 let. U 90letých jedinců je beta-amyloid v mozkové tkáni téměř vždy přítomen, dokonce s větší prevalencí u jedinců více kognitivně činných. Lze spekulovat o tom, že více kognitivně nadaný jedinec má větší kognitivní rezervu před tím, nežli se u něho příznaky AD projeví.
- Asi třetina starších dospělých má plně rozvinutou AD neuropatologii bez klinických projevů nemoci. Nálezy smíšených patologických nálezů jsou také zcela běžné. Příkladem je AD patologie a k tomu nálezy mozkových infarktů anebo společná AD patologie s Lewyho tělísky.
- Existují také nemocní s typickými projevy AD, ovšem bez prokázané patologie jak pomocí biomarkerů, tak post mortem.
- Je prokázané, že začátky ukládání beta-amyloidu do mozkové tkáně je možné sledovat několik dekád před vlastními klinickými projevy, tedy před kognitivní deteriorací. Současně lze vidět zánik synapsí, pokračující atrofii mozku, zejména některých jeho částí, jako jsou operkulum, cingulum a oblasti hipokampů.
- Familiární AD (FAD) je vzácná, vyskytuje se rodově například v Jižní Americe a celosvětově je zjištěno několik set rodin s touto autozomálně dominantní rodinnou variantou, ve které se uplatňují také deterministické geny. U méně nežli 1 % postižených s autozomálně dominantní dědičností je riziko vzniku AD rovno 100 %. V těchto rodinách se nemoc u některých jedinců projeví ve velmi nízkém věku, například již ve 3. dekádě.
- Obecně nelze u nefamiliárních forem říci, že se jedná o prokazatelně genetické onemocnění, v rodinách s výskytem AD je riziko postižení dalších členů asi 6krát vyšší nežli v běžné populaci. Jde o kombinace genetických a environmentálních faktorů.
3. Negenetická rizika:
- diabetes mellitus;
- arteriální hypertenze;
- obezita;
- deprese;
- kouření;
- kardiovaskulární choroby;
- tělesná inaktivita;
- mentální inaktivita;
- alkohol;
- nižší stupeň vzdělání;
- vyšší hladina homocysteinu;
- anamnéza závažných nebo opakovaných úrazů hlavy;
- hypercholesterolémie.
Doposud není jasné, zda klinické projevy AD nejsou zcela závislé na jiných faktorech, například depresi, diabetu anebo drobných mozkových infarktech. Okolnost, že řada rozpoznaných rizik je společná jak pro cerebrovaskulární onemocnění a cévní mozkové příhody, tak pro demenci, by pro druhou možnost mohla svědčit. Existují pozorování výskytu klinicky aparentní AD při současném nálezu typické patologie AD a současně mozkových ischemiích. Na druhé straně je při stejně rozvinuté AD patologie bez současné přítomnosti mozkových ischemií incidence klinických příznaků AD, tedy poruch kognice, mnohem méně častá. Také morbidita deprese u AD je častým a známým jevem.
Do protektivních faktorů patří následující okolnosti:
- tělesná aktivita;
- pití kávy a jiných kofeinových nápojů;
- přirozené potravinové antioxidanty, jako jsou vitamíny C a E;
- dobrá saturace vitamínem B (specificky B6 a B12);
- dostatečný příjem folátu v potravě;
- příjem nenasycených mastných kyselin;
- znalost nejméně 1 cizího jazyka;
- středomořská dieta (olivový olej, ořechy, zelenina, luštěniny, kvalitní mléčné výrobky, celozrnné obiloviny);
- důsledná léčba spánkové apnoe a dostatek spánku;
- kognitivní trénink;
- některé typy meditací, například „mindfulness“, „awareness“.
Fakt, že AD je neurodegenerativní onemocnění jednak s neznámou příčinou, jednak pravděpodobně multifaktoriální a konečně že biologický začátek onemocnění je posunut až tři dekády před klinický vznik projevů, výrazně stěžuje určení jednoho či více zásadních rizikových faktorů, na kterých závisí spuštění mechanismu neurodegenerace a posléze i klinické projevy. Po stránce genetické se jistě nejedná o monogenetické vyjádření a existuje více prokázaných anebo suspektních genů, které se na rozvoji nemoci podílejí. Stále není jasné, nakolik je amyloidová hypotéza platná a zda ukládání amyloidu není samo o sobě známkou jiného procesu, který vede k neurodegeneraci, nežli jeho vlastní příčinou.
- Corrada M. M. Ann Neurol. 2010 Jan; 67 (1): 114–121.
van Harten A. C., et al. Neurology. 2013; 81 (16): 1409–1416. - Barnes D. E. and Yaffe K. Lancet. 2011; 10 : 819–28.
Beydon M. A., et al. BMC Public Health. 2014; 14 : 643–676.
Barnard N. D., et al. Neurobiol Aging. 2014 Sep; 35 Suppl 2: S74–8.
Freedman M., et al. Behav Neurol. 2014; 2014 : 808137.
Mosconi L., et al. J Prev Alzheimers Dis. 2014; 1 (1): 23–32.
Troussiere A. C., et al. J Neurol Neurosurg Psychiatry. 2014. - Snowdon D. A., Nun Study (2003) Healthy aging and dementia: findings from the Nun Study. Ann Intern Med 139 : 450–4.
- Johnson K. A., et al. Cold Spring Harb Perspect Med. 2012; 2 (4): a006213. Prevalence of Cerebral Amyloid Pathology in Persons Without Dementia A Meta-analysis.
- Willemijn J. Jansen, MSc1; Rik Ossenkoppele, PhD 2, 3, 4, 5; Dirk L. Knol, PhD 6; Betty M. Tijms, PhD 2; Philip Scheltens, MD, PhD 2; Frans R. J. Verhey, MD, PhD 1; Pieter Jelle Visser, MD, PhD 1, 2; and the Amyloid Biomarker Study Group JAMA. 2015; 313 (19): 1924–1938; doi:10.1001/jama.2015.4668.
- Bruno Dubois, Howard H. Feldman, Claudia Jacova, Jeffrey L. Cummings, Steven T. DeKosky, Pascale Barberger-Gateau, André Delacourte, Giovanni Frisoni, Nick C. Fox, Douglas Galasko, Serge Gauthier, Harald Hampel, Gregory A. Jicha, Kenichi Meguro, John O’Brien, Florence Pasquier, Philippe Robert, Martin Rossor, Steven Salloway, Marie Sarazin, Leonardo C. de Souza, Yaakov Stern, Pieter J. Visser, Philip Scheltens Revising the definition of Alzheimer’s disease: a new lexicon www.thelancet.com/neurology Published online October 11, 2010 DOI:10.1016/S1474-4422(10)70223-4
- Tiia Ngandu, PhD, Jenni Lehtisalo, Msc, Alina Solomon, PhD, Esko Levälahti, Msc, Satu Ahtiluoto, MD, Prof Riitta Antikainen, PhD, Prof Lars Bäckman, PhD, Tuomo Hänninen, PhD, Prof Antti Jula>, PhD, Prof Tiina Laatikainen, PhD, Jaana Lindström, PhD, Francesca Mangialasche, PhD, Teemu Paajanen, MA Psy, Satu Pajala, PhD, Prof Markku Peltonen, PhD, Prof Rainer Rauramaa, PhD, Anna Stigsdotter-Neely, PhD, Prof Timo Strandberg, PhD, Prof Jaakko Tuomilehto, PhD, Prof Hilkka Soininen, PhD, Prof Miia Kivipelto, PhD 2 year multidomain intervention of diet, exercise, cognitive training, and vascular risk monitoring versus control to prevent cognitive decline in at-risk elderly people (FINGER): a randomised controlled trial. Lancet. 2015; 6: p2223-2322, http://dx.doi.org/10.1016/S0140-6736(15)60461-5 .
- Craft S. Insulin resistance syndrome and Alzheimer disease: pathophysiologic mechanisms and therapeutic implications. Alzheimer Dis Assoc Disord 2006; 20 (4): 298–301.
- Decarli C. Vascular factors in dementia: an overview. J Neurol Sci 2004; 226 (1–2): 19–23. Roe C., Xiong C., Miller J., Morris J. Education and Alzheimer disease without dementia: support for the cognitive reserve hypothesis. Neurology 2007; 68 (3): 223–228.
- Deng J., Zhou D. H., Li J., et al. A 2-year follow-up study of alcohol consumption and risk of dementia. Clin Neurol Neurosurg 2006; 108 (4): 378–383.
- Laitinen M. H., Ngandu T., Rovio S., et al. Fat intake at midlife and risk of dementia and Alzheimer’s disease: a population-based study. Dement Geriatr Cogn Disord 2006; 22 (1): 99–107.
- Larson E. B., Wang L., Bowen J. D., et al. Exercise is associated with reduced risk for incident dementia among persons 65 years of age and older. Ann Intern Med 2006; 144 (2): 73–81.
- Sitzer D. I., Twamley E. W., Jeste D. V. Cognitive training in Alzheimer’s disease: a meta-analysis of the literature. Acta Psychiatr Scand 2006; 114 (2): 75–90.
- Wang H. X., Karp A., Herlitz A., et al. Personality and lifestyle in relation to dementia incidence. Neurology 2009; 72 (3): 253–259.
- Potter G. G., Steffens D. C. Contribution of depression to cognitive impairment and dementia in older adults. Neurologist 2007; 13 (3): 105–117.
- Zakzanis K. K., Graham S. J., Campbell Z. A meta-analysis of structural and functional brain imaging in dementia of the Alzheimer’s type: a neuroimaging profile. Neuropsychol Rev 2003; 13 (1): 1–18 : 189–198.
- Kokmen E., Smith G. E., Petersen R. C., et al. The short test of mental status: correlations with standardized psychometric testing. Arch Neurol 1991; 48 (7): 725–728.
- Morris J. C., Weintraub S., Chui H. C., et al. The Uniform Data Set (UDS): clinical and cognitive variables and descriptive data from Alzheimer disease centers. Alzheimer Dis Assoc Disord 2006; 20 (4): 210–216.
- Knopman D. S., DeKosky S. T., Cummings J. L., et al. Practice parameter: diagnosis of dementia (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2001; 56 (9): 1143–1153.
- Roberson E. D., Scearce-Levie K., Palop J. J., et al. Reducing endogenous tau ameliorates amyloid beta-induced deficits in an Alzheimer’s disease mouse model. Science 2007; 316 (5825): 750–754.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



