-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPacient s neuropatickou bolestí v ordinaci praktického lékaře
Datum publikace: 3. 12. 2018
Úvod
Bolest je všeobecně vnímána jako závažný a kvalitu života zhoršující symptom, který vyžaduje zájem lékařů i ošetřovatelského personálu. Na straně druhé je ovšem i varovným signálem, který organismus chrání před závažným poškozením tělesných tkání. V klinické praxi je nutné akceptovat, že bolest je to, co sám pacient za bolest považuje, v místech, kam sám ukazuje.
Typy bolestí
Z časového hlediska rozlišujeme bolest akutní a chronickou. Akutní bolest se vyznačuje náhlým začátkem, trvá hodiny až dny a je projevem poškození tkání. Bývá provázena dalšími projevy, jako je pocení, zrychlený tep, rozšíření zornic, a je spojena se strachem či úzkostí. Chronická bolest trvá déle než 3–6 měsíců. Její příčina nebývá vždy jasná, provází ji změny psychiky (úzkostné stavy, deprese, změny osobnosti) a nemá funkci varovného signálu, tj. sama se stává nemocí.
Intenzita bolesti je dle Světové zdravotnické organizace (WHO) klasifikována do 6 stupňů:
0 = žádná bolest;
1 = mírná bolest neovlivňující funkce;
2 = vnímaná a obtěžující bolest, která již ovlivňuje funkce, ale umožňuje aktivity nutné k životu;
3 = silná, stresující bolest, která již ohrožuje aktivity nutné k životu;
4 = velmi silná, nesnesitelná bolest;
5 = zničující bolest.
Z hlediska patofyziologického lze bolest rozdělit na nociceptivní (nociceptorovou) a neurogenní (neuropatickou). Nociceptivní bolest se dělí na somatickou a viscerální.
Somatická bolest vzniká drážděním nebo senzibilizací nociceptorů v kůži nebo podkožních tkáních, fasciích či periostu. Receptory mohou být drážděny mechanicky či chemicky (bradykinin, prostaglandin, histamin). Somatická bolest se vyznačuje dobrou lokalizovatelností, tj. pacient je obvykle schopen bolestivé místo ukázat prstem.
Naopak viscerální bolest vzniká v důsledku dráždění receptorů v orgánech dutiny břišní či hrudní při jejich kompresi nebo při distenzi jejich pouzdra. Tento typ bolesti bývá často provázen nevolností a řadou dalších vegetativních příznaků. Viscerální bolest je obvykle obtížně lokalizovatelná. Na složitosti fenoménu chronické viscerální bolesti se podílejí všechny faktory typické pro chronickou bolest (vlivy psychosociální, psychosomatické, ekonomické, existenční) a faktory specifické (anatomické a patofyziologické zvláštnosti v inervaci útrob: somatoviscerální konvergence v ose mozek – mícha, excesivní viscerální divergence v CNS, mechanismy sekundární hyperalgezie, přenesené bolesti a viscerální hypersenzitivita).
Neuropatická bolest
Základní charakteristika neuropatické bolesti
Neuropatická bolest (dále jen „NB“) je častým problémem mnoha neurologických onemocnění. Může se vyskytovat u heterogenní skupiny poruch postihujících periferní i centrální nervový systém. Mezi hlavní příčiny u periferního typu NB patří fokální i systémové neuropatie, hlavními příčinami centrálních bolestí jsou míšní léze, roztroušená skleróza mozkomíšní a stavy po iktu. NB nevyžaduje aktivaci receptorů bolesti, i když současná stimulace může tuto bolest zvýrazňovat. Jde o patologický stav, který nemá žádný protektivní význam. Od roku 2008 platí revidovaná definice NB, podle které tato bolest vzniká v přímém důsledku léze nebo onemocnění postihujícího somatosenzitivní systém. Předpokládá se léze, která postihuje tenká vlákna periferních nervů a spinothalamokortikální dráhy, jež se podílejí na vedení bolesti.
Přesná epidemiologická data, zejména pro Českou republiku, nejsou k dispozici. Odhaduje se, že až 25 % pacientů v ambulancích pro léčbu bolesti trpí NB a její incidence v populaci činí až 1 %. Se zvyšujícím se věkem výskyt a závažnost NB dále rostou. Až 50 % NB postihuje jedince ve věku nad 70 let. NB se rozvíjí asi po 5 % všech úrazů periferních nervů, je častou komplikací metabolických polyneuropatií, vyskytuje se až u 50 % pacientů s diabetickou neuropatií starších 60 let. Navazuje i na infekce periferního nervového systému, postihuje třetinu pacientů v manifestní fázi infekce HIV, podobně je tomu u borreliové radikulitidy a herpes zoster. Centrální NB postihuje asi 8 % pacientů s ischemickou CMP, častější je u míšního nebo multifokálního postižení CNS, postihuje až 30 % osob trpících roztroušenou sklerózou. U syringomyelie je NB spíše pravidlem než výjimkou – vyskytuje se u 75 % postižených.
Nizozemská populační studie (Dieleman et al.) prokázala roční incidenci NB 8,2/1000 obyvatel, nejčastější příčinou byly mononeuropatie, zejména syndrom karpálního tunelu (4,3/1000), dále diabetická polyneuropatie (0,72/1000) a postherpetická neuralgie (0,42/1000). NB byla častější u žen a ve věkovém rozmezí 70–79 let.
Tab. 1. Přehled hlavních příčin neuropatické bolesti 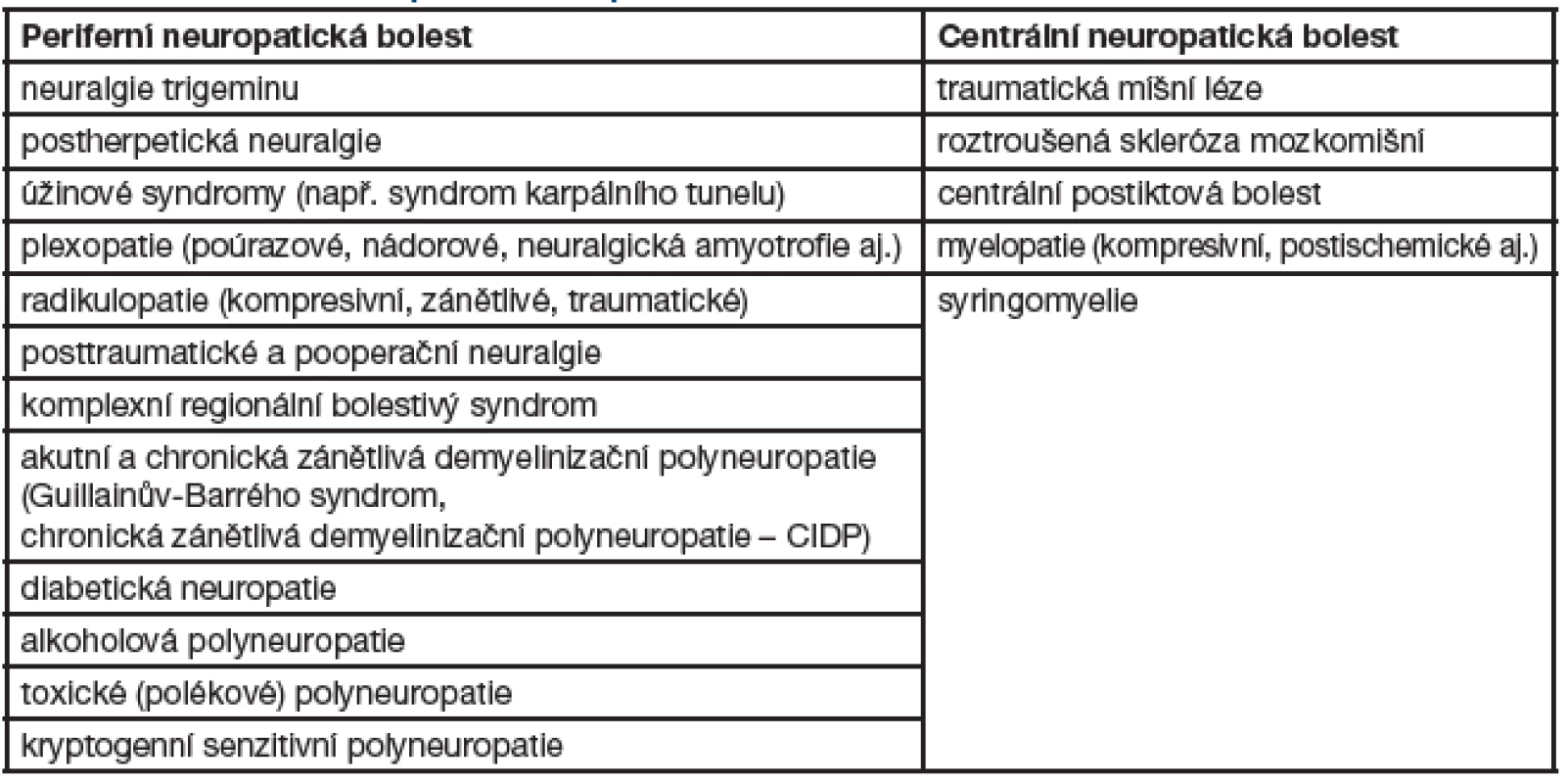
Význam neuropatické bolesti není ochranný a příčina nebývá ihned patrná. Pokud bolestivé impulzy proudí do mozku delší dobu, vzniká v některých strukturách nervového systému stav trvalého podráždění. Jeho důsledkem je pak zkreslené vnímání podnětů v organismu, tj. dosud nebolestivé podněty (např. dotek vatovým smotkem) jsou vnímány jako bolestivé (alodynie), jindy je podnět nepřiměřeně bolestivý (hyperalgezie).
Systém odstupňování diagnostické spolehlivosti přítomnosti NB
- Charakter a distribuce bolesti odpovídají NB.
- Přítomna léze nebo onemocnění postihující periferní nebo centrální somatosenzitivní systém se vztahem k NB.
- Prokázány pozitivní nebo negativní senzitivní příznaky postihující některou ze senzitivních modalit přenášených somatosenzitivním systémem a odpovídající základnímu onemocnění či lézi.
- Prokázána etiologicky relevantní onemocnění nebo léze somatosenzitivního systému v distribuci odpovídající bolesti.
- Pokud bolest u daného pacienta splňuje první dvě diagnostická kritéria, je diagnóza NB možná. Pokud jsou splněna všechna 4 kritéria, je diagnóza NB bolesti jistá. Některé chronické bolestivé syndromy mohou mít jak nociceptivní, tak i neuropatickou komponentu. Jde tedy o smíšenou bolest (viz např. chronický lumboischiadický syndrom).
Klinický obraz NB
- Periferní NB
Projevuje se změnou citlivosti ve smyslu hyperestezie, hyperalgezie, dysestezie, parestezie, alodynie, hypestezie až anestezie. Dalšími symptomy jsou spontánní senzace bez ovlivnění podnětem (dysestezie, mravenčení, brnění, pálení, pocity chladu a tepla). NB může být spojena s poruchou motorické funkce ve smyslu ochablosti či spasticity. Pocity elektrického výboje nebo lancinující bolesti se mohou spontánně objevovat u jakékoliv NB.
- Centrální NB
Neuralgické bolesti (trigeminus, n. glossofaryngeus) jsou charakterizované záchvatovitou vystřelující, lancinující bolestí a nemusí být přítomna trvalá bolest. Ta bývá konstantně u postherpetické neuralgie se všemi ostatními klinickými projevy popsanými výše.
Léčba NB
Základem úspěchu léčby NB je její správná diagnóza. Nemocného je nutné pečlivě vyšetřit a rozlišit typ bolesti (nociceptivní nebo neuropatickou, případně kombinaci obou faktorů). Důležité je, aby byl zvolen lék 1. volby podle žádaného efektu i možných nežádoucích účinků (risk and benefit ratio). Rovněž je třeba zohlednit přidružené komorbidity a podávat léky v dostatečné dávce. Vždy je nutné začínat léčbu malou dávkou a titrovat dle tolerance. Pacient musí být poučen o případných nežádoucích účincích léků. Neúčinnost léčby lze konstatovat až při dosažení terapeutické dávky. Kombinací léků lze docílit většího efektu než při monoterapii.
U převážné většiny pacientů s NB představují léčbu 1. volby adjuvantní analgetika, tj. léky, které neobsahují paracetamol (acetaminofen) a nejsou řazeny k nesteroidním antiflogistikům ani opioidům. Adjuvancia nejsou formálně klasifikována jako analgetika, protože jejich primární indikací jsou většinou jiná onemocnění či poruchy. Většina adjuvancií jsou neuroaktivní substance působící na centrální či periferní nervový systém. V klinické praxi jsou v léčbě neuropatické bolesti využívána tricyklická antidepresiva, antiepileptika, antikonvulziva, antidepresiva ze skupiny SNRI, slabé a silné opioidy a svalová relaxancia.
Základem pro zkoušení nových léků jsou tři klinické syndromy NB:
- postherpetická neuralgie (PHN),
- diabetická polyneuropatie (DPN),
- neuralgie trigeminu (NT).
Pro PHN je schválené doporučení gabapentin a pregabalin a 5% lidokainová náplast, pro DPN duloxetin a pro NT karbamazepin jako léky 1. volby. Pro léčbu NPB jsou klíčové 3 skupiny léků: antidepresiva, antiepileptika a opioidy. Další skupinu tvoří rozmanité léky podporující analgetický účinek nebo ovlivňující přidružené symptomy či nežádoucí účinky podávaných léků.
ANTIDEPRESIVA
Tricyklická antidepresiva (TCA)
Terciární aminy (amitriptylin, imipramin) působí na několika místech nervové soustavy, inhibují zpětné vstřebávání noradrenalinu a serotoninu. Sekundární aminy více inhibují reuptake noradrenalinu. Obě skupiny však mají další mechanismy účinku, nejdůležitější je anticholinergní efekt, dále působí alfa-adrenergní blokádu, inhibici zpětného vychytávání dopaminu, ovlivňují kyselinu gama-aminomáselnou, blokují receptory NMDA a významně inhibují sodíkové kanály. Sekundární aminy (desipramin, dosulepin) mají méně nežádoucích účinků.
Analgetický efekt TCA nesouvisí s antidepresivním působením. Jsou indikována jako první volba pro všechny neuropatické bolesti s výjimkou NT. Obvykle se začíná malou dávkou, 10–25 mg denně ve večerních hodinách. Dle efektu a nežádoucích účinků je možné dávku zvyšovat, maximální dávka bývá 75–150 mg.
TCA však mají řadu závažných nežádoucích účinků: xerostomie, obstipace, sedace, ortostatická hypotenze, retence moči, prodlužení intervalu QT vedoucí až k rozvoji srdeční arytmie, dále nárůst tělesné hmotnosti a sexuální dysfunkce. Terciární aminy jsou zatíženy častějšími a závažnějšími nežádoucími účinky, proto by TCA neměla být ordinována nemocným vyšších věkových kategorií a nemocným s glaukomem s uzavřeným úhlem.
SSRI
Selektivní inhibitory zpětného vychytávání serotoninu (citalopram, paroxetin, sertralin) mají menší analgetický účinek než TCA. Paroxetin u pacientů s diabetickou PN prokazoval větší účinek než placebo, ale menší než imipramin. Mezi nejčastější nežádoucí účinky SSRI patří nauzea, sedace, obstipace, nárůst tělesné hmotnosti a sexuální dysfunkce.
SSRI nemají preskripční omezení, praktičtí lékaři je mohou předepisovat.
SNRI
Inhibitory zpětného vychytávání serotoninu a noradrenalinu (venlafaxin, duloxetin) mají větší analgetický efekt u NB. Duloxetin je FDA registrován pro léčení DPN. Venlafaxin se dobře uplatňuje v kombinaci s dalšími léky. Jsou bezpečné i u pacientů vyšších věkových kategorií. Nežádoucí účinky SNRI jsou obdobné jako u SSRI. Ve srovnání s TCA jsou nežádoucí účinky méně časté a mírnější.
SNRI mají preskripční omezení, praktičtí lékaři je nemohou předepisovat.
ANTIKONVULZIVA
NB má stejně jako epilepsie základ v hyperexcitabilitě nervového systému. Z toho vychází možnost využití antiepileptik pro léčbu NB. Mezi nejpoužívanější patří karbamazepin a fenytoin.
Fenytoin se kvůli četným nežádoucím účinkům (poruchy paměti a koncentrace, hirsutismus, periferní neuropatie, gingivální hypertrofie) využívá pro léčení NPB méně. Je možno ho podávat parenterálně, takže výjimečně by mohl být nasazen u těžkých NPB.
Karbamazepin působí na napěťově řízené sodíkové kanály. Méně působí na vápníkové kanály
a inhibuje receptory NMDA. Svou strukturou je podobný TCA. Je 1. volbou léčby neuralgie trigeminu. U ostatních neuropatií je až 2. volbou. Mezi nežádoucí účinky karbamazepinu patří sedace, vertigo, nauzea, retence tekutin, elevace jaterních transamináz, poruchy krvetvorby, poruchy srdečního rytmu a četné interakce s jinými léky na podkladě indukce cytochromu P450.Karbamazepin nemá preskripční omezení, praktičtí lékaři jej mohou předepisovat.
Oxkarbazepin je derivát karbamazepinu. V léčbě bolesti se zatím užívá málo, dle některých studií lépe působí na neuralgii trigeminu a jeho výhodou je menší výskyt nežádoucích účinků. Pravděpodobně výrazněji ovlivňuje vápníkové kanály. Indikacemi jsou neuralgie trigeminu a DPN. Jeho nežádoucí účinky jsou podobné karbamazepinu, ale méně časté a mírnější.
Oxkarbazepin nemá preskripční omezení, praktičtí lékaři jej mohou předepisovat.
Kyselina valproová a její sodná sůl jsou antiepileptiky 2. generace. Působí na typ T vápníkových kanálů, zvyšují koncentraci GABA, inhibují sodíkové kanály a zvyšují vodivost draslíkových kanálů. Nejčastěji se u chronické bolesti užívají jako profylaxe migrenózních záchvatů a dále tam, kde není dostatečně účinný karbamazepin. Je možno je podat intravenózně, např. při záchvatu migrény. Dávkování v pomalé titraci podle snášenlivosti, efektu a hmotnosti je 150–500 mg/den. Mezi nežádoucí účinky valproátu patří reverzibilní alopecie, sedace a hepatotoxicita.
Valproát nemá preskripční omezení, praktičtí lékaři jej mohou předepisovat.
Gabapentin je v současné době doporučován jako lék 1. volby pro téměř všechny NB vyjma neuralgie trigeminu a cefaley. Blokuje vápníkové kanály, ovlivňuje sodíkové kanály a zvyšuje vyplavování GABA, ale neváže se na receptor GABA. Výhodou je, že není metabolizován v játrech.
Indikací jsou v první řadě PHN, DPN, ale také fantomové bolesti a ostatní NB nádorové i nenádorové etiologie. Dávkování je v pomalé titraci od 100 mg s počáteční večerní dávkou. U mladších jedinců lze zvolit rychlejší titraci od 300 mg denně. Účinná dávka gabapentinu se pohybuje od 900 mg/den, je možné stoupat až do dávky 3600 mg/den ve 3–4 dílčích dávkách denně.
Mezi nežádoucí účinky gabapentinu patří ospalost, závratě, únava, obstipace, xerostomie, sedace, otoky dolních končetin způsobené periferní vazodilatací a nárůst tělesné hmotnost.
Gabapentin nemá preskripční omezení, praktičtí lékaři jej mohou předepisovat.
Pregabalin reguluje aktivitu vápníkových kanálů, čímž dochází k redukci uvolňování substance P, CGRP a glutamátu, tlumí aktivované vápníkové kanály. Pregabalin se v porovnání s gabapentinem vyznačuje větší afinitou ke specifické podjednotce vápníkového kanálu a má lepší farmakokinetický profil. Není metabolizován enzymy cytochromu P450 a není induktorem ani inhibitorem metabolizátorů. Vzhledem k tomu, že je analgeticky účinný tam, kde byl gabapentin rezistentní, s velkou jistotou se předpokládají další mechanismy působení pregabalinu – např. přímo ovlivňuje uvolňování neurotransmiterů na synapsích.
Pregabalin tlumí bolestivou diabetickou DPN, zlepšuje spánek, úzkost, depresi, je dobře snášen a je možné ho relativně rychle titrovat do účinné dávky. Zahajovací dávka činí 75–150 mg denně ve večerních hodinách. Maximální účinná dávka je 600 mg denně. Pregabalin je indikován v léčbě PHN a DPN.
Mezi nežádoucí účinky patří ospalost, vertigo, snížení libida, xerostomie, obstipace a periferní otoky. Po jeho náhlém vysazení se může objevit deprese, bolest, průjem, pocení nebo nervozita.
Pregabalin nemá preskripční omezení, praktičtí lékaři jej mohou předepisovat.
Lamotrigin je antiepileptikum, které se pro léčení NB indikuje relativně zřídka. Vyžívá se spíše u pacientů s centrální bolestí postiktovou, thalamickou a tam, kde dosavadní léčba neměla dostatečný účinek. Další možností užití je HIV neuropatie a DPN, v kombinaci s fenytoinem nebo karbamazepinem pak i neuralgie trigeminu.
Mechanismus účinku, stejně jako u ostatních antiepileptik, je na úrovni sodíkových a vápníkových kanálů, kde blokuje uvolňování excitačních aminokyselin a zvyšuje GABA. Dávkování se pohybuje mezi 25 a 100 mg 1–2× denně, v závislosti na dávce. V kombinaci s valproátem a jinými induktory musejí být dávky sníženy.
Mezi nejčastější nežádoucí účinky patří makulopapulózní exantém. Vzniká po rychlém zvyšování dávky a překročením doporučené dávky nebo při současném užívání valproátu. Dalším nežádoucím účinkem je cefalea. Nepůsobí sedaci a neovlivňuje kognitivní funkce.
Lamotrigin má preskripční omezení, praktičtí lékaři jej nemohou předepisovat.
OPIOIDY
Oxykodon je potentní opioid s agonistickým účinkem na μ receptory a agonistickým efektem na κ receptory. Je 2. volbou léčby NB po amitriptylinu (TCA) a gabapentinu nebo pregabalinu. Má prodloužené uvolňování účinné látky, a tudíž je nutné podávat ho v pravidelných dvanáctihodinových intervalech. Protože NB se v noci často projevuje větší intenzitou, může být nezbytné asymetrické dávkování s vyšší dávkou večer. Nevykazuje interakce s jinými léky, v kombinaci s SSRI může vyvolat serotoninový syndrom, protože i opioidy mírně inhibují reuptake serotoninu.
Buprenorfin je potentní μ opioid s antagonistickým působením na κ receptor. Vyznačuje se silnou vazbou na receptor a menší vnitřní aktivitou. Má prodloužený účinek, takže je možné měnit náplasti po 96 hodinách. Titruje se velmi pomalu, s ohledem na své dlouhé působení. Je velmi dobře snášen i starými pacienty. Méně často působí zácpu, je vhodný i při zažívacích problémech
Mezi časté nežádoucí účinky potentních opioidů patří sedace, nauzea, zmatenost, halucinace (zvláště při rychlé titraci nebo rychlém odnětí v rámci odvykacího syndromu) a zácpa. Vyjma zácpy většina příznaků během titrace odezní. V současné době je k dispozici oxykodon kombinovaný s naloxonem, který má za úkol právě sklon k zácpě eliminovat.
Tramadol je slabý opioid s účinkem na receptory μ, zvyšuje hladinu serotoninu a noradrenalinu na synapsích blokádou zpětného vstřebávání. Je k dispozici ve všech formách, perorálních i injekčních, s pomalým i rychlým uvolňováním. Indikován je především v léčbě DPN. Jeho dávka se obvykle titruje od 50 mg denně. Zahájení vyšší dávkou může mít za následek rozvoj nežádoucích účinků, hlavně nevolnost a zvracení. Účinná denní dávka je 100–400 mg. Vyšší dávky jsou analgeticky neúčinné, protože tramadol má stropový efekt.
Mezi nežádoucí účinky tramadolu patří nauzea a zvracení, ospalost a sklon k obstipaci. V kombinaci se SSRI může vyvolat serotoninový syndrom a z tohoto důvodu se ani nedoporučuje kombinace se silnými opioidy. Není vhodný u pacientů se sklonem ke křečím.
LOKÁLNÍ LÉČBA
Lidokain v 5% koncentraci v náplasti je užíván hlavně pro PHN. Působí blokádu natriových kanálů, a navíc může být dobrou ochranou při alodynii, která často provází PHN.
Kapsaicin lokálně podaný zvyšuje práh bolesti, působí na vaniloidní receptory a tlumí uvolňování substance P z nemyelinizovaných C vláken. Aplikuje se v krému či náplasti.
Lokální léčba má preskripční omezení, praktičtí lékaři tyto preparáty nemohou předepisovat.
MYORELAXANCIA
Baklofen jakožto svalové relaxans je využíván hlavně tam, kde se na rozvoji NB účastní svalové spasmy. Jeho nejčastější indikací je neuralgie trigeminu. Dávkuje se až do maxima 80–100 mg denně.
Baklofen nemá preskripční omezení, praktičtí lékaři jej mohou předepisovat.
Doplňky stravy v léčbě neuropatické bolesti
Jedním z dostupných kvalitních doplňků stravy v léčebném ovlivnění NB je preparát Neuritogen® (Angelini). Jedná se o doplněk stravy s obsahem kurkuminu, resveratrolu, extraktu z Mangifera indica a vitaminů B2 a B6 ve formě s usnadněným vstřebáváním. Pozitivní ovlivnění intenzity vnímání NB spočívá u Neuritogenu v jeho významném antioxidačním a neuroprotektivním účinku.
Tento efekt dokládá i dvouměsíční sledování v České republice u pacientů s bolestivou diabetickou neuropatií, kteří tento preparát užívali v dávce 2 tbl. denně. Bylo prokázáno, že statisticky vysoce významně poklesla intenzita vnímané bolesti na vizuální analogové škále. Dalším sledovaným parametrem byla kvalita života hodnocená mezinárodním generickým dotazníkem EuroQol EQ-5D, která během sledování stoupala statisticky vysoce významně. Stejnou statistickou významnost vykázal i vzestup na vizuální analogové škále EQ-VAS, hodnotící aktuální zdravotní stav pacientů účastnících se studie. Zajímavé je zjištění, že pozitivní efekt byl zaznamenán jak u podskupiny pacientů, kteří byli doposud bez léčby, tak také u pacientů s již zavedenou léčbou antikonvulzivy, antidepresivy či jejich kombinací.
Závěr
Léčba NB má svá vlastní specifika. Nejen v ordinacích praktických lékařů, ale i ve specializovaných ambulancích se vlivem stárnutí populace budeme s tímto typem bolesti setkávat stále častěji. Proto je nutné, abychom si uvědomili, že při léčbě tohoto typu bolesti hraje velmi výraznou roli doba od prvního výskytu bolesti do zahájení terapie. Dále je nutné si uvědomit, že NB a její léčba má dvě zásadní úskalí: 1. šance na ovlivnění letitých NB je minimální, 2. existují preskripční omezení léků 1. volby v léčbě NB pro praktické lékaře, což má za následek významně limitovaný výběr léků v terapii NB. V případě, že nebudeme v léčbě NB úspěšní nebo budeme mít vyčerpány její stávající možnosti, pamatujme na to, že existují ambulance léčby bolesti.
- Ambler Z. Neuropatická bolest a současné možnosti její farmakologické léčby, Bolest 2000; 3 : 17–21.
- Attal N., Cruccu G., Haanpää M., et al. EFNS guidelines on pharmacological treatment of neuropathic pain. Eur J Neurol 2006; 13 : 1153–1169.
- Backonja M. M., Serra, J. Pharmacologic management part 1: Better-studied neuropathic pain diseases. Pain Med 2004; 5: S28–S47.
- Backonja M. M., Serra, J. Pharmacologic management part 2: Lesser-studied neuropathic pain diseases. Pain Med 2004; 5: S47–S59.
- Baron R., Binder A., Wasner G. Neuropathic pain: diagnosis, pathophysiological mechanisms, and treatment. Lancet Neurol 2010; 9 : 807–819.
- Bednařík J., Vlčková-Moravcová E., Buršová Š. et al. Etiology of small-fiber neuropathy. J Peripher Nerv Syst 2009; 14 : 177–183.
- Belgrade M. J. Following the clues to neuropathic pain. Postgrad Med 1999; 106 (6): 127–140.
- Cruccu G., Truini A. Neuropathic pain and its assessment. Surg Oncol 2010; 19 : 149–154.
- Černý, R., Slíva, J., Kozák J. Farmakoterapie neuropatické bolesti. Maxdorf, Praha, 2011.
- Devor M. Strategies for finding new pharmacological targets for neurophatic pain. Curr Pain Headache Rep 2004; 8 : 187–191.
- Dieleman J. P., Kerklaan J., Huygen F. J. P. M. et al. Incidence rates and treatment of neuropathic pain conditions in the general population. Pain 2008; 137 (3): 681–688.
- Dolin S., Padfield N., Pateman J. Pain Clinic Manual. Butterworth Heinemann, Oxford, 1997 : 38.
- Dworkin R. H., Backonja M., Rowbotham M. C. Advances in neuropathic pain: diagnosis, mechanisms and treatment recommendations. Arch Neur 2003; 60 : 1524–1535.
- Dworkin R. H. An overview of neuropathic pain: syndromes, symptoms, signs and several mechanisms. Clin J Pain 2002; 18 : 343–9.
- Dworkin R. H., O’Connor A. B., Bacackonjanjanja M. et al. Pharmacologic management of neuropathic pain: evidence-based recommendations. Pain 2007; 132 : 237–251.
- Eisenberg E., McNicol E. D., Carr D. B. Efficacy and safety of opioid agonists in the treatment of neuropathic pain of nonmalignant origin. Systematic review and meta-analysis of randomised controlled trials JAMA 2005; 293 : 303–3052.
- Finnerup N. B., Otto H. J., McQuay H. J., et al. Algorithm for neuropathic pain treatment: an evidence-based proposal; Pain 2005; 118 : 289–305.
- Finnerup N. B. A review of central neuropathic pain states. Curr Opin Anaesthesiol 2008; 21 : 586–589.
- Finnerup N. B., Sindrup S. H., Jensen T. S. The evidence for pharmacological treatment of neuropathic pain. Pain 2010; 150 : 573–581.
- Griessinger N., Sittl R., Likar R. Transdermal buprenorphine in clinical practice – a post-marketing surveillance study in 13 179 patients. Curr Med Res Opin 2005; 21 : 1147–1156.
- Guastella V., Mick G., Soriano C. et al. A prospective study of neuropathic pain induced by thoracotomy: Incidence, clinical description, and diagnosis. Pain 2011; 152 : 74–81.
- Hakl M. Léčba neuropatické bolesti. Neurologie pro praxi 2016; 17 (2): 113–116.
- Hansson P. Neuropathic pain: clinical characteristics and diagnostic workup. Eur J Pain 2002; 6 (Suppl. A): 47–50
- Chlup R., Podivínský J., Masnikosová D. Viscerální bolest a viscerální neuropatie. Česká geriatrická revue 2008; 6 : 40–46.
- ICHD-IL Part 3: Cranial neuralgias, central and primary facial pain and other headaches. Cephalalgia 2004; 24 (Suppl. 1): 126–135.
- Jackson K. C. Pharmacotherapy for neuropathic pain. Pain Pract 2006; 6 : 27–33.
- Kumar B., Kalita J., Kumar G. et al. Central poststroke pain: a review of pathophysiology and treatment. Anesth Analg 2009; 108 : 1645–1657.
- Neuritogen. Dostupné na: www.angelini.cz/wps/wcm/connect/cz/home/produkty/volne-prodejne-produkty/neuritogen-tablety
- Opavský J., Černý R. Neurologické aspekty bolesti, neuropatické bolesti. Bolest 2000; Suppl. 1 : 70–76.
- Otruba P. Neuritogen a diabetická neuropatická bolest. DMEV 2015, 18 (2): 61–8.
- Rehm S., Binder A., Baron R. Post-herpetic neuralgia: 5% lidocaine medicated plaster, pregabalin, or a combination of both? A randomized, open, clinical effectiveness study. Curr Med Res Opin 2010; 26 : 1607–1619.
- Rokyta R., Kršiak M., Kozák J. (eds.). Bolest. Tigis, Praha, 2006.
- Semel D., Murphy T. K., Zlateva G. et al. Evaluation of the safety and efficacy of pregabalin in older patients with neuropathic pain: results from a pooled analysis of 11 clinical studies. BMC Fam Pract 2010; 11 : 85.
- Sindrup S. H., Jensen T. S. Efficacy of pharmacological treatments of neuropathic pain: an updated and effect related to mechannism of drug action. Pain 1999; 83 : 389–400.
- Sommer C. Painful neuropathies. Curr Opin Neurol 2003; 16 : 623–628.
- Stacey B. R. Management of peripheral neuropathic pain. Am J Phys Med Rehabil 2005; 84: S4–S16.
- Ševčík P., Adam Z. Transdermální buprenorfin. Remedia 2006; 5 : 514–21.
- Toth C., Au S. A prospective identification of neuropathic pain in specific chronic polyneuropathy syndromes and response to pharmacological therapy. Pain 2008; 138 : 657–666.
- Vondráčková D., Lejčko J. Viscerální bolest a její léčba. Postgraduální medicína 2005; 4 : 12–15.
- Vondráčková D. Léčba bolesti. Pharmindex Brevíř. Psychiatrie, neurologie, léčba bolesti. Medical Tribune 2007 : 139–145.
- Votava M., Doležal T., Kozák J., Vondráčková D. Adjuvantní léčiva v terapii bolesti. In: Rokyta R., Kršiak M., Kozák J. (eds.). Bolest. Tigis, Praha, 2006 : 147–153.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




