-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaLéčba bolesti
Datum publikace: 26. 11. 2015
1. Úvod
Bolest patří mezi první vjemy, se kterými se člověk ve svém životě setkává a které ho doprovází po celou dobu jeho existence. Světová zdravotnická organizace (SZO) i Mezinárodní společnost pro léčbu bolesti (IASP) definují bolest jako „nepříjemný senzorický a emocionální prožitek spojený se skutečným či potencionálním poškozením tkání nebo zážitek, který je v termínech takového poškození popisován. Bolest je vždy subjektivní“.
Chronická bolest patří mezi nejrozšířenější medicínské problémy současnosti s výrazným socioekonomickým dopadem. Prevalence chronické bolesti v ekonomicky rozvinutých státech se udává kolem 20 %. Frekvence výskytu chronické bolesti v jednotlivých evropských zemích se liší jen mírně. Jedna z mála panevropských studií, provedená v roce 2006 v 15 evropských zemích a Izraeli, prokázala, že 19 % dospělého obyvatelstva má zkušenosti s dlouhodobou bolestí. Studie ze severských zemí hovoří o 24,2% výskytu chronické bolesti v Norsku a 20,2% výskytu ve Švédsku. Nejnižší výskyt je ve Španělsku, Irsku a Velké Británii (12–30 %), nejvyšší naopak v Itálii, Polsku a Norsku (26–30 %). Toto procento se v důsledku stárnutí populace postupně zvyšuje.
Obdobné výsledky ukazují i studie prováděné na populaci v České republice, jedno z mála českých sledování udává, že bolest je důvodem asi 20 % návštěv u praktického lékaře.
Dopady chronické bolesti výrazně negativně ovlivňují kvalitu života pacientů: 27 % lidí s chronickou bolestí se cítí kvůli její přítomnosti sociálně izolováno, 50 % z nich si myslí, že bolest výrazně ovlivňuje jejich vztahy s okolím, 29 % se obává v důsledku bolesti ztráty zaměstnání a 36 % udává, že chronická bolest má vliv na jejich rodinný život.
2. Patofyziologie bolesti
Pro správnou volbu terapeutického plánu, který zahrnuje efektivní farmakoterapii, tj. volbu analgetika, popř. analgetickou kombinaci, fyzioterapii a psychologickou péči, je důležité rozlišovat mezi bolestí akutní, chronickou, nociceptivní, neuropatickou, psychogenní a smíšenou.
Dělení bolesti
Nociceptivní bolest vzniká podrážděním nociceptorů, zahrnujících nocisenzory (volná nervová zakončení v tkáních, aktivují se pouze při bolestivé stimulaci), mechanosenzory (Vaterova–Paciniho tělíska) a polymodální receptory (reagují na teplo a chlad). Podle umístění receptorů rozlišujeme bolest somatickou a viscerální. K nociceptivní bolesti řadíme bolesti pohybového aparátu (osteoartrózy, artritidy, degenerativní změny páteře), bolesti vnitřních orgánů a většinu stavů akutní bolesti. Ve farmakoterapii nociceptivní bolesti jsou léky první volby analgetika.
Neuropatická bolest je způsobená lézí nebo dysfunkcí somatosenzorického nervového systému. Podle lokalizace poškození dělíme neuropatickou bolest na centrální, vznikající poškozením centrálního nervového systému, a periferní, vznikající v důsledku periferní nervové léze.
Podle dalšího dělení rozlišujeme neuropatickou bolest stimulovanou a bolest spontánní. Mezi stimulované bolesti patří alodynie (bolest vyvolaná podnětem, který ji za normálních okolností nevyvolává) a hyperalgezie (snížení prahu pro bolest v postižené oblasti). Spontánní bolestivé stavy podle průběhu v čase dělíme na kontinuální, intermitentní a paroxysmální. Neuropatická bolest je obvykle ohraničena příslušnou inervační oblastí a bývá spojena se senzitivním deficitem, hyperpatií a alodynií. Neuropatická bolest může časově navazovat na neurogenní lézi, stejně tak se však může objevit s časovou prodlevou. Pacienti nejčastěji charakterizují bolest jako ostrou, palčivou, vystřelující nebo bodavou. Velmi často je udáváno noční zhoršení bolesti.
Smíšená bolest zahrnuje stavy, na kterých se podílí více předchozích typů bolesti. V praxi se nejčastěji setkáváme s FBSS (failed back surgery syndrome) – bolestí po operaci bederní páteře. V oblasti zad trpí pacienti nociceptivní složkou bolesti, v distribuční oblasti postižených nervových kořenů naopak převažuje neuropatická složka. Mezi možné etiologické komponenty patří epidurální fibróza a adhezivní arachnoiditis. Terapie se odvíjí od převažující účasti jednotlivých složek. Léčba je často velmi složitá a uplatňují se zde i metody invazivní (kaudální blokády, neuromodulace).
Psychogenní bolest je bolest bez organické příčiny, bez palpačního nálezu bolestivých změn, s projevy bolestivého chování. Nejčastěji je výsledkem dlouhodobého psychického strádání jakéhokoliv původu, prožitých traumat, neřešených psychických potíží a intrapsychických konfliktů nebo je součástí psychiatrického onemocnění (součást psychotického obrazu, endogenní deprese, poruchy osobnosti – např. hysteroidní, hypochondrická). Základ terapie tvoří psychofarmaka a psychoterapie.
Akutní bolest je zpravidla náhle vzniklý bolestivý stav trvající několik hodin, dnů, výjimečně týdnů. Akutní bolest je „fyziologická“, plní svoji základní ochrannou funkci organismu, kdy slouží jako signál probíhajícího onemocnění nebo poškození. Akutní bolest bývá dobře lokalizovatelná, ostrého až palčivého charakteru, řadíme k ní bolest pooperační, traumatickou, porodní a bolest při některých vnitřních onemocněních. Akutní bolest má výrazný vliv na celý organismus, aktivuje sympatikus, aktivuje neuroendokrinní, imunitní a zánětlivé reakce, katabolismus, imunosupresi, zvyšuje spotřebu kyslíku myokardem, snižuje motilitu gastrointestinálního traktu a podílí se na řadě dalších změn (akutní stresová odpověď organismu).
Chronická bolest. Zatímco akutní bolest je symptomem probíhajícího onemocnění, chronická bolest se stává sama nemocí – syndromem. Cílem léčebných postupů u chronické bolesti nemusí být nutně úplné uzdravení jedince, ale zvýšení kvality života spočívající především v zajištění bolestí nerušeného spánku a obnovení funkční zdatnosti v oblasti fyzické, psychické i sociální (obdobně jako při chronické stresové odpovědi organismu).
3. Léčba bolesti
Léčba bolesti zahrnuje kombinaci farmakologických a nefarmakologických léčebných postupů.
Základem dobré léčby bolesti je důkladná anamnéza bolesti zahrnující intenzitu, lokalizaci, projekci, vyvolávající nebo zhoršující příčiny, charakter bolesti. Obzvláštní důraz je kladen na farmakologickou anamnézu, fyzikální vyšetření a znalosti všech vyskytujících se onemocnění.
U dlouhodobějších intenzivních bolestí zpravidla s pouhou farmakoterapií nevystačíme a je nutné zvolit multidisciplinární a multioborový přístup zahrnující spolupráci odborníků různých specializací. V terapii používáme kombinaci farmakoterapie a nefarmakologických léčebných metod, jako jsou invazivní léčebné postupy, psychoterapie, rehabilitace a další.
I přes širokou nabídku farmakoterapeutických možností se ne vždy daří uspokojivě vertebrogenní algický syndrom zvládnout tak, aby si pacient zachoval alespoň dobrou kvalitu života a byl schopen nadále běžně v životě fungovat se zachovalou funkční kapacitou. Jednou z hlavních příčin této frustrace je rozdělení mezi jednotlivé odbornosti, které mezi sebou nekomunikují. Léčba se spíše orientuje na biomedicínské řešení a opomíjí se psychosociální souvislosti, které se významnou měrou podílejí na rozvoji vertebrogenního chronického onemocnění.
Léčbou propojující specializovanou a sofistikovanou lékařskou péči, komplexní psychologickou péči, rehabilitační péči, kdy při vzájemné spolupráci jednotlivých odborníků dochází k zefektivnění péče ve smyslu snížení bolesti, snížení medikace, opakovaným návštěvám u lékařů, snížení zátěže zdravotnického systému a zvýšení pracovního potenciálu.
V současnosti bohužel v České republice neexistuje systémové propojení komplexní léčby vertebrogenního algického syndromu, při kterém by se na léčbě stejnou měrou podíleli neurolog, algeziolog, rehabilitační lékař, klinický psycholog, psychiatr a fyzioterapeut v rámci jednoho funkčního a komunikujícího týmu a společně by ordinovali individuální, na „tělo šitou“ komplexní terapii, která by vedla k efektivnějším výsledkům léčby. Komplexní, multimodální léčba by pacienta učila racionálně zacházet s bolestivým stavem a nabízela by možnost zvýšení funkční kapacity bez zbytečného nadužívání léků.
4. Farmakoterapie bolesti
Cílem léčby je zmírnění až odstranění bolesti, zvýšení funkční kapacity, zajištění nerušeného spánku a celkové zlepšení kvality života.
Strategie léčby bolesti vychází ze třístupňového žebříčku Světové zdravotnické organizace (WHO), publikovaného poprvé v roce 1986 a původně určeného pro léčbu bolesti onkologické. Záhy byl však zcela přejat pro léčbu bolesti neonkologické, akutní i chronické. Žebříček je tvořen třemi základními stupni terapie, první stupeň pro nejméně intenzivní bolest zahrnuje neopioidní analgetika, druhý stupeň pro intenzivnější bolest přidává k neopioidním analgetikům slabý opioid a ve třetím stupni je slabý opioid nahrazen opioidem silným. Celou terapii je možné doplňovat koanalgetiky (antikonvulziva, antidepresiva) pro léčbu specifických bolestivých stavů a adjuvantní medikací k potlačení nežádoucích účinků analgetik (antiemetika, laxativa). V indikovaných případech onkologické bolesti lze nově použít systém „elevátor“ (výtah), kdy při velmi intenzivní bolesti a předpokladu rychlého navyšování analgetik je možné druhý stupeň terapie (slabý opioid + neopioidní analgetikum) přeskočit a na neopioidní analgetika navázat přímo nízkou dávkou silného opioidu.
Třístupňový žebříček WHO
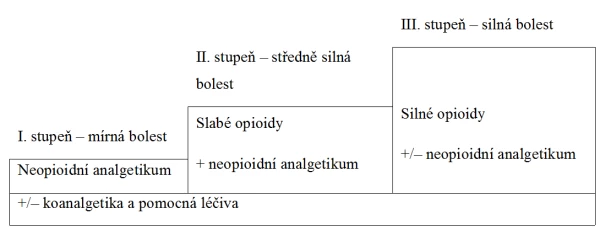
4.1. Neopioidní analgetika
Neopioidní analgetika tvoří chemicky různorodou skupinu. Ta zahrnuje paracetamol s metamizolem a skupinu nesteroidních antiflogistik (NSA).
Paracetamol – analgetikum bez protizánětlivého účinku. Doporučené dávkování je 500–1000 mg po 4–6 hodinách. Výraznější analgetický efekt dosahuje od 650 mg v jednotlivé dávce, nižší dávkování má převážně antipyretický účinek. Rychlost nástupu je 30 minut, maximální denní dávka je 4000 mg. Při vyšším dávkování hrozí riziko hepatotoxicity, která však není vyloučena ani při dlouhodobějším užívání dávek nižších než 2,5 g denně.
Metamizol je analgetikum s nástupem účinku 30 minut, obvyklé dávkování je 500 mg 4× denně. Vzhledem k riziku agranulocytózy je nevhodný k dlouhodobému podávání.
Nesteroidní antiflogistika
Princip účinku nesteroidních antiflogistik spočívá převážně v blokádě enzymů cyklooxygenázy (COX), která mění kyselinu arachidonovou na prostaglandiny. Existují dva izoenzymy – COX-1 a COX-2. Forma COX-1 je syntetizována v řadě orgánů (játra, ledviny, žaludeční sliznice, krevní destičky) a podílí se na jejich fyziologické funkci.
Dlouhodobé užívání NSA zvyšuje riziko ledvinného poškození a vznik ulcerací a krvácení v zažívacím traktu. Riziko krvácení je u seniorů 4× větší než u mladší části populace, vhodné je souběžné podávání antiulcerózní terapie. Většinou je doporučována redukce celkového množství NSA.
Pravidla používání neopioidních analgetik:
- Neopioidní analgetika jsou indikována v monoterapii k léčbě mírné a středně silné bolesti. Pro léčbu silné bolesti je třeba je vždy kombinovat s opioidy.
- Zvyšování dávek neopioidních analgetik nad uvedenou maximální denní dávku obvykle nevede k posílení analgetického účinku, ale ke zvýšení rizika závažných nežádoucích účinků.
- Existuje velká variabilita účinků (a nežádoucích účinků) jednotlivých analgetik u daného pacienta. Někdy je výhodné vyzkoušet jiné neopioidní analgetikum.
- Kombinace paracetamolu nebo metamizolu s nesteroidními antiflogistiky (NSA) zvyšuje analgetický účinek.
- Kombinace více nesteroidních antiflogistik není racionální a zvyšuje riziko nežádoucích účinků.
Přehled nejčastěji používaných neopioidních analgetik

4.2. Opioidní analgetika
Podle síly analgetického účinku se opioidy dělí na: a) slabé opioidy – dihydrokodein, kodein, tramadol, b) silné opioidy – morfin, piritramid, buprenorfin, fentanyl, oxykodon, hydromorfon, tapentadol a další.
Dělení opioidů na slabé a silné je používáno v praxi v rámci analgetického žebříčku WHO. Z farmakologického hlediska však patří všechny opioidy do jedné skupiny.
Slabé opioidy
Kodein je slabým μ-agonistou. V organismu je částečně biotransformován na morfin. Často je používán v kombinaci s paracetamolem.
Dihydrokodein je semisyntetický analog kodeinu. K dispozici je retardovaný dihydrokodein, který lze podávat v dávkách 60–120 (180) mg po 12, případně i 8 hodinách.
Tramadol vykazuje duální efekt, jednak působí jako slabý μ-agonista, jednak ovlivňuje zpětné vychytávání serotoninu a noradrenalinu v CNS. Na trhu je přítomen v řadě aplikačních forem, od injekční přes čípkovou až po tablety s bifázickým efektem a účinností 24 hodin (Noax uno).
Kombinace slabých opioidů s neopioidními analgetiky zvyšuje účinek obou s následnou možností snížit dávky. S tím souvisí omezení vedlejších účinků závislých na dávce.
Silné opioidy
Silné opioidy jsou zpravidla agonisty na µ-receptorech a jsou určeny pro silné, neztišitelné bolesti, které nelze dostatečně zmírnit neopioidními analgetiky nebo slabými opioidy. Maximální denní dávky silných opioidů nejsou striktně určeny a nejsou limitovány stropovým efektem. Postup určují pravidla pro léčbu opioidy u chronické nenádorové bolesti. V České republice jsou v současné době k dispozici tyto opioidy:
Morfin je klasickým standardem v léčbě silné bolesti. Injekční forma je vhodná pro léčbu silné akutní bolesti, per os SR formy s postupným uvolňováním působící 12 h nebo až 24 h jsou určeny pro chronickou bolest. Pro léčbu průlomové bolesti je vhodný morfin s bezprostředním uvolňováním (IR forma).
Fentanyl v transdermálním terapeutickém systému je vhodný pro léčbu silné chronické bolesti. Fentanyl je pro léčbu chronické bolesti dostupný v transdermální (TTS) formě. Výhodou TTS aplikačního systému je schopnost dosažení stabilní plazmatické hladiny a nižší výskyt nežádoucích účinků včetně zácpy. Určité potíže s autoaplikací TTS systému mohou mít senioři s poruchou zraku nebo třesem rukou. Ekvianalgeticky je fentanyl 100× silnější než morfin.
Hydromorfon je efektivní µ-agonista, lze jej uplatnit obecně v rámci rotace opioidů, k dispozici je v retardované, 12hodinové formě. Ekvianalgeticky je 5–7× silnější než morfin.
Oxykodon je další silný opioid určený pro léčbu silné chronické neonkologické a v některých případech i akutní bolesti. Pravděpodobně díky agonismu i na κ-receptorech je vhodným opioidem pro léčbu neulgetický účinek je často doprovázen zácpou. Ekvianalgeticky je přibližně 2× silnější než morfin.
Buprenorfin je z farmakologického hlediska parciální agonista na µ-receptorech a antagonista na κ-receptorech. Přesto je řazen do skupiny silných opioidů, neboť vyšší dávky jsou ekvianalgetické jiným silným opioidům. Trvání účinku je 6–8 hodin (injekční a sublingvální forma). V transdermální formě (systém TTS) se aplikuje na 3,5 dne. Tento opioid lze užít i v rámci rotace silných opioidů.
Tapentadol je nejnovější molekula ve skupině silných opioidů. Tapentadol je antagonistou na µ-opioidních receptorech a zároveň inhibuje zpětné vychytávání noradrenalinu v buňkách CNS. Charakteristický je pro něj nízký výskyt nežádoucích účinků a velmi dobrá afinita k neuropatické bolesti. V současné době je dostupný jak v retardované formě (50–250 mg), tak v rychle působící formě (50 a 75 mg).
Pethidin a piritramid jsou dostupné pouze v injekční formě a k léčbě chronické bolesti jsou nevhodné.
Tabulka ekvianalgetických dávek silných opioidů
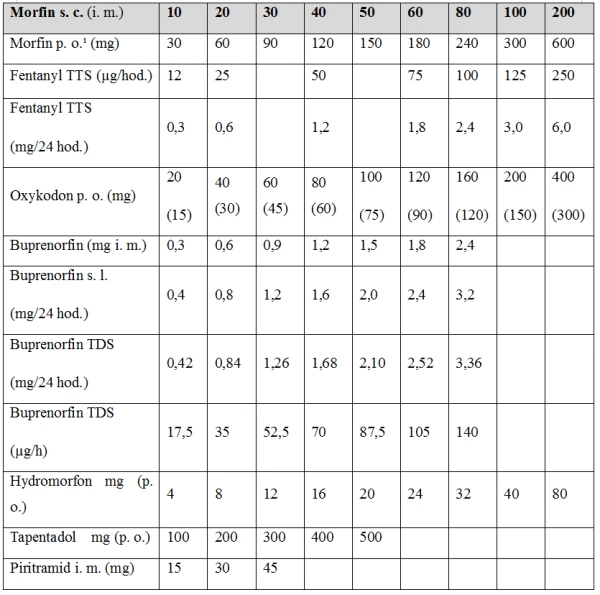
Maximální dávky silných opioidů nejsou stanoveny, farmakologicky jsou bez stropového efektu. Limitujícím faktorem v jejich užívání u seniorů je výskyt nežádoucích účinků. Nejčastěji se objevují ospalost, závratě, zmatenost, nauzea, zvracení a zácpa. Jejich nižší výskyt byl zaznamenán u forem s postupným uvolňováním a zejména u transdermálních forem. Při nasazování opioidní medikace je důležitá pomalá titrace, pečlivé sledování výskytu nežádoucích účinků a rychlá terapeutická reakce. Přestože farmakologicky stropový efekt silných opioidů nepozorujeme, obvykle je vhodné se držet maximálních dávek ekvianalgeticky odpovídajících 160 mg morfinu denně.
Praktické poznámky k farmakoterapii chronické bolesti
- Léčbu chronické bolesti zahajujeme neopioidním analgetikem, jako lék první volby je doporučován paracetamol 500 mg v dávce 1,5 až 2 tbl. 3× denně. Výhoda paracetamolu je ve velké terapeutické bezpečnosti a minimu nežádoucích účinků.
- Při nedostatečném efektu přidáváme NSA. Vzhledem k tomu, že při léčbě chronické bolesti předpokládáme nutnost dlouhodobější léčby, volíme NSA ze skupiny COX2-preferenčních. Nejbezpečnějším se v dlouhodobé léčbě jeví meloxicam, aceklofenak a koxiby. Zvýšená opatrnost je nutná u pacientů nad 65 roků, pacientů s kardiovaskulárním nebo gastrointestinálním onemocněním, užívajících kortikoidy nebo antikoagulancia. Nikdy nekombinujeme různá NSA včetně čípkových forem.
Není pravda, že čípková NSA jsou šetrnější vůči gastrointestinálnímu traktu!
- V případě přetrvávající bolesti přidáváme k neopioidní medikaci lék ze skupiny slabých opioidů, finančně nejdostupnější je na českém trhu tramadol. Vždy začínáme nejnižšími dávkami, tedy 2× 100 mg denně u retardovaných forem (resp. 1× 100 mg u 24hodinové formy) nebo 3× 50 mg (20 kapek) u forem s rychlým účinkem (IR). Pacienta poučíme o možných nežádoucích účincích (závratě, nauzea, zvracení). Pacienty s horší lékovou snášenlivostí v anamnéze vybavíme metoklopramidem. Pacientům je nutné vysvětlit přechodnost těchto nežádoucích účinků (1–2 týdny). Pokud je opioidů zapotřebí pouze pro občasné zhoršení bolestí, vždy volíme rychle nastupující (IR) formu nebo léky kombinované s paracetamolem. Výhoda opioidní medikace oproti NSA je v téměř nulové orgánové toxicitě.
Z hlediska rizikovosti vzniku psychické závislosti na opioidech je nejrizikovější IR forma tramadolu. V léčbě chronických bolestí není smysluplné používání i. m. nebo s. c. aplikace analgetik.
- Při přetrvávání silných chronických bolestí (VAS > 4 na stupnici 0–10) je indikován přechod na silnou opioidní léčbu. Indikací podávání silných opioidů je intenzita bolesti, nikoliv její původ (onkologická × neonkologická). Výběr silného opioidu je vždy individuální. Obvykle je doporučováno zahájení léčby tabletovou formou, která umožňuje rychlejší titraci. Vždy však začínáme nejnižší dostupnou dávkou a dle reakce na terapii postupně titrujeme až na dávku účinnou. Cílem je dosažení VAS < 4 (na stupnici 0–10). V případě, že se nedaří dosáhnout dostatečné terapeutické odpovědi nebo v průběhu léčby došlo k rozvoji tolerance (dříve účinná dávka již je k utlumení bolesti nedostatečná), volíme rotaci opioidu. Použijeme jinou účinnou látku v ekvianalgetické dávce nebo v dávce o 10–30 % nižší.
- U některých pacientů je zapotřebí lék na krátkodobé zhoršení bolestí. Používáme zásadně léky s rychlým nástupem účinku, a to jak ze skupiny neopioidních analgetik, tak slabých (tramadol cps, gtt) nebo silných (IR morfin, morfiový sirup, transmukózní fentanyl) opioidů.
- U opioidní medikace pacienta edukujeme o možnosti výskytu přechodných nežádoucích účinků (nauzea, zvracení, vertigo, ospalost). Jediným přetrvávajícím nežádoucím účinkem je obstipace. Výskyt nežádoucích účinků je důvodem k jejich léčbě, nikoliv vysazení opioidní medikace!
- Neuropatickou bolest (postherpetická neuralgie, neuralgie n. trigeminus, radikulopatie, centrální bolesti apod.) léčíme antikonvulzivy. Lékem bez preskripčního omezení je karbamazepin. Účinná dávka je od 2× 200 mg u retardovaných forem a od 3× 200 mg u neretardovaných forem. Léky druhé volby (gabapentin, pregabalin) mají omezení odborností (neurologie, algeziologie), pacienty je nutno odeslat na specializované pracoviště. Tuto terapii je možné doplnit antidepresivy, především první generace (amitriptilyn, klomipramin). Účinná NSRI antidepresiva mají opět preskripční omezení odborností (psychiatrie, neurologie).
5. Závislost na opioidních analgetikách
V současné době se postoj a tolerance vůči užívání opioidů za účelem analgetické léčby různí nejen u laické veřejnosti, ale i v rámci veřejnosti odborné. U pacienta se postoj k opioidům může vytvářet na základě vlastní zkušenosti s opioidní léčbou, získaným špatným příkladem v rodině, osobní zkušeností s vlastním abúzem drog či jako důsledek nekriticky přijatého stereotypu. I u lékaře se postoj vytváří v kombinaci přítomných osobních dispozic, nakolik je lékař v zajetí vlastních mýtů a jaké zkušenosti s těmito pacienty v průběhu své praxe získal. Významnou roli hraje také jeho odbornost. Jistě jiný a více tolerantní pohled na problematiku lékové závislosti mají algeziologové, onkologové nebo ortopedi, přísnější postoj mají např. psychiatři, což vychází z jejich pracovního kontextu a z neblahých zkušeností se závislými pacienty.
Lékař, který ordinuje opioidy za účelem analgetické léčby, by si měl být vědom možnosti vzniku závislosti. Poslední výzkumy dokládají, že existuje určitá část populace, která vykazuje rizikové faktory pro rozvoj psychické závislosti. Za rizikový faktor se obecně považuje výskyt alkoholové či jiné závislosti v anamnéze, účelové chování svědčící pro závislost (opakované ztrácení receptů či léků), nedodržování pravidel léčby a jejich svévolné přizpůsobování, vyžadování receptu u různých odborných lékařů, vyžadování pouze konkrétního přípravku či opakované žádosti o injekční aplikaci, získávání opioidů z jiných zdrojů než medicínských (např. přes internet) či odmítání změny terapie i přes nepříznivý efekt opioidní léčby.
Silným faktorem hovořícím pro rozvoj psychické závislosti je přítomnost určité osobnostní disponovanosti pacienta, jejíž ohniska můžeme spatřovat v oslabené jáské struktuře, konstituční, těžko kontrolovatelné anxietě či dysforii, poruše osobnosti (zvláště dg. hraniční porucha, narcistická porucha, závislá porucha osobnosti). Tito pacienti se vyznačují obzvláště křehkým a nevyzrálým egem a nízkými seberegulačními mechanismy. Obecně ale nelze tvrdit, že existuje „specifická osobnost“, která má tendenci k rozvoji syndromu závislosti. Zároveň je vhodné myslet na to, že výskyt psychiatrické diagnózy, zejména afektivních nebo fobických poruch a poruch osobnosti, může přispívat k rozvoji závislosti.
Posoudit, zda se jedná o závislost, je diagnosticky náročné, protože by se o ní nemělo uvažovat jen na základě agresivnější komunikace ze strany pacienta a silné neochoty ke změně medikace. Může se jednat o pseudozávislost, což je abnormální chování jedince v důsledku trvání bolesti při nedostatečné dávce silných opioidů, jež bývá mylně považováno za psychickou závislost. Tento klinický problém lze efektivně řešit způsobem, kdy po edukujícím, zklidňujícím pohovoru a úpravě medikace, která vede k úlevě od bolesti, popsané behaviorální projevy zmizí.
Jiným typem závislosti je tzv. terapeutická závislost. Ta se vyskytuje u pacienta, který v minulosti trpěl neztišitelnou bolestí, a proto lpí na konkrétní léčebné strategii ze strachu před recidivou algického stavu a není ochoten opustit či riskovat změnu léčby. Opět zde pomůže pohovor, který by měl vést k emočnímu zklidnění a nabytí důvěry v lékaře, že má pacientovu bolest plně pod kontrolou a nenechá jej zbytečně trpět.
Algeziologická léčba opioidy je spojena s rozvojem závislosti. Je nutné umět od sebe rozlišit psychickou a fyzickou závislost. Fyzická závislost vzniká při pravidelném užívání opioidů. Projevuje se tzv. syndromem z odnětí neboli abstinenčním syndromem při náhlé a výrazné redukci či úplném vysazení opioidů. Vzniká na podkladě chaotické aktivity CNS po odeznění celkového tlumivého efektu opioidů na CNS. Pro klinickou praxi platí, že každý jedinec dlouhodobě užívající opioidy musí být považován za fyzicky závislého.
K rozvoji abstinenčního syndromu dochází v závislosti na druhu a formě vysazeného opioidu v průběhu několika hodin až dní. Podkladem abstinenčního syndromu je pravděpodobně hyperaktivita sympatoadrenálního systému, která se projevuje pocením, zvracením a nauzeou.
Pro rozvoj psychické závislosti nestačí „pouze“ užívat danou drogu. Podílí se na ní součinnost čtyř faktorů:
- farmakologické vlastnosti návykové látky,
- jedinec (genetické, psychosociální faktory),
- faktory prostředí (nápodoba, norma skupiny),
- faktory podnětové (bolest, stres).
Rozvoj psychické závislosti u algického syndromu může vznikat plíživě a po dlouhou dobu, příznaky mohou být maskované. Mohou také být zkreslované obrazem základního algického onemocnění. Na rozdíl od běžného abúzu opioidů za účelem zneužití psychoaktivního efektu může být u pacientů s algickým syndromem primární motivace ve snížení bolesti, utlumení vnímání nepříznivé osobní či sociální situace nebo potlačení nepříjemných afektivních komponent, které působí rušivě. Vedlejší efekt opioidů toto zúžené vnímání reality může nabídnout a může se tak rozvinout sekundární zisk z nadužívání léků. Zneužíváním léku se rozumí jeho aplikace buď z jiného než terapeutického důvodu, nebo v neobvykle vysokých dávkách po neobvykle dlouhou dobu. Má-li takové užívání léku za následek poškození zdraví nebo narušení interpersonálních vztahů po dobu minimálně jednoho měsíce, odpovídá to podle MKN-10 škodlivému užívání.
Závislost na léku charakterizujeme podle MKN-10 jako syndrom závislosti, který se vyznačuje silnou touhou získat látku neboli bažením (craving), obtížemi s kontrolou jejího užívání, které pokračují i přes nebezpečné konsekvence, upřednostňováním užívání látky před jinými aktivitami či povinnostmi, zvýšenou tolerancí a někdy somatickým odvykacím stavem.
Podle MKN-10 a DSM-IV by se definitivní diagnóza syndromu závislosti měla stanovit až po splnění alespoň tří a více přítomných jevů během posledního roku:
- Přítomnost abstinenčních příznaků a odvykacího syndromu.
- Narůstající tolerance k návykové látce.
- Porucha kontroly v užívání látky, která se váže na množství, čas a sociální kontext.
- Změny životního stylu v důsledku užívání látky, ztráta pracovní aktivity (nebo její výrazné snížení), ztráta „zdravých“ sociálních vztahů a zájmů.
- Pokračování v užívání návykové látky i při zjevných psychosociálních nebo somatických komplikacích.
- Touha po návykové látce nebo neúspěšná snaha užívání látky přerušit.
(upraveno podle MKN-10 a DSM-IV)
Mnohá kritéria a psychosociální změny u jedince uvedené pro stanovení syndromu závislosti jsou běžné i pro typický obraz a dynamiku algického syndromu jako takového. Proto je při stanovení syndromu závislosti nutné velmi citlivě vnímat jednotlivé nuance ve změně prožívání a uskutečňování sociálních vztahů a vazeb u pacienta trpícího algickým syndromem. Než diagnózu syndromu závislosti stanovíme, je třeba zvážit skutečnou povahu pacientova problému, neboť jednou přisouzená diagnóza syndromu závislosti je stigmatizující a pro budoucnost pacienta velmi limitující, zvláště co se týká další péče a přístupu zdravotníků k němu.
Domníváme se, že v péči o pacienty s algickým syndromem je paradoxně nejlepší prevencí rozvoje syndromu závislosti na opioidech správně a kvalitně léčit bolest opioidy tak, aby se minimalizovala bolest. Je nutné pečovat o psychickou pohodu pacienta i rozvíjet a naplňovat jeho sociální potřeby. Jinými slovy – usilujeme o zvyšování kvality života, aby pacient neměl tendenci opioidy zneužívat.
6. Invazivní metody léčby bolesti
Invazivní metody v léčbě bolestí zad jsou indikovány jako doplněk farmakoterapie bolesti nebo jako další stupeň léčby bolesti u pacientů, u nichž farmakoterapie bolesti nepřináší dostatečný klinický efekt nebo je zatížena výraznými nežádoucími účinky. I při použití invazivních léčebných postupů musí být zachován multidisciplinární přístup zahrnující farmakoterapii, psychoterapii a rehabilitační a fyzikální léčbu. V ordinaci praktického lékaře lze využít infiltraci spouštěcího bodu (trigger point).
U pacientů s myofasciálním syndromem (bolest vycházející z měkkých tkání v důsledku svalové dysbalance při špatných pohybových stereotypech) často nacházíme v hypertonickém svalu tzv. spouštěcí body. Palpačně se jedná o místo se zvýšenou citlivostí o velikosti 2–5 mm. Tlak na bod vyvolává intenzivní bolest v místě tlaku nebo bolest přenesenou. Aplikace malého množství lokálního anestetika do těchto bodů přináší velmi dobrou, ale krátkodobou úlevu. Vedle aplikace lokálního anestetika lze použít i metodu „suché“ jehly (mechanické podráždění bez aplikace látky) nebo stimulace tlakem, ledem či kryosprejem.
7. Psychoterapie
Role klinického psychologa v úspěšném managementu bolesti je významná nejen v rámci psychologického vyšetření, které je důležité zvláště pro diferenciální diagnostiku etiologie rozvoje algického syndromu spolu se stanovením efektivního léčebného plánu v rámci týmové spolupráce. Neméně významná role klinického psychologa by měla být obsažena v psychoterapeutické práci s pacientem. Je jednoznačně prokázáno, že k nejúčinnějšímu léčebnému efektu dochází právě kombinací racionální farmakoterapie, rehabilitace a psychoterapie. Cílem psychologické péče je pacienta nasměrovat k efektivním změnám v jeho životě, které by měly mít rysy zdravého fungování a nastolení shovívavého přístupu ke svému tělu a zdraví. Jeden z důvodů recidivy algických potíží je, že pacient téměř nic nezmění ve svém životním tempu a nadále žije podle dřívějších stereotypů, které se podílí na rozvoji onemocnění. I přes uvědomění si vhodnosti změny nezdravých stereotypů se pacientovi často nedaří dosáhnout změny. To může vycházet z vnitřních motivů a neuvědomovaných bloků, které spontánní změně brání. Právě psychoterapeutický proces s analýzou neefektivního fungování může přinést zvnitřnělou změnu v přístupu k vlastnímu tělu a akceptaci zdravotních potíží.
Psychoterapeutická péče by měla být zakotvena v podpůrné a abreaktivní terapii spolu s nácvikovými technikami, jako je např. nácvik relaxace. Měla by také poskytnout komplexní péči v rámci managementu bolesti a systematické psychoterapie, která vyžaduje osobní nasazení a ochotu podstoupit dlouhodobý terapeutický proces. Benefit systematické psychoterapie je v zaměření na změnu a růst osobnosti. Díky terapeutickému procesu je pacient schopen získat náhled na vlastní chování, rozvinuté postoje a způsoby fungování, které bolest ovlivňují, a to nejen ve smyslu zhoršení intenzity bolesti. Systematickou vnitřní prací získává nové dovednosti a náhled na to, jak může efektivně dosáhnout snížení bolesti a zlepšení nálady. Dosahuje změny, která vede k tomu, aby byl jeho život naplněný a spokojený i s bolestí.
Aktuální výzkumy dokazují, že psychoterapie neléčí pacienty s chronickou vertebrogenní bolestí do stavu bezbolestnosti, ale pomáhá snižovat intenzitu bolesti, zvyšuje pacientovu funkčnost a je významnou součástí v léčbě pacientů s chronickou bolestí.
Psychoterapeutická péče by měla být „šitá na tělo“ podle potřeb a motivace konkrétního pacienta a v závislosti na jeho možnostech a potenciálu. Psychoterapie má velký přínos pro celkový kurativní proces nejen v rámci zlepšení psychického fungování, ale pozitivně se projeví ve zlepšení pocitu „uspokojivého zdraví“.
V rámci psychoterapeutické léčby vertebrogenního onemocnění bolesti usilujeme o:
- projasnění nálady, zklidnění afektivního prožívání,
- snížení intenzity bolesti,
- posílení pacientovy kontroly nad bolestí a negativními projevy nemoci,
- zvýšení tolerance na zbytkovou bolest, postupné zvyšování funkční kapacity,
- přijetí změny životního stylu,
- pochopení smyslu života i s onemocněním,
- porozumění „řeči vlastního těla“ a schopnost vnímat s ním spojené emoce a impulzy,
- efektivní práci s tělem, školu zad,
- podporování pacienta v přechodu od vnějších podpor k vlastní sebepodpoře,
- rozvoj sebeúzdravných mechanismů, efektivní management bolesti,
- facilitaci potřebné změny z maladaptivních na efektivní strategie vedoucí ke zvýšení kvality života.
8. Rehabilitace
Léčebná rehabilitace je komplex medicínských preventivních, diagnostických a terapeutických opatření směřujících k obnovení maximální funkční zdatnosti jedince postiženého na zdraví cestou odstranění, případně snížením či zpomalením progrese onemocnění. Využití metod léčebné rehabilitace zkvalitní pohybový aparát, ovlivní bolest, sníží svalovou únavnost a zlepší i pracovní a kognitivní výkonnost.
Mezi nejčastější diagnózy, se kterými jsou pacienti odesíláni na rehabilitaci, patří bolesti zad. Jeden z možných rozpisů vhodných rehabilitačních úkonů při bolestech zad:
21001 – kineziologický rozbor;
21113 – TENS proudy, neprahově senzitivní, 15 min + nahřátí nebo UZ 1 W/cm2, 5 min do obl. reflexních změn;
21413 – techniky měkkých tkání;
21415 – mobilizace;
21221 – LTV na neurofyziologickém podkladě;
21215 – instruktáž a zácvik pacienta.
9. Léčba nejčastějších bolestivých stavů
Bolesti zad
Bolesti zad můžeme z etiologického hlediska rozdělit na vertebrogenní onemocnění na podkladě funkčních a nespecifických degenerativních změn páteře (spondylóza, diskopatie, spondylartróza) a onemocnění, při kterých je páteř postižena organickým onemocněním specifické nedegenerativní povahy (zánětlivého, metabolického, nádorového nebo traumatického charakteru). Podle délky trvání dělíme vertebrogenní onemocnění na akutní a chronické.
Léčba akutních bolestí zad zahrnuje nesteroidní antiflogistika, která je možno kombinovat s paracetamolem (3× 750 mg) a dle intenzity bolesti případně v kombinaci se slabým opioidem. Podávání myorelaxancií je diskutabilní a názory na jejich použití se liší, v případě, že se rozhodneme pro jejich použití, neměly by být podávány déle než 5–7 dnů. Farmakoterapii je možné kombinovat s reflexní terapií, režimovým opatřením (klid na lůžku max. 4 dny). Po odeznění akutních příznaků by měla následovat rehabilitace a edukace pacienta o nutnosti pravidelného cvičení.
Léčba chronických bolestí se řídí žebříčkem WHO, v případě přítomnosti neuropatické komponenty bolesti je vhodné analgetickou medikaci kombinovat s antikonvulzivy (karbamazepin 2× 200 mg, gabapentin 300 mg 3× 1, pregabalin 2× 150 mg).
Bolesti kloubního původu
Chronické bolesti při kloubních onemocněních se analgeticky léčí dle žebříčku WHO, včetně silné opioidní medikace. Ta je většinou zapotřebí u artrotického postižení kyčelních a kolenních kloubů II. a vyššího stupně. V medikaci je důležité nezapomínat na výhodnou kombinaci opioidu s paracetamolem.
Bolesti hlavy
Mezi nejčastější bolesti hlavy patří tenzí bolesti, které postihují asi 69 % mužů a 88 % žen, a migréna, kterou trpí 18 % žen a 6 % mužů.
Obvyklá délka trvání migrény je 4–72 hodin, při delším trvání hovoříme o migrenózním statusu, pokud migréna pacienta postihuje častěji než 15 dnů v měsíci, hovoříme o chronické migréně. Asi 20 % migrenózních záchvatů je spojeno s aurou, jejíž délka trvání je do 60 minut. Projevuje se ložiskovými příznaky, jako jsou pozitivní nebo negativní skotomy, parestezie, hypestezie končetin, afázie a dysartrie. Léčbu migrény dělíme na profylaktickou a léčbu akutního záchvatu. Léčba lehkého záchvatu spočívá v podání NSA s rychlým nástupem (nimesulid, ibuprofen, diklofenak, …), středně těžká a těžká migréna vyžaduje podání triptanů. Zlatým standardem je sumatriptan, vhodný pro všechny typy migrény, eletriptan vychází jako nejúčinnější a frovatriptan je vhodný pro léčbu záchvatů vázaných na menstruační cyklus. Profylaktická léčba migrény zahrnuje v lécích první volby kyselinu valproovou 300–1000 mg, topiramat 2× 50 mg, betablokátory (metoprolol) 50–200 mg 1× denně, blokátory kalciových kanálů (flunatrizin) 5–10 mg 1× denně. Jako léky druhé volby nebo doplňkové používáme antidepresiva (amitriptylin 25 mg 1–2 tbl. večer, venlafaxin 75–150 mg).
Neuropatická bolest
Mezi nejčastější bolestivé neuropatické stavy patří postherpetická neuralgie, neuralgie nervu trigeminu, posttraumatické neuropatie a metabolické polyneuropatie. Lékem první volby jsou antikonvulziva. V ordinaci PL lze předepsat pouze karbamazepin, který by měl být podáván v dávce minimálně 2× 200 mg u retardovaných forem a 3× 200 mg u neretardovaných forem. V současné době patří však mezi léky první volby pouze u neuralgie trigeminu, u ostatních stavů jsou léky první volby gabapentin (minimální terapeutická dávka 3× 300 mg), pregabalin (2× 150–300 mg) a NSRI antidepresiva (venlafaxin, duloxetin). Všechny tyto moderní léky mají však v současné době preskripční omezení odborností (neurologie, psychiatrie, algeziologie). Jako doplňkové léky používáme neopioidní analgetika nebo slabé opioidy.
Psychogenní komorbidita algických stavů
Přítomnost psychogenně podmíněného obrazu u algického syndromu často bývá pro lékaře svízelnou situací. Pacienti s tímto okruhem potíží jsou převážně zátěžoví, stěžují si na rozličné potíže, které plně neodpovídají běžným klinickým zkušenostem, nereagují adekvátně na léčbu, vyžadují specifické služby, jsou přecitlivělí a ve většině případů je jejich stav nesnesitelný. Zvláště pozorní bychom měli být v případech, kdy u pacienta nacházíme výskyt těchto faktorů:
- proměnlivé nálezy vyšetření s doprovodnými psychovegetativními symptomy;
- diskrepance mezi objektivními nálezy a subjektivními stesky;
- přítomnost teatrality a sugestibility v behaviorálním projevu;
- rezistence vůči terapii s dlouhodobou pracovní neschopností;
- přítomnost úzkosti, neklidu, sklíčenosti, poruchy spánku;
- zatěžující aktuální životní situace;
- vysoký počet neúspěšných vyšetření, časté změny lékaře;
- chybějící patologicko-strukturální změny.
Pokud u pacienta převažuje výše uvedený obraz potíží, je vhodné uvažovat o susp. somatoformní poruše, pro kterou je charakteristická absence objektivních příčin, a přesto je akcentovaná symptomatologie různých fyzických obtíží při neúčinnosti běžně užívané farmakoterapie.
Somatoformní poruchy tvoří skupinu nemocí, jejichž společným jmenovatelem je pociťování širokého spektra různých tělesných symptomů a bolesti, které jedinec domněle vztahuje k nějaké somatické nemoci, avšak tyto symptomy jsou spojeny s psychologickými faktory. Proto lékařské vyšetření neodhalí žádnou somatickou příčinu, popř. nálezy jsou hraniční a neodpovídají akcentovaným subjektivním steskům. Důvodem této nestandardní situace jsou nejrůznější psychologické příčiny – prožitá traumata, chronický stres, dlouhodobé neřešené vnitřní konflikty, psychická zranění či deprivace získaná v dětském věku. Tyto intrapsychické obsahy jsou disociovány od vědomí a v důsledku obranných mechanismů jsou zastřeny, popřeny či vytěsněny. Pacient svoje symptomy nepředstírá, není si vědom psychologického pozadí somatických potíží a o to intenzivněji se soustřeďuje na léčbu potíží v somatické rovině. Lékař by v tomto případě měl být dobrým diplomatem a pacienta k psychologické péči správně motivovat. Závěrem je vhodné doplnit, že chování pacienta se somatoformní poruchou není účelové povahy. Je způsobeno masivní úzkostí, bezradností a bezvýchodností situace, ve které se nachází. Z klinického hlediska je nutné akceptovat, že pacient bolest nesimuluje a jeho stesky o intenzitě bolesti a dalších fyzických potížích je třeba brát vážně. Běžná farmakologická léčba je neúčinná, spíše se zde osvědčuje medikace s psychokinetickým účinkem spolu s psychoterapií. Také bychom měli mít na mysli, že diagnóza somatoformní poruchy je možná i v přítomnosti současného somatického onemocnění.
10. Organizace pracovišť léčby bolesti v České republice
V České republice je vybudována hustá a kvalitní síť pracovišť léčby bolesti. Podle rozsahu poskytované péče dělíme pracoviště na I. až IV. typu. V současné době registruje Společnost pro studium a léčbu bolesti v ČR 80 těchto pracovišť.
Pracoviště I. typu jsou „centra léčby bolesti“. O pacienty na těchto pracovištích se obvykle starají odborníci z oboru algeziologie, psychologie, psychiatrie, neurologie a rehabilitace. Tato pracoviště se podílejí i na pregraduální a postgraduální výuce lékařů.
Pracoviště II. typu poskytují stejný rozsah péče jako pracoviště prvního typu, nepodílejí se však na vzdělávání lékařů.
Pracoviště III. typu jsou nejrozšířenější. Jedná se o samostatné privátní ambulance nebo ambulance v menších nemocnicích. Péči zde zajišťuje atestovaný algeziolog nebo lékař pracující pod odbornou garancí tohoto lékaře. Ambulance bolesti poskytují základní rozsah algeziologické péče zahrnující dle možností pracoviště farmakoterapii a invazivní metody. Další odborníci se připojují k léčbě v rámci konziliární intervence. Chybí zde multidisciplinární a multimodální přístup v péči.
Pracoviště IV. typu se většinou zaměřují na určitou léčebnou metodu, často z oblasti alternativní medicíny.
Seznam pracovišť léčby bolesti lze najít na stránkách Společnosti pro studium a léčbu bolesti ČLS JEP: www.pain.cz nebo www.i-clb.cz.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



