-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKortikální kost a její význam pro pevnost skeletu
Datum publikace: 15. 5. 2015
Souhrn
Proces kostní remodelace zajišťuje integritu skeletu. U žen po přechodu dochází ke ztrátě rovnováhy kostní remodelace a k úbytku kostní hmoty, jenž zpočátku postihuje více metabolicky aktivnější trámčitou kost. S narůstajícím věkem dominuje ztráta kortikální kosti, která zodpovídá za stoupající incidenci nevertebrálních zlomenin. Experimentální možnosti stanovení pevnosti kortikální kosti se v poslední době rozšířily, v klinické praxi se však stále spoléháme na vyšetření kostní denzitometrií (DXA). Aplikace monoklonální protilátky proti RANKL denosumabu vede k významnému snížení pravděpodobnosti vertebrálních i nevertebrálních zlomenin, vč. zlomenin proximálního konce kosti stehenní. Řada studií prokazuje zlepšení parametrů kortikální kosti po aplikaci denosumabu ve srovnání s placebem, ale i alendronátem. Pro klinickou praxi je podstatné, že při aplikaci denosumabu je vývoj denzity kostního minerálu (BMD) těsně spjat s rizikem nevertebrálních zlomenin.
Klíčová slova
Kortikální kost, denosumab, fraktury.
Remodelace kortikální kosti
Za fyziologických okolností je každá kost lidského skeletu tvořena dvěma histologickými typy kosti – kostí trámčitou (trabecularis) a kostí kompaktní neboli kortikální (corticalis; 1, 2). Kost kortikální představuje 80 % celkové hmoty skeletu a propůjčuje mu tuhost potřebnou v zátěži. Části skeletu bohaté na trámčinu (zbývajících 20 % skeletální masy) zajišťují pružnost těch částí skeletu, které jsou vystaveny nárazům (obratle, juxtaartikulární úseky dlouhých kostí) a umožňují jejich absorpci. Dlouhé kosti jsou tvořeny převážně kortikální, těla obratlů trámčitou kostí. Přístupnější studiu je trámčitá kost, která je metabolicky podstatně aktivnější a která na negativní i pozitivní stimuly reaguje rychleji než kost kortikální. Koordinovaná činnost osteoklastů a osteoblastů zajišťuje trvale probíhající proces kostní remodelace. Jeho cílem je jednak zachování biomechanické kompetence skeletu náhradou úseků starší kostní tkáně novou, vč. adaptace na změny působících sil, jednak zajištění metabolických funkcí skeletu. Procesem kostní remodelace, který probíhá v 1–2 milionech kostních mnohobuněčných jednotek (bone multicelullar units, BMU), je obměněno 2–10 % kostní hmoty ročně. V premenopauze a u mladších mužů je bilance kosti na úrovni každé BMU vyrovnaná: co je osteoklasty resorbováno, je osteoblasty vytvořeno a kostní hmoty neubývá ani nepřibývá (1). Vyšší věk je charakterizován několika změnami. Dochází k vzestupu aktivační frekvence, tedy ke zvýšení počtu nově iniciovaných remodelačních jednotek. To by za podmínek vyrovnané bilance kosti nevadilo, ale protože zároveň dochází k poklesu kostní novotvorby více než k poklesu kostní resorpce, na úrovni každé BMU vzniká malý deficit kostní hmoty. Celkový úbytek kostní hmoty je dán součtem deficitu kostního materiálu všech BMU, a je tedy úměrný nárůstu aktivační frekvence (2).
Po přechodu dochází k relativně rychlejšímu úbytku kosti trámčité než kosti kortikální, ale protože kortikální kost je převažujícím histologickým typem, v absolutních číslech je v postmenopauze úbytek kortikalis obdobný úbytku trámčiny. Ve vyšším věku nedochází ke zpomalování úbytku kosti. Na distálním radiu je ztráta kostní hmoty v intervalu 65–80 let oproti věkové kategorii 50–64 let čtyřnásobná (!), přičemž již převažuje úbytek kortikální kosti. Ve věku nad 80 let je za úbytek kostní hmoty z 90 % zodpovědná ztráta kortikalis (3). Tato zjištění odpovídají klinické zkušenosti: nevertebrální fraktury představují 80 % všech zlomenin a dochází k nim v místech skeletu tvořených převážně kortikální kostí.
Proces kostní remodelace probíhá jednak endostálně, na površích kostních trámců a na endokortikálním povrchu, jednak intrakortikálně. Relativní převaha endostální osteoresorpce na kostních trámcích vede k jejich ztenčování, perforaci, resp. úplnému přerušení. Endostální endokortikální resorpce má za následek zmenšování tloušťky kortikalis, přičemž excesivní remodelace přeměňuje přechodnou zónu mezi trabecularis a kortikalis v kost trámčitou – dochází k tzv. trabekularizaci kortikalis. Převaha osteoresorpce intrakortikálně rozšiřuje prostory haverských kanálů (a možná i osteocytárních lakun) – zvyšuje se průměr kortikálních pórů, což se projeví jako nárůst intrakortikální porozity. Podle některých názorů představuje ve vyšším věku většina kosti trámčitého vzhledu trabekularizovanou kortikalis (4) – viz obr. 1. Tloušťka kortikalis, resp. průměr kortikálních pórů, je pozitivním, resp. negativním prediktorem pevnosti kortikální kosti (5).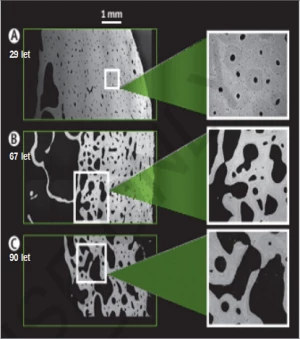
Možnosti neinvazivního stanovení parametrů kortikální kostní hmoty
Metody založené na detekci zeslabení ionizujícího záření
Celkové zeslabení ionizujícího záření v kortikální kosti určují dva aspekty. Především je to poměr objemu vlastní kostní hmoty k „dutému“ objemu, který představují kortikální póry. Nezanedbatelný je ale i stupeň mineralizace kostní hmoty, tedy mineralizovaného osteoidu. Rychlá fáze primární mineralizace saturuje organický osteoid kostním minerálem ze 70 % velmi rychle, během jednoho týdne. Nedojde-li k remodelaci vytvořené kostní tkáně, pomalá sekundární fáze mineralizace probíhá po dobu 12–36 měsíců. Během této doby může dojít k plné saturaci kostním minerálem. Průměrný stupeň mineralizace kostní tkáně (MDBM, mean degree of bone mineralization) je tedy nepřímo úměrný stupni kostní remodelace. Tento faktor je nutno při zkoumání efektů léčiv ovlivňujících proces kostní remodelace – což je případ většiny užívaných preparátů, jak antiremodelačních, tak osteoanabolických – brát v úvahu.
Dlouhé, tubulární kosti jsou, i přes svůj zdánlivě jednoduchý tvar, heterogenními strukturami. Kortikální topografie zahrnující periostální a endokortikální průměr, plochu a tloušťku kortikalis se podél dlouhé osy tubulární kosti výrazně proměňuje (viz dále – Vztah parametrů kostní hmoty a její pevnosti).
Pro dostatečně reprodukovatelné a přesné stanovení parametrů morfologie kosti je klíčová definice hranic – periostálního a endokortikálního povrchu i kostních trámců. Periostální průměr, jenž mimochodem fyziologicky narůstá s věkem tempem 5–35 µm/rok (6), současné zobrazovací metody detekují s dostatečnou přesností. Větší problém představuje endostální povrch. Přechod trámčité kosti v endokortikální vrstvu kortikální kosti je postupný a zmíněný proces trabekularizace kortikalis jej posouvá směrem k periostu, což se jeví jako expanze dřeňové dutiny. Skutečnost, že přesná definice endostálního povrchu je prakticky nemožná, vedl k prosazení termínu „přechodná zóna“ (transitional zone) jako odděleného kompartmentu kortikální kosti.
V klinické praxi jsou naše možnosti zkoumání stavu kortikální kosti omezené na kostní denzitometrii (DXA), stanovující parametr denzita kostního minerálu (BMD, g/cm2). Z užívaných oblastí zájmu relativně nejvyšší podíl kortikalis obsahuje proximální úsek distálního radia a krček kosti stehenní.
Experimentálně používaná metodika kvantitativní počítačové tomografie (QCT), zastoupená především modernějšími přístroji s vysokým rozlišením (HRCT), dokáže – kromě vyjádření celkové hodnoty – hodnotit odděleně trámčitou a kortikální kost i přechodnou zónu (nejmodernější přístroje i vnitřní a vnější kompartment přechodné zózy) a na nich i jednotlivé její aspekty – jednak objemovou (volumetrickou) BMD (g/cm3), jednak geometrické parametry spojované s pevností kosti (tloušťka kortikalis, její plocha, kortikální porozita apod.). Tyto parametry bylo původně možno stanovovat pouze invazivně, histomorfometrickým vyšetřením vzorku kosti, odebraného nejčastěji z lopaty kosti kyčelní. Invazivní metodika ostatně stále představuje zlatý standard hodnocení vlivu léčiv na histologické složení kosti a jako jediná umožňuje stanovení dynamických parametrů kostní tkáně. Některé mikrostrukturální parametry získané prostřednictvím QCT nejsou zjišťovány přímo, jde o odvozené parametry a je nutné je v tomto kontextu interpretovat.
Nepřímé metody stanovení pevnosti kosti
Patrně nejnadějnější metodou stanovení pevnosti kosti in vivo je metoda analýzy konečných prvků (FEA). Trojrozměrné zobrazení nejčastěji proximálního femuru nebo obratlového těla pořízené HRCT je podrobeno pomocí speciálního softwaru počítačové simulaci napodobující působení vnějších sil. Pevnost kosti, resp. její hranice, je pak možno analyzovat za různých podmínek působení vnějších sil (varianty komprese a torze na těle obratle, laterální náraz na trochanter proximálního femuru). Pevnost tubulárních struktur – a platí to pro technické výrobky i pro dlouhé kosti – v ohnutí a torzi závisí mj. na tloušťce stěny materiálu (v případě dlouhé kosti tedy na tloušťce kortikalis) a také na průměru celé struktury. Tubulární struktura je tím pevnější, čím více materiálu je distribuováno co nejdále od osy otáčení struktury. Zvýšení pevnosti válcovité struktury konstantní hmotnosti je možno dosáhnout distribucí materiálu co nejdále od osy otáčení, tedy zvýšením průměru, a to do určité míry i na úkor tloušťky stěny. Tuto závislost popisuje vzorec pro výpočet parametru polární moment setrvačnosti (PMI). Tento parametr lze na dlouhých kostech za použití zobrazovací metody (CT) dlouhých kostí spočítat a nepřímo tak odvodit jejich pevnost. Všechny zmíněné metody mohou být použity jako nástroj posuzující vliv řady faktorů na skelet, vč. efektů léčby.
Vztah parametrů kostní hmoty a její pevnosti
Z klinického hlediska je samozřejmě podstatná korelace mezi měřitelnými parametry kostní hmoty a její pevností. Jako první byla jasně prokázána závislost pevnosti kosti na hodnotě BMD, která stojí v pozadí definice osteopenie a osteoporózy dle Světové zdravotnické organizace jako poklesu BMD (7). Přestože jejich užití v klinické praxi je stále otázkou budoucnosti, moderní zobrazovací metody ukázaly přesněji, na jakých prvcích kostní architektury závisí pevnost jednotlivých kosti především. Mechanické testování pevnosti krčku kosti stehenní kadaverózních vzorků a simulace pádu na bok analyzovaná metodou FEA ukázaly absolutní převahu vlivu kortikalis nad vlivem trámčiny (8), přičemž nejpodstatnějším parametrem byla hodnota mediánu tloušťky kortikalis (nikoli průměrná hodnota, která může zastřít výrazná ztenčení kortikalis v kritických místech krčku femuru; rozložení tloušťky i plochy kortikální kosti není gaussovské (9). Simulovaný náraz kolmo k ploše radiokarpálního skloubení analyzovaný pomocí FEA ukázal, že pevnost distálního radia podmiňuje především tloušťka kortikální kosti a až s odstupem počet kostních trámců a jejich tloušťka (10). Pouze za pevnost obratlového těla zodpovídá relativně více trámčitá než kortikální kost. Simulace komprese v ose, opět hodnocená prostřednictvím FEA, stanovila jako nejvýznamnější parametr pevnosti kosti tloušťku trámců následovaný tloušťkou kortikalis v přední části obratlového těla (11).
Vliv léčby na parametry kortikální kosti
Složitost problematiky vlivu léčby osteoporózy na parametry kortikální kosti zjišťované atenuačními metodami (HR-CT a pHR-CT) lze demonstrovat na práci srovnávající vliv teriparatidu a denosumabu (12).
Teriparatid, aminoterminální fragment lidského parathormonu připravený rekombinantní technikou, zvyšuje úroveň kostní remodelace s relativní převahou kostní novotvorby. Následkem je pozitivní bilance kosti. Na úrovni zvýšeného počtu remodelačních jednotek jde o „overfilling“ resoprčních kavit, k apozici kosti dochází i na klidových kostních površích. Výsledkem je celkový osteoanabolický efekt, zvýšení reálného objemu kostní hmoty (13).
Denosumab je monoklonální protilátka třídy IgG2 proti ligandu pro aktivátor receptoru nukleárního faktoru κ-B (RANKL), který je klíčovým mediátorem osteoklastogeneze a aktivity osteoklastů (14). Po jeho aplikaci dochází k hlubokému útlumu kostní remodelace (15).
Zmíněná práce nepozorovala zvýšení tloušťky kortikální kosti po aplikaci osteoanabolického teriparatidu, ale po antiresorpčním denosumabu. Tato zjištění jsou alespoň zčásti důsledkem obtíží v odlišení trámčité a kortikální kosti a v tomto případě i důsledkem skutečnosti, že mineralizace kostní hmoty po aplikaci osteoanabolika klesá a po aplikaci antiresorpčního léku roste. Pod vlivem teriparatidu dochází k depozici osteoidu na endokortikálních a trámčitých površích (16). Nově vytvořený osteoid zachycuje fotony až v okamžiku určitého stupně mineralizace, takže skutečná periostální apozice není alespoň zčásti touto metodikou detekována. Teriparatidem navýšená remodelace kosti navíc na intrakortikálních, enodkortikálních i trámčitých površích odstraňuje plně mineralizovanou kost, kterou nahrazuje organickým osteoidem. To může vést až k poklesu obsahu kostního minerálu stanovené oblasti, což se eventuálně projeví až poklesem BMD, přestože přímé histomorfometrické vyšetření prokazuje vzestup objemu kosti. Po aplikaci teriparatidu nebylo v této práci pozorováno zvýšení tloušťky trámců a jejich počtu a snížení jejich separace, přestože přímé histomorfometrické analýzy tyto efekty opakovaně ukázaly a pro jejich přítomnost svědčí i významné snížení rizika zlomenin po aplikaci teriparatidu. Antiresorptiva, jejichž představitelem je denosumab, v nejlepším případě zastavují úbytek kostní hmoty a narušení mikroarchitektoniky kostní tkáně. Dosahují toho snížením úrovně kostní remodelace. Na počátku léčby, kdy dochází k prudkému poklesu zvýšené úrovně kostní remodelace, klesá počet aktivních remodelačních jednotek, které se nachází v různé fázi kostní resorpce/novotvorby a představují „prázdný“, tzv. tranzientní remodelační prostor. Aktivní remodelační jednotky jsou zaplňovány a nové jsou aktivovány jen minimálně. Postupné zaplnění tranzientního remodelačního prostoru trvá cca 3 měsíce a je spojeno s fokálním poklesem intrakortikální porozity (v případě zaplnění resorpčních kavit v intrakortikálních kanálech), resp. fokálním zvýšením tloušťky kortikalis (jako důsledku zaplňujících se kavit endokortikálně). Tato úvodní fáze je charakterizována rychlým nárůstem BMD. Na tom se podílí i narůstající průměrný stupeň kostní mineralizace (MDBM), protože se prodlužuje trvání průměrné fáze sekundární mineralizace. Právě vzestup MDBM může být z části zodpovědný za „vzestup“ tloušťky kortikalis po aplikaci denosumabu. Na periostální a endokortikální hranici překročí vyšší počet voxelů parametry zeslabení ionizujícího záření charakteristického pro kost. Dalším potenciálním mechanismem vzestupu tloušťky kortikalis po aplikaci denosumabu je pokračující periostální a endokortikální modelace, kterou již nezastírá vysoká úroveň kostní remodelace (17). Léčba denosumabem je ve srovnání s placebem spojena s významným snížením incidence zlomenin obratlových těl i nevertebrálních zlomenin vč. zlomenin proximálního femuru (18).
Vliv denosumabu na parametry kortikální kosti byl zkoumán v registračních studiích II. a III. fáze i v samostatně designované pilotní studii II. fáze. Primárním cílem studie Denosumab Fortifies Bone Density (DEFEND), 2leté randomizované placebem kontrolované studie s 332 postmenopauzálními ženami s nízkým množstvím kostní hmoty (tedy v indikaci prevence postmenopauzální osteoporózy), bylo stanovení vývoje BMD bederní páteře a celkové oblasti proximálního femuru po aplikaci registrované dávky denosumabu ve srovnání s placebem (19). Zároveň byla prostřednictvím kvantitativní počítačové tomografie (QCT) po 1., 6., 12. a 24. měsíci stanovena objemová BMD. QCT analýza byla rozdělena na hodnocení proximální, distální a ultradistální části dolního konce radia. Volumetrická BMD kompartmentu kortikální kosti proximální i distální oblasti zájmu byla u těchto relativně mladých pacientek (průměrný věk 59,4 roku) léčbou denosumabem mírně, ale významně zvýšena. Tloušťka kortikalis byla léčbou denosumabem stabilizována (mírný vzestup proximálně, mírný pokles distálně). Aplikace placeba byla spojena s významnými poklesy všech jmenovaných parametrů. Polární moment setrvačnosti distálního radia při léčbě denosumabem vykázal významné vzestupy již po prvním měsíci léčby a po dobu trvání studie docházelo k jeho dalšímu nárůstu, zatímco pacientky na placebu vykazovaly soustavný pokles tohoto parametru pevnosti kosti. Nejrozsáhlejší registrační studie s denosumabem (zařazeno 7868 žen s postmenopauzální osteoporózou o průměrném věku 72,3 roku), Fracture Reduction Evaluation of Denosumab in Osteoporosis every 6 Months (FREEDOM), byla 3letou klinickou studií III. fáze zaměřenou na průkaz snížení rizika zlomenin při aplikaci denosumabu ve srovnání s placebem. Subanalýzy této studie zahrnovaly podrobnější stanovení vývoje BMD (n = 441) a především QCT parametrů (n = 182) distálního radia a také zhodnocení incidence zlomenin distálního radia v celém souboru studie FREEDOM (n = 7812), včetně početné podskupiny pacientek ve vyšším riziku nevertebrálních zlomenin, definované vstupním BMD krčku femuru ≤ −2,5 SD (n = 2709). U 62 pacientek byla provedena subanalýza QCT parametrů proximálního konce kosti stehenní. Po 36 měsících léčby denosumabem činily vzestupy BMD distálního radia proximálně 1,9 %, distálně 3,2 % a ultradistálně 5,9 %, zatímco u pacientek na placebu došlo k poklesům ( − 2,2 %, − 2,5 %, − 2,5 %; 20). Studie potvrdila i vzestupy PMI spojené s léčbou denosumabem tak, jak je ukázala studie DEFEND, vč. třetího roku léčby (19).V celém souboru studie FREEDOM bylo s aplikací denosumabu spojeno nevýznamné snížení incidence zlomenin distálního radia. V subpopulaci pacientek ve vyšším riziku byla prokázána jednak vyšší incidence těchto fraktur (prokazující, že vedle pádů se na patogenezi zlomenin distálního radia podílí i snížená denzita kostního minerálu periferního skeletu), jednak i účinnost denosumabu v jejich prevenci (významné snížení rizika o 40 % ve srovnání s placebem; 18). QCT subanalýza proximálního konce kosti stehenní ukázala trvalý a významný vzestup volumetrické BMD nejen trabekulárního, ale i subkortikálního a kortikálního kompartmentu (21). Potud vliv denosumabu na kortikální kost ve srovnání s placebem, tedy na pozadí jejího přirozeného, s výjimkou užívání vápníku a vitamínu D, léčbou neovlivněného vývoje. Vedle toho existuje doklad o vlivu denosumabu ve srovnání nejen s placebem, ale zároveň i aktivní kontrolou – dalším antiresorpčním preparátem alendronátem. Jak denosumab, tak alendronát byly aplikovány v dávkách registrovaných pro léčbu osteoporózy (denosumab 60 mg s. c. 1×/6 měsíců, alendronát 70 mg p. o. 1×/týden) po dobu jednoho roku v rámci randomizované dvojitě slepé dvojitě maskované studie. Studie srovnávala u 247 postmenopauzálních žen s T-skóre bederní páteře nebo celkového proximálního femuru v rozmezí −2,0 až −3,0 SD (T-skóre). Stanovován byl mj. vliv na tloušťku kortikalis a volumetrickou BMD kortikalis distálního radia a distální tibie. V placebové skupině se volumetrická BMD kortikální kosti i tloušťka kortikální kosti distálního radia snížila. Alendronát poklesu volumetrické BMD kortikalis zabránil a kortikální tloušťku významně zvýšil, což potvrdilo výsledky jiných studií s alendronátem (22). Aplikace denosumabu významně zvýšila jak volumetrickou BMD, tak tloušťku kortikalis ve srovnání se vstupní hodnotou, přičemž vzestup vBMD významně převýšil efekt alendronátu. Obdobný vývoj celkové volumetrické BMD byl pozorovatelný i na distální tibii: pokles u pacientek z placebové skupiny, vzestup při aplikaci alendronátu i denosumabu. Polární moment setrvačnosti (PMI) se po 12 měsících v placebové skupině nezměnil, léčba alendronátem jej mírně zvýšila, ale významně méně, než jej zvýšil denosumab. Uvedené rozdíly byly patrné již po 6 měsících léčby (23).
V témže souboru byla pomocí speciálního počítačového softwaru kvantifikována míra kortikální porozity. Na kortikální kosti umožnil software izolované hodnocení denzního, kompaktního kortexu a přechodné zóny mezi kortikalis a trámčinou. Aplikace placeba, tedy vápníku a vitamínu D v „nejkortikálnějších“ oblastech, dokázala udržet úroveň kortikální porozity. Alendronát porozitu významně snížil během prvních 6 měsíců a dále ji udržel, což odpovídá dříve publikovaným údajům (24). Denosumab progresivně snižoval porozitu po celý rok sledování, takže po 12. měsíci byla porozita významně snížena nejen proti placebu, ale i ve srovnání s alendronátem (23, 25) – viz obr. 2.

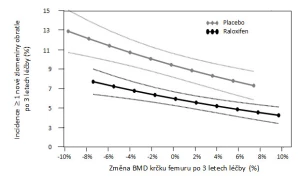
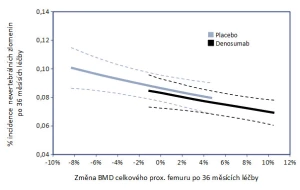
Jak bylo řečeno výše, v omezené míře vypovídá o stavu kortikální kosti i vyšetření kostní denzitometrií. Léčba denosumabem ve srovnání s aplikací placeba zvyšuje BMD ve všech stanovených oblastech zájmu, včetně těch, kde převažuje kortikální kost (26) – viz obr. 3. Popis vlivu změny BMD indukovaný antiresorpčním preparátem na pravděpodobnost zlomeniny nelze zjednodušit do jednoho schématu (27). Záleží mj. na měřeném místě skeletu, typu zlomeniny, k němuž se vývoj BMD vztahuje, a v neposlední řadě na zdrojových datech analýz i způsobu jejich zpracování (28). Obecně lze říci, že změna BMD denzitometrické oblasti zájmu bohaté na kortikální kost více vypovídá o riziku nevertebrálních zlomenin než zlomenin obratlových těl. Jsou popsány situace, kdy vzestup BMD konkrétní oblasti zájmu prakticky nevypovídá o riziku určitého typu zlomeniny. Příkladem může být vztah vývoje BMD krčku kosti stehenní a rizika zlomeniny obratle u žen s postmenopauzální osteoporózou léčených raloxifenem nebo placebem. Změna BMD při užívání raloxifenu zodpovídá pouze za 4 % pozorovaného snížení rizika zlomeniny (29) – viz obr. 4a. Na opačném pólu spektra je závislost pravděpodobnosti nevertebrální zlomeniny na změně BMD celkové oblasti horního konce kosti stehenní při užívání denosumabu. Změna BMD této oblasti vysvětluje snížení rizika nevertebrálních zlomenin z 87 % (30) – viz obr. 4b. Přesto, že jde o souhrnná data pocházející z analýz mnohatisícového souboru studie FREEDOM a na úrovni jednotlivého pacienta by měla být interpretována opatrně, lze vývoj BMD celkové oblasti proximálního femuru považovat za parametr účinnosti léčby denosumabem na snížení rizika nevertebrálních zlomenin.

Závěr
S nástupem menopauzy dochází k úbytku kostní hmoty, zpočátku především trámčité kosti (ztenčení, resp. zánik trámců), později převážně kosti kortikální (ztenčení, nárůst kortikální porozity). Progrese výskytu zlomenin s věkem koreluje se ztrátou trámčité i kortikální kosti, přičemž úbytek trámčité kosti zodpovídá za zvýšenou incidenci zlomenin obratlů a distálního radia v prvním deceniu po přechodu, úbytek kortikalis společně s vyšším rizikem pádů je spojen s narůstající incidencí nevertebrálních zlomenin. Vliv úbytku kortikální kosti progresivně narůstá s věkem.
Léčba denosumabem příznivě ovlivňuje parametry kortikální kosti jak ve srovnání s placebem, tak v přímém srovnání s alendronátem.
Vzestup BMD celkové oblasti proximálního femuru, denzitometrické oblasti zájmu tvořené převážně kortikální kostí, vypovídá při léčbě denosumabem o snížení rizika nevertebrálních zlomenin.
- Fleisch H. Bisphosphonates in bone disease. From the laboratory to the patient. 4. vydání, Academic Press 2000, ISBN 0122603702.
- Seeman E. Age - and menopause-related bone loss compromise cortical and trabecular microstructure. J Gerontol A Biol Sci Med Sci 2013; 68 : 1218–1225.
- Ghasem-Zadeh A., Bohte A., et al. Intracortical remodelling and porosity in the distal radius and post-mortem femurs of women: a cross-sectional study. Lancet 2010; 375 : 1729–1736.
- Zebaze R., Ghasem-Zadeh A., Bohte A., et al. Intracortical remodelling and porosity in the distal radius and post-mortem femurs of women: a cross-sectional study. Lancet 2010; 375 : 1729–1736.
- Wachter N. J., Krischak G. D., Mentzel M., et al. Correlation of bone mineral density with strength and microstructural parameters of cortical bone in vitro. Bone 2002; 31 : 90–95.
- Balena R., Shih M.-S., Parfitt J. Bone resoption and formation on the periostal envelope of the ilium: a histomorphometric study in healthy women. J Bone Mineral Res 1992; 7 : 1475–1482.
- Report of a WHO Study Group. Assessment of fracture risk and its application to screening of postmenopausal osteoporosis. WHO Technical Reports Series 843, Ženeva 1994.
- Holzer G., von Skrbensky G., Holzer L. A., Pichl W. Hip Fractures and the contribution of cortical versus trabecular bone to femoral neck strength. J Bone Miner Res 2009; 24 : 468–474.
- Kersh M. E., Pandy M. G., Bui Q. M., et al. The heterogeneity in femoral neck structure and strength. J Bone Miner Res 2013; 28 : 1022–1028.
- Pistoia W., van Rietbergen B., Rüegsegger P. Mechanical consequences of different scenarios for simulated bone atrophy and recovery in the distal radius Bone 2003; 33 : 937–945.
- Roux J.-P., Wegrzyn J., Arlot M. E., et al. Contribution of Trabecular and cortical components to biomechanical behavior of human vertebrae: an ex vivo study. J Bone Miner Res 2010; 25 : 356–361.
- Tsai J. N., Uihlein A. V., Burnett-Bowie S. M., et al. Comparative effects of teriparatide, denosumab, and combination therapy on peripheral compartmental bone density, microarchitecture, and estimated strength: the DATA-HRpQCT Study. J Bone Miner Res 2015; 30 : 39–45.
- Lindsay R., Cosman F., Zhou H. et al. A novel tetracycline labeling schedule for longitudinal evaluation of the short-term effects of anabolic therapy with a single iliac crest bone biopsy: early actions of underline teriparatide. J Bone Miner Res 2006; 21 : 366–373.
- Bone H. G., Bolognese M. A., Yuenet C. K., al. Effects of denosumab treatment and discontinuation on bone mineral density and bone turnover markers in postmenopausal women with low bone mass. J Clin Endocrinol Metab 2011; 96 : 972–980.
- McClung M. R., Lewiecki E. M., Gelleret M. L., et al. Effect of denosumab on bone mineral density and biochemical markers of bone turnover: 8-year results of a phase 2 clinical trial. Osteoporos Int 2013; 24 : 227–235.
- Compston J. E. Skeletal actions of intermittent parathyroid hormone: effects on bone remodelling and structure. Bone 2007; 40 : 1447–1452.
- Ominsky M., Libanati C., Boyce R. W., et al. Continuous modeling-based bone formation: a novel mechanism that could explain the sustained increases in hip bone mineral density (BMD) with denosumab treatment. J Bone Miner Res 2013; 28 (Suppl 1).
- Cummings S. R., San Martin J., McClung M. R., et al. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med 2009; 361 : 756–765.
- Bone H. G., Bolognese M. A., Yuen C. K., et al. Effects of denosumab on bone mineral density and bone turnover in postmenopausal women. J Clin Endocrinol Metab 2008; 93 : 2149–2157.
- Genant H. K., Engelke K., Hanley D. A., et al. Denosumab improves density and strength parameters as measured by QCT of the radius in postmenopausal women with low bone mineral density. Bone 2010; 47 : 131–139.
- Genant H. K., Libanati C., Engelke K., et al. Improvements in hip trabecular, subcortical, and cortical density and mass in postmenopausal women with osteoporosis treated with denosumab. Bone 2013; 50 : 482–488.
- Rizzoli R., Laroche M., Krieg M.-A., et al. Strontium ranelate and alendronate have diverging effects on distal tibia bone microstructure in women with osteoporosis. Rheumatol Int 2010; 30 : 1341–1348.
- Seeman E., Delmas P. D., Hanley D. A., et al. Microarchitectural deterioration of cortical and trabecular bone: differing effects of denosumab and alendronate. J Bone Miner Res 2010; 25 : 1886–1894.
- Roschger P., Rinnethaler S., Yates J., et al. Alendronate increases degree and uniformity of mineralization in cancellous bone and decreases the porosity in cortical bone of osteoporotic women. Bone 2001; 29 : 185–191.
- Zebaze R. M., Libanati C., Austin M., et al. Differing effects of denosumab and alendronate on cortical and trabecular bone. Bone 2014; 59 : 173–179.
- Bolognese M. A., Teglbjærg C. S., Zanchetta J. R., et al. Denosumab significantly increases DXA BMD at both trabecular and cortical sites: results from the FREEDOM study. J Clin Densitom 2013; 16 : 147–153.
- Delmas P. D., Zhengqing L., Cooper C. Relationship between changes in bone mineral density and fracture risk reduction with antiresorptive drugs: some issues with meta-analyses. J Bone Miner Res 2004; 19 : 330–337.
- Delmas P. D., Seeman E. Changes in bone mineral density explain little of the reduction in vertebral or nonvertebral fracture risk with anti-resorptive therapy. Bone 2004; 34 : 599–604.
- Sarkar S., Mitlak B. H., Wong M., et al. Relationships between bone mineral density and incident vertebral fracture risk with raloxifene therapy. J Bone Miner Res 2002; 17 : 1–10.
- Austin M., Yang Y.-C., Vittinghoff E., et al. Relationship between bone mineral density changes with denosumab treatment and risk reduction for vertebral and nonvertebral fractures. J Bone Miner Res 2012; 27 : 687–693.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



