-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaDiagnostika a léčba infekce močových cest u dětí
Datum publikace: 23. 11. 2015
Úvod
Infekce močových cest (IMC) je častým onemocněním dětského věku. V průběhu prvních 8 let života postihuje 7–8 % dívek a 2 % chlapců. Pouze období prvního roku života je spojeno s vyšším výskytem u chlapců, v pozdějším věku je IMC významně častější u děvčat (1). Febrilní IMC může způsobit jizvení ledvin, jež bývá v některých případech spojeno s trvalými následky pro pacienta, především v podobě chronického onemocnění ledvin, hypertenze a proteinurie (2). Včasná a správná diagnostika IMC spolu s adekvátní léčbou jsou hlavními úkoly pediatra. Diagnostika je s ohledem na komplikovanější odběr moči obtížná obzvláště u malých dětí. Vzhledem k velké prevalenci v dětském věku se diagnostice i léčbě IMC věnuje mnoho studií, navzdory tomu je tato problematika nadále předmětem odborných diskuzí, kontroverzí a nejasností.
Anamnéza a příznaky infekce močových cest
U dětí s podezřením na IMC pátráme v anamnéze cíleně po predisponujících faktorech či známkách chronického onemocnění ledvin, které shrnuje tabulka 1. Vrozená vada močového traktu se manifestuje obvykle u malých dětí, u adolescentek souvisí první IMC často se zahájením sexuálního života. Diagnostika IMC u starších dětí je založena na přítomnosti specifické symptomatologie. U infekcí dolních močových cest pacienti udávají tzv. dysurické obtíže – bolesti a pálení při močení –, obvykle pociťují také časté nucení na močení – polakisurii. V některých případech je IMC doprovázena bolestmi břicha či zad, zvracením a makroskopickou hematurií. IMC bychom měli vyloučit i v případě nově vzniklé inkontinence moči. Pro akutní pyelonefritidu (AP) jsou charakteristické systémové příznaky – přítomnost horečky, pacienti mohou být schvácení, onemocnění někdy probíhá i pod obrazem septického stavu. U novorozenců, kojenců a malých batolat mohou být klinické symptomy velmi nespecifické. Na IMC bychom proto měli myslet i u dětí s protrahovaným nechutenstvím, váhovým neprospíváním a vyšší dráždivostí. Prvním příznakem močové infekce může být také konjugovaná hyperbilirubinemie v prvním měsíci života.
Tabulka 1 – Anamnestická data, na něž se zaměřujeme u pacienta s IMC

* Aktivně se ptáme na event. patologický nález z prenatálního sonografického skríninku.
Odběr moči k vyšetření
Vyšetření moči je v diagnostice IMC naprosto zásadní. U větších dětí obvykle vyšetřujeme moč ze středního proudu po omytí okolí ústí močové trubice, abychom tak předešli kontaminaci. U starších dívek je vhodné při odběru oddálit labia, ideálně moč zachytávat při opačném posazení na toaletu s koleny ve výrazné abdukci, chlapci si před odběrem přetáhnou předkožku. Odběr moči je problematický hlavně u kojenců a malých batolat, ideální je zachycení vzorku moči ze středního proudu do připravené zkumavky. Neinvazivita je výhodou záchytu moči do tzv. sběrného sáčku, ale vzhledem k vysokému riziku kontaminace – až 63 % (4) – je tento poměrně rozšířený způsob vhodný pouze ke skríninkovému vyšetření. Přimísení bakteriální flóry z předkožky, vaginy i z okolí ústí močové trubice může významně zkreslit výsledek kultivačního vyšetření. Tzn. negativní kultivační nález ze sáčku vylučuje močovou infekci, v případě pozitivního výsledku musíme brát v úvahu možnost kontaminace, a to hlavně při přítomnosti dvou a více bakteriálních kmenů. Vhodnou metodou k získání vzorku moči hlavně u malých dětí je transuretrální katetrizace. Při cévkování provádíme řádnou dezinfekci a používáme topické anestetikum, ideální je neodebírat hned první kapky moči, jelikož mohou být kontaminovány flórou z uretry. Rodiče dítěte musí být řádně poučeni o důvodech prováděného zákroku. Mezi rizika výkonu patří trauma uretry, mikroskopická hematurie či iatrogenní IMC, nicméně jejich výskyt je při správném postupu velmi nízký. Suprapubická punkce močového měchýře se provádí nejčastěji u dětí, u nichž nelze adekvátní vzorek moči k vyšetření získat jiným způsobem – např. v případě labiálních synechií nebo těsné fimózy. Suprapubická punkce je populární hlavně ve Spojených státech. Při tomto způsobu odběru s nejmenším rizikem kontaminace se moč získává vpichem jehlou do močového měchýře 1–2 cm nad symfýzou pod sonografickou kontrolou.
Vzorek moči musí být včas zpracován, případně do doby transportu uložen v chladicím zařízení při teplotě 4 ˚C, protože v teplejším prostředí se bakterie nadále pomnožují a zkreslují výsledek kvantity aktuální bakteriurie. Při nálezu sterilní pyurie musíme myslet na možnou jinou infekční i neinfekční etiologii. Také zánětlivé změny orgánů sousedících s močovým traktem či medikace mohou být provázeny leukocyturií spolu s negativní močovou kultivací. Příčiny sterilní pyurie shrnují tabulky 2, 3 a 4 (5, 6).
Tabulka 2
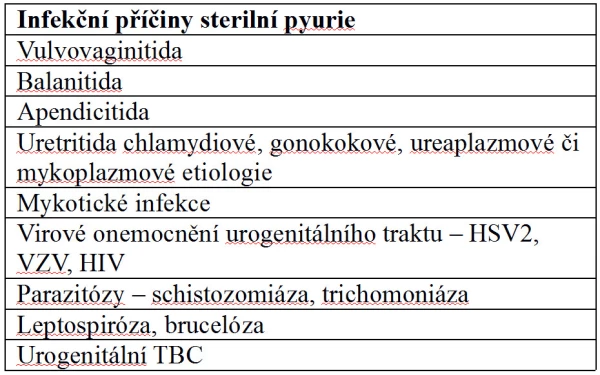
HSV … virus Herpes simplex; VZV … virus Varicella zoster; HIV … human immunodeficiency virus; TBC … tuberkulóza
Tabulka 3

Tabulka 4

Interpretace laboratorního vyšetření moči
Důležitou součástí komplexního vyšetření dítěte s podezřením na IMC je chemické vyšetření moči. V ambulancích se s výhodou využívají rychlotesty diagnostickým proužkem. Pozitivita leukocytární esterázy (LE) je nepřímou známkou pyurie s vysokou senzitivitou i specificitou pro IMC (tabulka 5). Vyšetření LE může být falešně negativní při patologické proteinurii, glykosurii, vysoké specifické hmotnosti moči, léčbě cefalexinem, tetracyklinem nebo u dětí s nadměrným příjmem kyseliny askorbové. Naopak falešnou pozitivitu může způsobit hnisavý vaginální výtok různé etiologie vč. trichomonádové. Nitritovým testem, jehož pozitivita je taktéž vysoce specifická pro IMC, měříme přeměnu nitrátů na nitrity gramnegativními bakteriemi. V určitých případech může ale být i tento test falešně negativní, a to při polakisurii, kdy dochází k častému vyprazdňování močového měchýře, dále u dětí s vysokou specifickou hmotností moči, při vysokém příjmu vitaminu C nebo v případě jiného původce IMC, který nemetabolizuje nitráty na nitrity. Mikroskopické vyšetření moči nám umožňuje přesnou analýzu počtu elementů v moči, ozřejmí přítomnost bakterií, krystalů, případně válců (7). Negativní LE i nitritová reakce spolu s mikroskopickým vyšetřením, jež neprokazuje patologickou leukocyturii a bakteriurii, na 99 % vylučují přítomnost IMC (8).
Tabulka 5 – Senzitivita a specifita ukazatelů infekce močových cest (8)
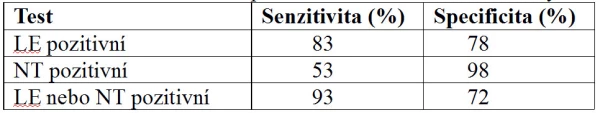
LE … leukocytární esteráza; NT … nitritový test
Kultivace moči
Často se opomíjí důležitá skutečnost, že i jedna dávka účinného antibiotika obvykle inhibuje růst bakterií v moči, a proto je bezpodmínečně nutné provést odběr moči k vyšetření vždy před zahájením antibiotické léčby. Pozitivní nález bakterií v moči je hlavní diagnostický parametr IMC, proto je vyšetření kultivace moči nezbytnou součástí vyšetření u dítěte s podezřením na močovou infekci. Již několik desítek let pokládají lékaři za signifikantní bakteriurii počet bakterií ≥105/ml moči, podle posledních doporučení American Academy of Pediatrics (AAP) je za významnou bakteriurii považován již nález 50 000 bakterií v 1 ml moči (8). Výsledky studií ale ukázaly, že asi u 20 % pacientů s počtem bakterií < 105 mikrobů/ml v odběru ze středního proudu moči byla zjištěna přítomnost bakterií v moči při současném odběru suprapubickou punkcí, a tudíž by podle současných doporučení u části dětí s počtem bakterií 104/ml, a dokonce i 103/ml byla vzhledem k nevýznamnosti bakteriurie IMC poddiagnostikována (9). Nižší kvantita bakterií v moči u dětí s IMC může být dána i zvýšenou diurézou při nadměrném příjmu tekutin nebo pomalejším růstem některých kmenů, jako je tomu v případě Staphylococcu saprophyticu (10). Při interpretaci mikrobiologického vyšetření moči musíme tedy v první řadě zohlednit způsob odběru moči. U části dětí diagnostikujeme tzv. asymptomatickou bakteriurii (AB) – nacházíme u nich významnou bakteriurii bez pyurie či klinických známek močové infekce. U dětí mladších než 1 rok byla zjištěna vyšší prevalence AB u chlapců (2,5 %) v porovnání s dívkami (0,2 %), v pozdějším věku je AB častější u dívek (11). Tyto děti není nutné léčit antibiotiky, jelikož bakteriurie obvykle časem vymizí. Kontaminace moči nebo přítomnost AB významně přispívá k falešně pozitivním diagnózám IMC, a proto by snaha o co nejkvalitnější odběr moči měla být prioritou lékaře i za cenu využití invazivních metod.
Odlišení akutní pyelonefritidy od infekce dolních močových cest
AP odlišíme od akutní cystitidy na základě odlišné symptomatologie i rozdílných laboratorních nálezů. K diferenciální diagnostice používáme upravená Jodalova kritéria (tabulka 6). Pacienti s AP mívají obvykle horečku, celkové příznaky a výraznější elevaci zánětlivých markerů. Typický je také sonografický nález renální parenchymové léze, případně zvětšení ledviny, ale v řadě případů bývá ultrazvukové vyšetření u dětí s AP normální (12). Vyšetření CRP, sedimentace erytrocytů a počet leukocytů v krevním obraze jsou hlavními běžně užívanými laboratorními parametry umožňujícími odlišit akutní cystitidu od AP. Nejspecifičtějším markerem postižení ledvin v rámci IMC je v současnosti prokalcitonin. Řada studií prokázala jeho korelaci se závažností bakteriálního zánětu, ale také s výskytem následného jizvení ledvin (13). Nevýhodou je jeho vysoká cena a obvykle nedostupnost v ambulantní sféře.
Tabulka 6 – Modifikovaná Jodalova kritéria (12)

Zobrazovací metody u dětí s akutní infekcí močových cest
Velmi přínosným, neinvazivním a široce dostupným zobrazovacím vyšetřením je sonografie, jež nám poskytuje informace o struktuře renálního parenchymu, velikosti ledvin, pánvičky, kalichů, šířce ureterů a síle stěny močového měchýře. S velkou přesností lze také změřit velikost postmikčního rezidua, čehož využíváme u dětí s podezřením na poruchu evakuace močového měchýře. Ultrazvukem můžeme diagnostikovat komplikované formy AP, jako jsou akutní fokální pyelonefritida či přítomnost abscesu. Hlavním přínosem sonografie je odhalení vrozené vady močového traktu, a proto je vhodné vyšetřit ultrazvukem všechny děti s febrilní IMC.
V minulých letech byla součástí vyšetřovacího schématu u všech dětí po prodělané AP i mikční cystografie (MCG), vyšetření, pomocí něhož lze zobrazit anatomii vývodného močového systému. U dětí s IMC provádíme MCG hlavně k detekci vezikoureterálního refluxu (VUR) a k posouzení tvaru uretry, v těchto případech je MCG zlatým standardem. V posledních letech se ale vyšetření MCG u dětí po prodělané AP indikuje selektivně. Víme, že sterilní primární VUR nemusíme léčit, jelikož není spojen s rizikem jizvení ledvin. Primární reflux má navíc u většiny dětí tendenci ke spontánní úpravě. Nevýhodou MCG je radiační zátěž spojená s tímto vyšetřením a nutnost katetrizace močového měchýře (2). V současnosti provádějí některá zahraniční pracoviště mikční sonografii, kde se namísto rentgenu používá ultrazvuk. Studie srovnávající sonografickou mikci s MCG ukazují, že toto vyšetření je velmi spolehlivé v detekci VUR (14). V České republice zatím ale mikční sonografie nemá rutinní využití. Zatímco v roce 1999 vydala American Academy of Pediatrics (AAP) doporučení provádět MCG u všech dětí ve věku od 2 měsíců do 2 let již po první atace APN, v roce 2011 již doporučovala vyšetření MCG pouze u dětí s opakovanou APN nebo u pacientů s abnormálním sonografickým nálezem a dále u dětí s jinou etiologií APN než Escherichia coli či u jedinců s těžkým průběhem APN (15). Podobně také britský National Institute for Health and Care Excellence (NICE) doporučuje provádět MCG pouze u vybrané skupiny pacientů (16). Tyto závěry jsme potvrdili i v retrospektivní studii provedené ve Fakultní nemocnici Motol, kdy jsme vyhodnotili data 182 dětí ve věku od 2 měsíců do 2 let po 1. atace APN. U dětí s recidivujícími APN jsme nalezli signifikantně vyšší výskyt VUR i dilatujícího VUR. Pokud bychom k MCG selektovali pacienty v souladu s doporučením AAP, ušetřili bychom 64 dětí invazivního vyšetření MCG (17). Kvalitně provedené sonografické vyšetření nám tedy významně pomohlo správně indikovat děti k MCG. Je ale potřeba zdůraznit, že tato problematika je stále předmětem diskuzí a názory na ni nejsou jednotné. Například Evropská pediatrická urologická společnost (ESPU) nadále ve svých doporučeních uvádí, že MCG by měly podstoupit všechny dívky bez ohledu na věk, ale také chlapci do 12 měsíců věku po proběhlé AP i s normálním ultrazvukovým nálezem (18). MCG se v minulosti prováděla s odstupem 4–6 týdnů od proběhlé infekce, protože se předpokládalo, že se tak lze vyhnout nálezu falešně pozitivního VUR. Srovnávací studie ale prokázaly, že MCG není nutno odkládat a můžeme ji indikovat již v průběhu prvního týdne u dítěte s již zaléčenou IMC a negativní kultivací moči (19).
Dalším vyšetřením, které má své důležité místo v diagnostice IMC a jejich následků, je statická scintigrafie ledvin. Tímto vyšetřením, kdy se dítěti podává radiofarmakum – nejčastěji dimerkaptosukcinát 99mTcDMSA –, získáváme informace o funkčnosti renálního parenchymu a stranové funkci ledvin. Parenchymová jizva se zobrazuje jako defekt vychytávání radiofarmaka; DMSA je považováno za nejspolehlivější vyšetření v diagnostice AP, není ale trvale dostupná a navíc je spojena s expozicí ionizujícímu záření. Provádí se častěji v indikovaných případech s odstupem 6 měsíců od infekce k posouzení případného renálního jizvení, a tedy chronického poškození ledvin.
Léčba akutní infekce močových cest
U dětí s IMC je hlavním terapeutickým opatřením časné nasazení antibiotika. Při léčbě dětí s AP můžeme podávat antibiotika parenterálně i per os. Mezi dětmi léčenými od počátku perorálními antibiotiky a jedinci léčenými iniciálně intravenózně (3–4 dny) s následným přechodem na perorální léčbu nebyl prokázán rozdíl v účinnosti léčby. Tyto dvě skupiny pacientů se nelišily ani v incidenci následného jizvení ledvin (20, 22). Věková hranice pro nutnost podání intravenózní léčby není jednotná. Závěry randomizovaných studií na velkých souborech dětí ukazují, že perorální podání je stejně účinné jako parenterální již u dětí nad 1 měsíc věku, ESPU i AAP doporučují možnost perorální léčby u dětí starších 2 měsíců, britský NICE navrhuje léčit perorálně děti až od 3 měsíců věku (15, 16, 18, 20, 22). Intravenózní podání antibiotik je dále indikováno u nemocných se strukturální vrozenou vadou vývodného močového systému, u dětí netolerujících perorální antibiotika či dostatečný příjem tekutin a v neposlední řadě u pacientů s těžším nebo septickým průběhem AP. Perorální léčba je tedy určena pro pacienty s nekomplikovaným průběhem AP, kteří tuto terapii dobře tolerují. Doporučená doba antibiotické léčby AP u dětí je 10–14 dní, volba antibiotika závisí na regionální prevalenci rezistence patogenů (19). Léčbu zahajujeme empiricky, léky první volby u nekomplikované AP jsou potencované aminopeniciliny a cefalosporiny druhé, případně třetí generace. Následně můžeme antimikrobní terapii upravit po obdržení výsledků močové kultivace. Doporučovaná antibiotika určená k léčbě IMC včetně jejich dávkování shrnují tabulky 7, 8 a 9. V případě nutnosti podání aminoglykosidů je u dětí starších než 1 měsíc podání v jedné dávce denně spojeno se stejnou účinností a menší toxicitou než v případě dávkování po 8 hodinách. V průběhu léčby aminoglykosidy je ale nutno monitorovat hladiny antibiotik v séru. (23, 24)
Během 24–48 hodin by mělo při adekvátní terapii AP dojít ke zlepšení klinického stavu dítěte, horečky však mohou přetrvávat i po 2 dnech od zahájení léčby (21). U dětí bez známek klinického zlepšení je vhodné provést kontrolní vyšetření včetně ultrazvuku ledvin. Eventuální úprava antibiotické léčby se odvíjí od výsledku kultivačního vyšetření moči. Pacienti s fokální nefritidou vyžadují kombinovanou antibiotickou léčbu, děti s abscesovou pyelonefritidou léčíme invazivně ve spolupráci s intervenčními radiology a urology.
Děti s akutní nekomplikovanou cystitidou by měly být primárně léčeny perorálně chemoterapeutiky – nitrofurantoinem, trimetoprimem či kotrimoxazolem. Alternativními léky jsou v indikovaných případech potencované aminopeniciliny a cefalosporiny druhé generace. Doba léčby je 3–7 dnů. V případě komplikované cystitidy je na místě vyšetření specialistou k odhalení možných příčin onemocnění (např. porucha evakuace močového měchýře). U těchto pacientů nacházíme často kultivačně širší spektrum bakterií a od toho se odvíjí i specifická cílená terapie (25). Četné studie prokázaly, že léčba obstipace vede ke snížení rekurence IMC. Pokud na základě anamnézy a vyšetření dítěte máme podezření na dysfunkční mikci, je nutné dítě odeslat k urologickému vyšetření (18).
Tabulka 7
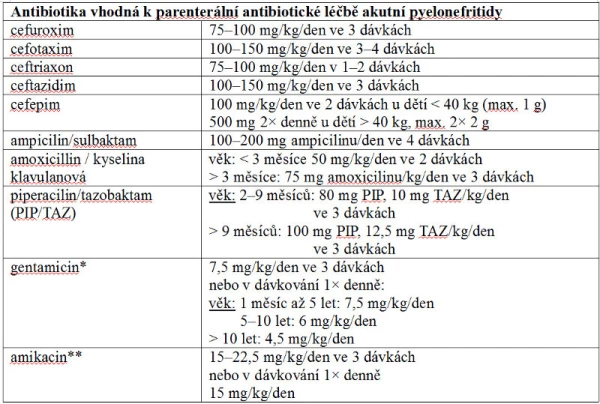
* Při dlouhodobém podávání gentamicinu je nutné monitorovat hladinu před podáním (trough level) a stropovou hladinu (peak level), která se zjišťuje 30 min po dokapání infuze s antibiotikem. CAVE – nefrotoxicita, ototoxicita! Nutné sledování renálních parametrů. Vzhledem k potenciaci ototoxicity není vhodné podávat aminoglykosidy spolu s furosemidem nebo kyselinou etakrynovou.
** Nutnost monitorace hladin, renálních funkcí, spektrum nežádoucích účinků je podobné jako u gentamicinu.
Tabulka 8
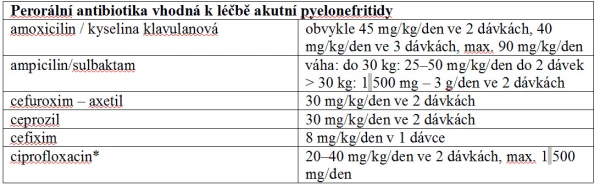
* Ciprofloxacin není u dětí obvykle lékem první volby. Nejčastější indikací je záchyt patogenního kmene rezistentního k ostatním testovaným perorálním antibiotikům. Výhody léčby musí převýšit riziko nežádoucích vedlejších účinků fluorochinolonu.
Tabulka 9
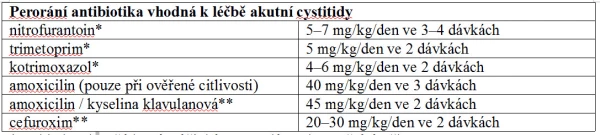
* Vzhledem k nežádoucím účinkům nepodávat do 2 měsíců věku.
** Indikované při nevhodnosti podání nitrofurantoinu, trimetoprimu.
Při léčbě IMC se všeobecně doporučuje klidový režim a adekvátní hydratace nemocného. K dispozici máme rovněž přípravky charakteru doplňkové léčby. Jsou jimi probiotika, živé organizmy přidávané do potravy a léčiv, které mají ovlivnit zdraví jedince zlepšením rovnováhy jeho střevní mikroflóry. Probiotika se doporučují jako doplněk k antibiotické léčbě, řada studií rovněž prokázala jejich efekt v profylaxi IMC. Dle závěrů některých prací by mohla být dokonce považována za alternativu antibakteriální profylaxe (26). Za hlavní mechanizmus účinku probiotik se pokládají prevence adheze mikroba na uroepitel a tvorba biofilmu spolu s redukcí pH. Podávání těchto přípravků děvčatům per os či lokálně umožňuje ovlivňovat vaginální prostředí redukcí pH a produkcí antibakteriálních substancí, což má vliv na prevenci močových infekcí, neboť právě poševní záněty bývají častými příčinami vzniku IMC (27). Také bylinné preparáty, z nichž nejčastěji se používají extrakty z brusinek, mají své místo v doplňkové léčbě IMC. Brusinky obsahují proanthokyanidin, látku s prokázanou schopností bránit vazbě bakteriálních fimbrií ke slizničnímu epitelu močových cest. Byl také popsán bakteriostatický účinek brusinek a jejich přímý efekt na snížení virulence Escherichie coli (28). Některé práce prokazují příznivé působení brusinkového džusu hlavně v rámci prevence vzniku močové infekce (29, 30, 31). Hodnocení výsledků studií komplikuje fakt, že doposud nebyly stanoveny jasné doporučené dávky brusinkového extraktu; navíc se preparáty liší v obsahu účinné látky. Výhodou zůstává, že tato léčba není spojena s výskytem závažných nežádoucích účinků. Pouze při konzumaci velkého množství brusinek přijímá pacient i nadbytek vitaminu C, což může dítě v některých případech predisponovat k tvorbě litiázy. Pozoruhodné jsou také výsledky randomizované studie s podáním D-manózy u dospělých žen s opakovanými IMC. D-manóza je sacharid taktéž bránící adhezi mikrobů k uroepitelu, její profylaktické podávání vedlo k významné redukci rekurentních IMC (32). Užívání profylaktických antibiotik u pacientů s recidivujícími IMC může být spojeno s výskytem nežádoucích účinků a s rizikem vzniku antibiotické rezistence, proto je podávání doplňkové léčby výhodné, k určení konkrétních doporučení musíme ale vyčkat na výsledky randomizovaných studií v dětské populaci.
Závěr
IMC v dětském věku diagnostikujeme na základě klinických příznaků a výsledků laboratorních vyšetření krve a moči. Hlavně u malých dětí mohou být příznaky infekce velmi nespecifické, a proto je někdy diagnóza stanovena s časovou prodlevou. Hlavní zdravotní rizika AP spočívají v možnosti tvorby jizev na ledvinách, které mohou být spojeny s trvalými následky pro nemocného. Správný odběr moči k vyšetření a její včasné zpracování jsou základními podmínkami pro získání co nejpřesnějších nálezů. IMC je vysoce suspektní při pozitivitě LE a nitritového testu. Při předpokladu, že pozitivní bakteriurie odpovídá množství patogenu ≥ 105/ml moči ze středního proudu, můžeme IMC významně poddiagnostikovat. Naopak pacienti, u nichž byl odebraný vzorek moči kontaminován nebo nesprávně zpracován, či děti s AB jsou v řadě případů neindikovaně léčeni antibiotiky. Perorální léčba AP je možná již u malých kojenců s nekomplikovanou infekcí bez vrozené vady uropoetického traktu, kteří tolerují antibiotika i dostatečný příjem tekutin. Mikční cystografie je podle většiny současných doporučení indikovaná pouze u vybraných pacientů a je možno ji provést časně. Probiotika a bylinné preparáty mají také své místo v léčbě a prevenci IMC, je však zapotřebí provést další randomizované studie k potvrzení jejich příznivého efektu.
- Chang S. L., Shortliffe L. D. Pediatric urinary tract infections. Pediatr Clin N Am 2006; 53 : 379–400.
- Tullus K. Vesicoureteric reflux in children, Lancet 2015; 385 : 371/9.
- Al-Orifi F., McGillivray D., Tange S et al. Urine culture from bag specimens in young children: are the risks too high? J Pediatr 2000; 137 : 221–6.
- Al-Orifi F., Mc Gillivray D., Tange S. Urine culture from bag specimens in young children: are the risks too high? J Pediatr 2000; 137 : 222 : 1–6.
- Dieter R. S. Sterile pyuria: A differential diagnosis, Compr Ther 2000; 26 : 150–2.
- Wise G. J., Schlegel P. N. Sterile pyuria. N Engl J Med. 2015; 372 : 1048–54.
- Simerville J. A., Maxted W. C., Pahira J. J. Urinalysis: a comprehensive review. Am Fam Physician 2005; 71 : 1153–62.
- Roberts K. B., Downs S. M., Finnell S. M. et al. Urinary tract infection: clinical practice guideline for the diagnosis and management of the initial UTI in febrile infants and children 2 to 24 months. Pediatrics 2011; 128 : 595–610.
- Koskimies O. Diagnostic accuracy of urinary tract infection and subsequent development of renal scars. J Pediatr 1995; 126 : 157–159.
- Franz M., Hörl W. H. Common errors in diagnosis and management of urinary tract infection. I: pathophysiology and diagnostic techniques. Nephrol Dial Transplant 1999; 14 : 2746–53.
- Wettergren B., Jodal U. Spontaneous clearence of asmyptomatic bacteriuria in infants. Acta Paediatr Scand 1990; 79 : 300–4.
- Janda J., Bébrová E., Bláhová K., Seeman T. Infekce močových cest a vezikoureterální reflux. In: Seeman T a kol. Dětská nefrologie, Mladá fronta, 2015 : 227–260.
- Shen J. N., Chang H. M., Chen S. M. et al. The role of procalcitonin for acute pyelonephritis and subsequent renal scarring in infants and young children. J Urol 2011; 186 : 2002–8.
- Darge K. Voiding ultrasonography with ultrasound contrast agents for the diagnosis of vesicouretericreflux in children. Pediatr Radiol 2008; 38 : 40–53.
- Roberts K. B., Downs S. M., Finnell S. M. et al.Urinary tract infection: clinical practice guideline for the diagnosis and management of the initial UTI in febrile infants and children 2 to 24 months. Pediatrics 2011; 128 : 595–610.
- Mori R., Lakhanpaul M., Verrier-Jones K. Diagnosis and management of urinary tract infection in children: summary of NICE guidance. BMJ 2007; 335 : 395–7.
- Mlynářová E., Zieg J., Sorantin E. Zobrazení močového traktu u dětí s febrilní infekcí močových cest ve věku 2–24 měsíců v centru terciální péče v České republice: zamyšlení nad současnými postupy. Ces Radiol 2013; 67 : 253–259.
- Stein R., Dogan H. S., Hoebek P. et al. Urinary Tract Infections in Children: EAU/ESPU Guidelines. Eur Urol 2015; 67 : 546–58.
- Strohmeier Y., Hodson E. M., Willis N. S. et al. Antibiotics for acutepyelonephritis in children. Cochrane Database Syst Rev 2014; 7: CD003772.
- Mahant S., Tot T., Friedman J. Timing of voidingcystourethrogram in the investigation of urinarytractinfections in children. J Pediatr 2001; 139 : 568–71.
- Hoberman A., Wald E. R., Hickey R. W. et al. Oral versus initial intravenous therapy for urinary tract infections in young febrile children. Pediatrics. 1999; 104 : 79–86.
- Montini G., Toffoo A., Zuchetta P. Antibiotic treatment for pyelonephritis in children: multicentre randomised controlled non-inferiority trial. BMJ. 2007; 335 : 386.
- Carapetis J. R., Jaquiery A. L., Buttery J. P. et al. Randomized, controlled trial comparing once daily and three time daily gentamicin in children with urinary tract infections. Pediatr Infect Dis J 2001; 20 : 240–6.
- Marik P. E., Havlik I., Monteagudo F. S. The pharmocokinetic of amikacin in critically ill adult and paediatric patients: comparison of once - versus twice-daily dosing regimens. J Antimicrob Chemother 1991; 27 : 81–9.
- Bartoníčková K., Bébrová E., Beneš J. et al. Doporučený postup pro antibiotickou léčbu komunitních infekcí ledvin a močových cest v primární péči. Prakt. lék. 2006; 86, 429–438.
- Lee S. J., Lee J. W. Probiotics prophylaxis in infants with primary vesicoureteral reflux. Pediatr Nephrol 2015; 30 : 609–13.
- Chapman C. M., Gibson G. R., Rowland I. Effects of single - and multi-strain probiotics on biofilm formation and in vitro adhesion to bladder cells by urinarytract pathogens. Anaerobe 2014; 27 : 71–6.
- Lavigne J. P., Bourg G., Combescure C. et al. In-vitro and in-vivo evidence of dose-dependent decrease of uropathogenic Escherichia coli virulence after consumption of commercial Vaccinium macrocarpon (cranberry) capsules. Clin Microbiol Infect 2008; 14 : 350–5.
- Afshar K., Stothers L., Scott H. et al. Cranberry juice for the prevention of pediatric urinary tract infection: a randomized controlled trial. J Urol 2012; 188 : 1584–7.
- Salo J., Uhari M., Helminen M., Korppi M., Nieminen T., Pokka T., Kontiokari T. Cranberry juice for the prevention of recurrences of urinary tract infections in children: a randomized placebo-controlled trial.Clin Infect Dis. 2012 Feb 1; 54 (3): 340–6.
- Helminen M., Korppi M., Nieminen T., Pokka T., Kontiokari T. Cranberry juice for the prevention of recurrences of urinary tract infections in children: a randomized placebo-controlled trial. Clin Infect Dis. 2012 Feb 1; 54 (3): 340–6.
- Altarac S., Papeš D. Use of D-mannose in prophylaxis of recurrent urinary tract infections (UTIs) in women.BJU Int. 2014 Jan; 113 (1): 9–10.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



