-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAktuální možnosti diagnostiky a léčby litiáz
Datum publikace: 15. 10. 2024
MUDr. Tomáš Ürge, Ph.D.
Urologická klinika LF UK a FN PlzeňIncidence a etiologie urolitiázy
Incidence litiázy závisí na geografických, klimatických, etnických, dietních a genetických faktorech. V souladu s tím se míra prevalence urolitiázy pohybuje od 1 do 20 % [1], v české populaci je to kolem 4 % [2]. Rozdíly jsou způsobeny rovněž pohlavím (muži : ženy 1,3–2,1) [3]. Litiázou trpí nejvíce lidé ve věku 20–50 let (cca 70 % případů). Odhaduje se, že incidence urolitiázy v těhotenství činí 0,03–0,4 % [3].
Pacient s prvním výskytem litiázy má 40–60% riziko, že se u něho litiáza v průběhu života zopakuje. 5leté riziko recidivy má přibližně 26 % nemocných. Vysoce recidivující onemocnění je pozorováno u více než 10 % pacientů [6]. Stanovení rizika tvorby litiázy je nezbytné pro volbu léčebného postupu. Předchozí litiatická anamnéza (recidiva, opětovný růst, operace litiázy) je základním prvkem při určování rizika. Riziko recidivy je určeno onemocněním nebo poruchou, která způsobuje tvorbu konkrementů.
Vysokou predispozici litiázy mají pacienti [2, 4, 5]:
- se strukturálními odchylkami vývodných cest močových (zúžení močovodu či pelviureterální junkce, ureterokéla, podkovovitá ledvina, vezikoureterální reflex);
- s metabolickými odchylkami (hyperkalciurie, hyperoxalurie, hyperurikosurie, cystinurie – tedy zvýšené vylučování vápníku, kyseliny šťavelové, močové a cystinu ledvinami do moči);
- s celkovým onemocněním (hyperparatyreóza, sarkoidóza, onemocnění střev spojená s poruchou vstřebávání živin /Crohnova choroba, malabsorpční syndromy/, dlouhodobá imobilizace;
- s expozicí horkému prostředí vedoucí k dehydrataci (např. práce ve sklárnách);
- s dědičnou predispozicí (častější výskyt urolitiázy v rodinách);
- s polékovou litiázou (kortikoidy, cytostatika, preparáty s obsahem Ca).
Rizikový stav by měl být stanoven komplexně s ohledem nejen na pravděpodobnost recidivy nebo progresi litiázy, ale také na riziko komplikací, jako je chronické onemocnění ledvin (CKD), konečné stadium onemocnění ledvin (ESRD) nebo metabolická porucha kostí (MBD). Urolitiáza může ohrozit renální funkce sekundárně v důsledku obstrukce, infekce či urologické léčby nebo primárně, což zahrnuje poškození renální tkáně v důsledku primárního onemocnění způsobujícího tvorbu litiázy (některá genetická onemocnění, nefrokalcinóza, enterická hyperoxalurie atd.) [7] (viz tab. 1).
Urolitiázu lze klasifikovat podle velikosti, lokalizace, rentgenových charakteristik, etiologie vzniku, složení a rizika recidivy:
- Velikost litiázy může být uvedena v jednom, dvou nebo třech rozměrech. V současné době guidelines Evropské urologické asociace (EAU) z roku 2024 stále používají základní dělení nemocných do skupin podle velikosti litiázy: < 5 mm, 5–10 mm, 10–20 mm a > 20 mm k sestavení léčebných algoritmů.
- Litiázu lze klasifikovat podle anatomické polohy: horní, střední nebo dolní kalich, ledvinná pánvička, horní, střední nebo distální ureter a močový měchýř.
- Litiázu klasifikujeme rovněž dle prostého snímku břicha (KUB) či nativního CT
(NCCT) a tento vzhled se liší podle minerálního složení [8] (viz tab. 2).
- Složení litiázy, které ovlivňuje její hustotu a vnitřní strukturu, je základem pro další rozhodnutí stran diagnostiky a managementu péče. Litiáza často vzniká ze směsi látek (viz tab. 3).
Tab. 1 Rizikové faktory pro CKD a metabolické onemocnění kostí u pacientů s litiázou (zdroj: EAU guidelines 2024)
Rizikové faktory pro CKD
ženské pohlaví
nadváha
časté uroinfekce a infekční litiáza
získaná jediná ledvina
neurogenní močový měchýř
předchozí obstrukční nefropatie
ileální konduit
Možné riziko CKD
– xanthinové kameny
– indinavirové kameny
– distální renální tubulární acidóza (nekompletní)
– primární hyperparatyreóza
– poruchy příjmu potravy a zneužívání laxativ
– medulární houbovitá ledvina
Střední riziko CKD
– štětinové kameny
– 2,8-dihydroxyadeninové kameny
– sarkoidóza
– pyeloureterální nebo ureterální striktury
Vysoké riziko CKD
– cystinové kameny
– struvitové kameny
– kameny v jedné ledvině
– distální renální tubulární acidóza (úplná)
– sekundární hyperoxalurie (bariatrická chirurgie, zánětlivé onemocnění střev, resekce střeva a malabsorpční syndromy)
– jiné formy nefrokalcinózy (často spojené s genetickými stavy s hyperkalciurií)
– anatomické abnormality ledvin a močových cest (např. podkovovitá ledvina, ureterokéla a vezikoureterální reflux)
– neurologický močový měchýř
Velmi vysoké riziko CKD
– primární hyperoxalurie
– autosomálně dominantní polycystická ledvina
Riziko metabolického onemocnění kostí
distální renální tubulární acidóza (úplná nebo neúplná)
medulární houbová ledvina
primární hyperparatyreóza
malabsorpční syndromy
hyperkalciurie nalačno
genetické poruchy
Tab. 2 Chemické složení litiázy (zdroj: EAU guidelines 2024)
Chemický název
Název minerálu
Chemický vzorec
monohydrát šťavelanu vápenatého
whewellit
Ca(C2O4).H2O
dihydrát šťavelanu vápenatého
weddellit
Ca(C2O4).2H2O
fosforečnan vápenatý
apatit
Ca10(PO4)6(OH)2
hydroxyfosforečnan vápenatý
apatit
Ca5(PO4)3(OH)
β-trikalciumfosfát
whitlockit
Ca3(PO4)2
karbonátapatit
dahllit
Ca5(PO4,CO3)3(OH)
dihydrát hydrogenfosforečnanu vápenatého
brushit
CaHPO4.2H2O
uhličitan vápenatý
aragonit
CaCO3
kyselina močová
uricit
C5H4N4O3
dihydrát kyseliny močové
uricit
C5H4N4O3.2H2O
hexahydrát fosforečnanu hořečnatoamonného
struvit
MgNH4PO4.6H2O
Tab. 3 Rentgenové charakteristiky litiázy (zdroj: EAU guidelines 2024)
rentgenkontrastní
špatná radioopacita
radiolucentní
dihydrát šťavelanu vápenatého
fosforečnan hořečnatoamonný
kyselina močová
monohydrát šťavelanu vápenatého
cystin
urát amonný
fosforečnan vápenatý
xanthin
Klinické projevy urolitiázy
Renální kolika se vyznačuje nepříjemnou až šokující bolestí v oblasti břišní dutiny. Vzniká náhle a bolest může být velmi intenzivní. Pacienti s kolikou bývají bledí, při prvním záchvatu bolestí většinou zvracejí, mohou mít zástavu pasáže plynů a stolice. Zatímco náhlé příhody břišní (NPB) zánětlivého charakteru provází zpravidla tachykardie, u renální koliky je tepová frekvence normální, velmi zřídka se objevuje bradykardie z podráždění vagu. Na rozdíl od většiny zánětlivých nebo perforativních příhod v dutině břišní, kde bolest nutí nemocného ke klidu, je kolika provázena motorickým neklidem. Nemocní nemohou nalézt úlevovou polohu, lépe bolest snášejí vstoje.
U konkrementu uloženého v horní třetině ureteru se bolest obvykle propaguje do varlete nebo vulvy, protože průběh nervového zásobení těchto orgánů je podobný (Th10–12). Při lokalizaci konkrementu ve střední části ureteru se bolest propaguje do McBurneyho bodu a může imitovat apendicitidu nebo vlevo divertikulitidu sigmatu. Při lokalizaci konkrementu v ústí močovodu mohou být příznakem polakisurie, urgence a bolesti za sponou (LUTS – symptomy dolních cest močových).
Břicho je třeba náležitě vyšetřit jako při náhlé příhodě břišní. Vyšetření per rectum či per vaginam může být bolestivé u pánevní ureterolitiázy [2]. Okamžité vyšetření je indikované u pacientů se solitární ledvinou, horečkou nebo při pochybnostech o diagnóze renální koliky.
Diagnostika urolitiázy
Základem diagnostiky jsou rodinná a osobní anamnéza (se zaměřením na litiázu a přidružené choroby) a fyzikální vyšetření (viz výše). Navazujícím krokem v diagnostice litiázy, který určuje další postup, jsou zobrazovací vyšetření.
Ultrazvuk
Ultrazvuk (UZ) by měl být použit jako primární diagnostický zobrazovací nástroj. Adekvátní léčba bolesti a dalších symptomů by neměla být zdržována zobrazovacími vyšetřeními. Ultrazvuk je bezpečný (bez rizika radiace), reprodukovatelný a levný a díky běžné dostupnosti i rychlý. Dokáže identifikovat přímo litiázu lokalizovanou v kalichu, pánvičce a pyeloureterových a vezikoureterových junkcích (UZ s naplněným měchýřem), stejně jako nepřímé známky litiázy – dilataci horních močových cest. Ultrazvuk má senzitivitu 45 % a specificitu 94 % pro ureterolitiázu a senzitivitu 45 % a specificitu 88 % pro nefrolitiázu [9, 10]. Je vyšetřením první volby i u těhotných a dětí, případně je vhodný pro sledování nekontrastní nefrolitiázy [11]. Jeho výtěžnost je ale značně ovlivněna řadou faktorů. Klíčovou roli má zručnost a zkušenost vyšetřujícího lékaře.
Nativní snímek břicha – nefrogram
Senzitivita a specificita nativního rtg snímku břicha (KUB) se pohybuje mezi 44 a 77 % [11]. Rentgenografie ledvin, močovodu a močového měchýře je užitečná při rozlišení mezi radiolucentními (nekontrastními) a radioopaktními (kontrastními) konkrementy a je využívána pro srovnání litiázy (progrese počtu, velikosti, hustoty) během sledování [12]. Podobný obraz jako litiáza mohou mít i kalcifikované uzliny nebo flebolity. Naopak litiázu může překrývat střevní plyn.
Výpočetní tomografie
Výpočetní tomografie (CT) bez použití kontrastní látky (NCCT – non-contrast computer tomography) se stala standardem pro diagnostiku akutní bolesti v boku a nahradila intravenózní urografii. Vyšetření je schopné detekovat konkrementy rentgen-nekontrastní (typicky uráty vzácněji xanthin), litiázu sumující se před struktury skeletu a rovněž případné tvarové nebo polohové anomálie ledviny. Jeho senzitivita a specificita dosahuje 95–100 % a umožňuje také hodnocení pomocí multiplanárních nebo 3D rekonstrukcí. Hlavním přínosem je možnost měření velikosti a denzity litiázy a dalších parametrů, jakými jsou vzdálenost od konkrementu k povrchu těla, lokalizace litiázy v dutém systému a tvar – délka infundibula, velikost infundibulárního úhlu a podobně. Díky těmto informacím pak můžeme nemocnému nabídnout optimální výkon. Nevýhodou je nemožnost zobrazení některých vzácných litiáz (jako např. indinavirové – proteázový inhibitor pro léčbu infekce HIV). Radiační riziko lze snížit nízkodávkovaným CT. Metaanalýza prospektivních studií [2,13] ukázala, že NCCT vyšetření diagnostikovalo urolitiázu se souhrnnou senzitivitou 93,1 %. CT s duální energií odliší konkrementy obsahující kyselinu močovou od litiázy obsahující vápník [14].
V případě detekce komplikované litiázy či patologie parenchymu lze doplnit další fáze tomografického vyšetření po aplikaci kontrastní látky včetně fáze vylučovací s modelací celého vývodného močového systému. Nezastupitelnou roli má CT s kontrastní látkou v případě urotelových nádorů horních močových cest. Vždy je ale nutné zvážit přínos kontrastního vyšetření oproti rizikům podání jodové kontrastní látky.
Vedle alergií na jodovou kontrastní látku stoupá v poslední době i incidence nefropatie indukované kontrastní látkou (CIN – contrast-induced nephropathy). CIN je definována jako akutní zhoršení renální funkce se zvýšením kreatininu o > 44 μmol/l nebo relativním zvýšením kreatininu o ≥ 25 % oproti vstupní hodnotě. K tomuto zhoršení renálních parametrů dochází během 48–72 hodin po podání kontrastní látky a může přetrvávat 3–5 dnů. Výskyt CIN u rizikových nemocných, jimiž pacienti s chronickou renální insuficiencí (CHRI) nepochybně jsou, se udává mezi 20 a 38 %. U běžné populace se udává výskyt CIN 0,6–2,3 %. U pacientů s kreatininem > 440 μmol/l je popsán výskyt CIN až v 50 % případů [15]. Výrazně vyšší riziko je u pacientů s CKD ≥ 4. stadia (glomerulární filtrace < 0,5 ml/s).
Rizikových faktorů CIN je řada. Některé jsou prakticky neovlivnitelné, jiné lze určitými – především preventivními – opatřeními ovlivnit. Mezi neovlivnitelné faktory rozvoje CIN patří CKD, diabetes mellitus, kardiální insuficience, věk > 75 let. Mezi ovlivnitelné faktory patří typ a množství kontrastní látky, dehydratace, hypotenze, hypoxie, anémie, hypoalbuminémie, hyponatrémie, hypokalémie. Zvláště rizikoví jsou diabetici s renální insuficiencí a zároveň s nefrotickým syndromem. Jednoznačně nejdůležitějším preventivním opatřením rozvoje CIN je adekvátní hydratace pacientů, racionální provádění intervenčních výkonů a použití izoosmolárních neiontových kontrastních látek (viz tab. 4). Pozitivní působení různých preventivních farmakologických režimů není zatím jednoznačně prokázáno [16].
Tab. 4 Obecná doporučení ohledně preventivních opatření rozvoje CIN u pacientů s CKD
Glomerulární filtrace
Preventivní opatření
Sledování
> 1 ml/s
kontrola hydratace – většinou p.o. (500 ml před vyšetřením, 2500 ml po vyšetření)
klinická observace pacienta
0,5–1 ml/s
i.v. hydratace (1 ml/kg/hod před vyšetřením a následně 12–24 hod po něm)
použití izoosmolární neiontové kontrastní látky
zvážit podání acetylcysteinu
stanovení sérového kreatininu před dimisí, do 72 hod od vyšetření
< 0,5 ml/s
nefrologické konzilium
i.v. hydratace
izoosmolární neiontová kontrastní látka
acetylcystein
v případě nutnosti zajištění hemodialýzy
opakované stanovení sérového kreatininu
Laboratorní vyšetření
Biochemické vyšetření je podobné u všech pacientů. Moč vyšetřujeme pomocí dipstick testů. Při podezření na zánětlivou komplikaci doplňujeme kultivační vyšetření moči a CRP v séru. Kultivace moči je rovněž nutná, pokud plánujeme intervenci. Zde je důležité doplnit též hemokoagulační vyšetření. Specifičtější analytický program by měli podstoupit pouze pacienti s vysokým rizikem recidivy konkrementu. Analýza složení konkrementu by měla být provedena vždy při prvním záchytu litiázy. Opakovat analýzu konkrementu je nutné v případě:
- recidivy v rámci farmakologické prevence;
- časné recidivy po intervenční terapii s úplným odstraněním kamenů;
- pozdní recidivy po prodlouženém období bez kamenů [19].
Diagnostika urolitiázy v těhotenství a u dětí
V těhotenství se urolitiáza projeví nejčastěji ve II. trimestru. Klinicky se renální kolika v těhotenství neliší od té, kterou pozorujeme u netěhotných. Renální kolika v těhotenství je rizikovým faktorem nízké porodní hmotnosti, předčasného porodu a císařského řezu. Ze zobrazovacích metod se primárně používá UZ. Při nedostatečné výpovědné hodnotě UZ může být použita magnetická rezonance (MRI). Ta nedokáže zobrazit konkrement přímo, ale jako výpadek v náplni moče. Poskytuje detailní anatomický obraz vývodného systému močových cest, přítomnosti obstrukce či stenózy ureteru a morfologie renálního parenchymu. V indikovaných život ohrožujících případech může být použito low dose NCCT (viz tab. 5).
Tab. 5 Diagnostika urolitiázy v těhotenství (zdroj: EAU guidelines 2024)
Souhrn důkazů
LE
Pro zobrazování u těhotných žen s podporou UZ a MRI existují pouze údaje na nízké úrovni důkazů
3
Doporučení
Hodnocení síly
Použijte UZ jako preferovanou zobrazovací metodu u těhotných žen
silný
Použijte MRI jako zobrazovací modalitu 2. linie u těhotných žen
silný
Použijte CT s nízkou dávkou jako poslední možnost u těhotných žen
silný
Děti s močovými kameny mají vysoké riziko recidivy, proto platí standardní diagnostické postupy pro vysoce rizikové pacienty, včetně validní analýzy konkrementů. Nejčastějšími nemetabolickými poruchami usnadňujícími tvorbu kamenů jsou vezikoureterální reflux, obstrukce ureteropelvické junkce, neurogenní měchýř a další mikční potíže. V zobrazovacích metodách je primární technikou UZ [17]. Pravidla provedení UZ jsou srovnatelná s vyšetřením pro dospělé. KUB přináší základní informace o radioopacitě a lokaci konkrementů a usnadňuje sledování. Při nejasném nálezu, zvláště pokud je litiáza sdružena s jinou patologii horních močových cest, lze využít vylučovací urografie, nízkodávkových protokolů CT nebo NCCT a MRI [18].
Léčba urolitiázy
Terapie urolitiázy je založena na mnoha parametrech a je individuální pro každého pacienta z důvodu velké diverzity onemocnění. Základem rozhodování o léčbě jsou kritéria jako velikost, počet, umístění a složení konkrementů. Dále je nutné vzít v úvahu individuální anatomii horních močových cest.
Analgetická terapie
V případě vzniku renální koliky je nutné efektivně léčit bolest a zabránit její recidivě. Při renální kolice probíhá léčba bolesti paralelně s vyšetřovacím procesem.
Lékem první volby je metamizol – metamizolum natricum monohydricum 500 mg v 1 ml injekčního roztoku 5 ml i.m. nebo i.v. nebo v rámci kombinovaného preparátu (metamizolum natricum 500 mg, pitofenoni hydrochloridum 2 mg, fenpiverinii bromidum 20 µg v 1 ml injekčního roztoku) 5 ml i.m. nebo i.v., který obsahuje i spasmolytickou složku (piritramid, fenpiverin). Metamizol je relativně kontraindikovaný u těhotných, v této situaci lze použít paracetamol 1 g i.v. [20].
Standardem jsou rovněž nesteroidní protizánětlivá léčiva (NSAIDs). Důvodem je kombinace analgetického účinku, antiedémového efektu, ovlivnění peristaltiky hladké svaloviny a změn renální hemodynamiky. U pacientů s poruchou funkce ledvin však užívání NSAIDs (vzhledem k poklesu glomerulární filtrace) může vést k jejímu dalšímu zhoršení. Je-li proto podezření na zhoršenou funkci ledvin s ohledem na anamnézu, komorbidity nebo podle aktuálních výsledků, nejsou NSAIDs doporučena. Diklofenak s ibuprofenem rovněž mohou zvyšovat riziko koronárních příhod [22]. Obezřetnost je zapotřebí u nemocných se srdečním selháním (NYHA II–IV), ischemickou chorobou srdce nebo dolních končetin (ICHS, ICHDK), cerebrální příhodou v anamnéze, předchozím infarktem myokardu (IM), těhotenstvím, floridním žaludečním vředem nebo srdečními vadami závislými na přítomnosti Botallovy dučeje. Injekčně podáváme diklofenak (1 amp. 3 ml/75 mg) i.m. či i.v. Doporučené perorální dávkování diklofenaku je 50 mg 3× denně ve formě tablet nebo čípků, v případě indometacinu se používá dávka 100 mg 2× denně, preferenčně ve formě čípků. Ibuprofen v dávce 400 mg 3× denně je také možný, ale jeho efekt je menší [23]. U pacientů se šancí na spontánní odchod konkrementu lze v této léčbě pokračovat, maximálně však po dobu 10 dnů.
Trimekain může být podáván u těžko řešitelných renálních kolik nejčastěji v kombinaci v infuzi F1/1 500 ml + 1 amp. 5 ml metamizol + 1 amp. trimekain 1 % i.v. Trimekain kromě alergie nemá další kontraindikace a je vhodný v těhotenství [20].
Opioidy, zejména pethidin, jsou spojeny s vysokou mírou zvracení ve srovnání s NSAIDs a nesou s sebou větší pravděpodobnost potřeby další analgezie. Pokud se používá opioid, doporučuje se, aby to nebyl pethidin. Kombinace opioidů a NSAIDs zvyšuje analgetický účinek ve srovnání se samotnými opioidy [24].
Pokud nelze analgezie dosáhnout farmakoterapií, je indikovaná intervence – drenáž pomocí ureterálního stentu, perkutánní nefrostomie nebo nejlépe definitivní odstranění konkrementu [25]. Obstrukce horních močových cest se všemi známkami infekce močových cest a/nebo anurií je urologický urgentní stav. Často je nezbytná naléhavá dekomprese, aby se zabránilo dalším komplikacím. Existují 2 možnosti pro urgentní dekompresi horních močových cest:
- zavedení ureterálního stentu;
- perkutánní nefrostomie.
Spolu s dekompresí ucpaného a infikovaného systému by měly být odeslány vzorky moči ke kultivačnímu vyšetření, případně nabrána hemokultura a okamžitě by měla být zahájena léčba antibiotiky. Definitivní odstranění konkrementu by mělo být odloženo, dokud se infekce nevyléčí [26].
Medikamentózní expulzní terapie
Konzervativní terapii nazývané též medikamentózní expulzní terapie (MET). Pro tuto metodu primárně indikujeme konkrementy s vysokou pravděpodobností spontánního odchodu (≤ 5 mm), bez přítomnosti komplikujících faktorů (infekce močových cest, obstrukce ureteru solitární ledviny). Současně pacient musí být schopen tolerovat obtíže, které konkrement vyvolává. Indikací k ukončení konzervativní terapie je výskyt komplikací a intolerance obtíží. Pokud konkrement neodejde, je nutné terapii ukončit po 4 týdnech vzhledem k riziku poškození funkce ledviny [2].
Při posuzování šance na spontánní odchod konkrementu je hlavní kritériem jeho velikost. Metaanalýza provedená panelem expertů Americké urologické asociace (AUA) a Evropské urologické asociace (EAU) prokázala, že konkrementy o velikosti < 5 mm mají v průběhu 2 týdnů až 68% pravděpodobnost (rozmezí 46–85 %) spontánního odchodu a konkrementy o velikosti 5–10 mm mají 47% pravděpodobnost (rozmezí 36–59 %). Pro konkrementy o velikosti > 10 mm nejsou dostupné spolehlivé údaje [27].
Spontánní průchod kamenů byl hlášen u 49–52 % konkrementů v horním ureteru, 58–70 % ve středním ureteru a 68–83 % v distálním ureteru. Vzhledem k velikosti téměř 75 % konkrementů < 5 mm a 62 % konkrementů ≥ 5 mm vymizelo spontánně, s průměrnou dobou do vypuzení asi 17 dní (rozmezí 6–29 dní) [31]. Vzhledem k velikosti i lokalizaci mají konkrementy o velikosti < 5 mm v distálním ureteru 89% šanci na spontánní průchod, zatímco pouze 71 % konkrementů o velikosti < 5 mm lokalizovaných v horním ureteru stále spontánně projde [31]. Spontánní expulze konkrementu klesá s rostoucí velikostí.
Jako statisticky významný prvek podporující expulzi konkrementu se ukázal účinek skupiny alfa1-blokátorů (nejčastěji hodnocený byl z této skupiny tamsulosin) [28, 29], jež zvyšují pravděpodobnost spontánního odchodu o 29 %. Expulzní léčba také vede k mírnému urychlení pasáže litiázy a snižuje nutnost používání analgetik a výskyt epizod renální koliky.
Obecně lze tedy říci, že pro konkrementy o velikosti < 10 mm je možné iniciálně navrhnout sledování a medikamentózní expulzní léčbu. Podmínkou je dostatečné poučení pacienta, absence známek uroinfektu a sepse, dobrá kontrola bolesti, adekvátní rezerva renálních funkcí a pravidelné kontroly monitorující postup litiázy a dilataci horních močových cest. Nemocného je nutné poučit též o možné hypotenzi a retrográdní ejakulaci. Konkrementy o velikosti > 10 mm by primárně neměly být indikované k observaci. Aktivní řešení je ale obecně doporučované již od velikosti 7 mm, protože šance na spontánní odchod je relativně malá.
Chemolýza
Kameny složené z kyseliny močové lze rozpustit perorální chemolýzou založenou na aplikací alkalického citrátu (kalii natrii hydrogenocitras 2,4 g v 1 odměrce či magistraliter kalium citrát 500 mg v 1 tobolce) nebo hydrogenuhličitanu sodného, čímž se upraví pH moči na 7,0–7,2. Účinnost chemolýzy se uvádí 80,5 %. Komplikacemi vyžadujícími přerušení či vysazení hemolýzy mohou být uroinfekce, gastrointestinální obtíže (akutní gastritida) a obstrukce močových cest vyžadující další intervenci [30]. V případě obstrukce sběrného systému kyselinou močovou je možná perorální chemolýza v kombinaci s drenáží moči uretrálním stentem.
Chirurgická léčba urolitiázy
Před chirurgickou léčbou by pacienti měli být informováni o jednotlivých metodách včetně vysvětlení rozdílů v úspěšnosti a výskytu komplikací, délce pobytu v nemocnici a agresivity zvolené metody, aby si vybrali mezi dostupnými modalitami. Výběr postupu závisí na mnoha faktorech, jež souvisejí s konkrementy (velikost, umístění a hustota) a také se samotným pacientem (tělesný habitus, anatomie dutého systému, krvácivé poruchy a další potenciální komorbidity). V tab. 6 jsou výkony rozděleny dle rizika krvácení.
Tab. 6 Stratifikace rizika krvácení v rámci procedur léčby litiázy (zdroj: EAU guidelines 2024)
Procedury s nízkým rizikem krvácení
- cystoskopie
- flexibilní cystoskopie
- ureterální katetrizace
- extrakce ureterálního stentu
- utereroskopie
Procedury s vysokým rizikem krvácení
- litotrypse rázovou vlnou
- perkutánní nefrostomie
- perkutánní nefrolitotomie
Je tedy vždy nutné individuálně zvážit přínos zvolené metodiky a riziko peroperačního či pooperačního krvácení. Zde ureteroskopie včetně flexibilní přináší alternativu léčby litiázy, která by primárně mohla být léčená extrakorporální litotrypsí či perkutánní extrakcí. Vysoký BMI může představovat vyšší anestetické riziko a nižší úspěšnost po SWL a PCNL (viz níže). Kameny složené z brushitu, monohydrátu kalciumoxalátu nebo cystinu jsou zvláště tvrdé, stejně jako homogenní kameny s vysokou hustotou na NCCT
Chirurgická léčba nefrolitiázy
Indikace pro odstranění nefrolitiázy dle guidelines EAU 2024 zahrnují:
- růst konkrementu;
- litiázu u vysoce rizikových pacientů (predispozice, recidiva);
- obstrukční nefrolitiázu;
- infekční litiázu;
- symptomatickou litiázu (např. bolest či hematurie);
- preference pacienta.
Otázka, zda by se měla léčit asymptomatická kalikolitiáza, stále není zodpovězena. Indikacemi pro terapii jsou růst litiázy, de novo obstrukce, přidružená infekce a akutní či chronická bolest. Pokud kalikolitiáza zůstává objemově stabilní nejméně 6 měsíců, je možné ji sledovat v ročních intervalech, záleží však na preferencích pacienta.
Pro nefrolitiázu jsou obecně dané tyto možnosti:
- extrakorporální litotrypse (SWL – shock wave lithotripsy);
- flexibilní ureterorenoskopie (RIRS – retrograde intrarenal sugery);
- perkutánní extrakce (PCNL – percutaeous nephrolithotomy, česky PEK).
Zatímco účinnost PCNL není velikostí konkrementu ovlivněna, SFR (stone free rate, tj. podíl odstranění konkrementu) pro SWL či RIRS je nepřímo úměrný velikosti konkrementu [32]. PCNL však s sebou nese vyšší riziko krvácení a je spojena s delší hospitalizací. Mezi zahrnutými studiemi nicméně existuje vysoký stupeň heterogenity [33].
Konkrementy o velikosti > 20 mm by měly být léčeny primárně pomocí PCNL. Alternativou je RIRS u pacientů, kde je PCNL spojen s vysokým rizikem komplikací, ať již krvácivých či obecných, vycházejících z polohy při výkonu a dalších dle přidruženého onemocnění [34]. Je však nutné počítat s opakovaným výkonem. Kombinace PCNL a RIRS může být vhodnou alternativou pro léčbu objemné až odlitkové nefrolitiázy ve srovnání se standardní PCNL; úroveň existujících důkazů je ovšem nízká [35].
Obecně lze SWL doporučit u konkrementů o velikosti ≤ 20 mm, s výjimkou litiázy v dolním kalichu. Když se uvažuje o SWL u konkrementů s denzitou > 1000 HU (a vysokou homogenitou), na NCCT je méně pravděpodobné, že budou dezintegrované [36]. RIRS je považována za efektivnější metodu ve srovnání se SWL, protože dosahuje větší míry úspěšnosti co do kompletního odstranění litiázy na počet výkonů. Ve srovnání s PCNL a RIRS je u SWL méně celkových komplikací. V metaanalýze se vyskytlo 18,43 % komplikací Clavien I–II a 2,48 % komplikací Clavien III–IV [37]. Rozhodovací algoritmus, jakou metodu využít při léčbě nefrolitiázy dle guidelines EAU 2024, zobrazuje obr. 1.
Obr. 1 Algoritmus rozhodování ohledně volby metody léčby nefrolitiázy (zdroj: EAU guidelines 2024)
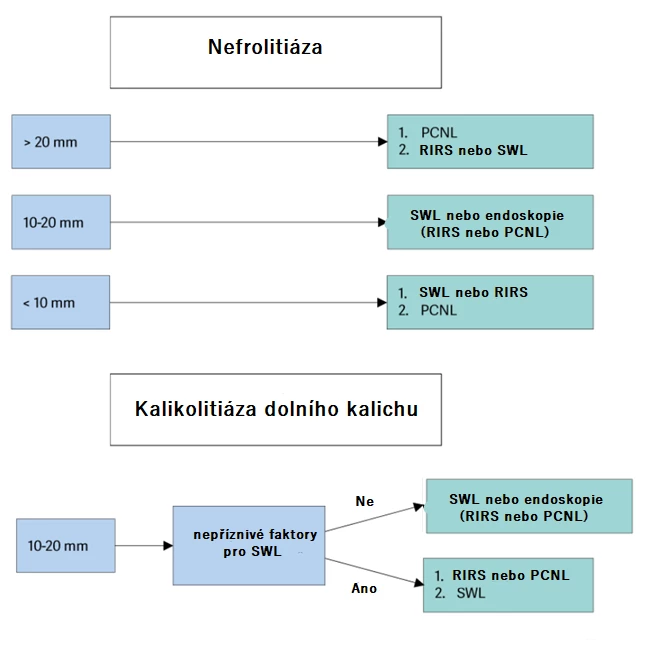
Existuje několik kontraindikací SWL:
- těhotenství, kvůli potenciálním účinkům na plod [38];
- krvácivé poruchy, které by měly být kompenzovány alespoň 24 hodin před léčbou a 48 hodin po ní [39];
- nekontrolované uroinfekce;
- závažné kosterní malformace a obezita, jež brání zacílení litiázy;
- arteriální aneuryzma v blízkosti litiázy [40];
- anatomická obstrukce distálně od trimovaného konkrementu.
Stejně tak existují relativní i absolutní kontraindikace PCNL:
- neléčená uroinfekce;
- nádor v oblasti předpokládaného přístupového traktu;
- těhotenství;
- pacienti, kteří dostávají antikoagulační léčbu, musejí být před operací i po ní pečlivě sledováni; antikoagulační léčba musí být před PCNL přerušena [41].
Pokud jde o RIRS, kromě celkových problémů, napíklad s celkovou anestezií nebo neléčenou uroinfekcí, lze výkon provést u všech pacientů bez specifických kontraindikací.
Princip a provedení SWL
Generátory rázové vlny se obecně dělí dle principu vzniku rázové vlny. Existuje elektromagnetický, elektrohydraulický a piezoelektrický generátor. Právě díky rozdílnému způsobu vzniku má rázová vlna jednotlivých generátorů odlišné fyzikální vlastnosti, přičemž nejvyšší tlak na litiázu vyvíjí vlna elektromagnetických generátorů. Způsob zaměření litiázy je pak skiaskopický či ultrazvukový. Některé přístroje umožnují oba způsoby. Výkon se nejčastěji provádí v analgezii či analgosedaci. Právě důsledná kontrola bolesti je nezbytná k omezení pohybů pacienta a nadměrných respiračních exkurzí vyvolaných bolestí [42]. Ke kvalitě výsledku přispívá rovněž pečlivá kontrola zaměření litiázy během výkonu [43].
Počet rázových vln, které lze aplikovat při každém sezení, závisí na typu litotryptoru a výkonu rázové vlny. Neexistuje jednotný názor na jejich maximální počet. [44]. Zahájení SWL nižší energií s postupným zvyšováním výkonu zabraňuje poškození ledvin [45]. Doporučená frekvence je 60–90 rázů za minutu [46]. Neexistují žádné průkazné údaje o doporučených intervalech mezi výkony, pokud nedojde k uspokojivé desintegraci po jedné aplikaci. [47]. MET může snížit požadavky na analgetika a podobně jako diuretická terapie může významně zlepšit SFR a urychlit průchod konkrementů po SWL [48].
Provedení RIRS
Většina výkonů se provádí v celkové nebo spinální anestezii [49]. Užitečné může být začít výkon semirigidním uretroskopem a využít jej pro dilataci močovodu pod optickou kontrolou. Pokud ureterální přístup není možný, alternativu nabízí zavedení ureterálního stentu s následným RIRS po 7–14 dnech [50]. Rutinní prestenting však není nutný. Tento postup sice zvýší úspěšnost zavedení flexibilního uretroskopu či access sheath, a usnadní tak výkon, na možné perioperační komplikace ovšem vliv nemá. [51]. Měli bychom také vzít v úvahu, že se zavedením stentu pacient pociťuje bolest či iritační obtíže spojené se stentem do doby finálního výkonu.
Pokud je to nutné, lze výkon provést bilaterálně [52]. Je třeba však počítat s mírně nižším SFR a vyšším výskytem komplikací (většinou menší, Clavien 1 a 2) [53]. Použití ureterálního access sheath je bezpečné a umožnuje bezpečné opakované zavedení endoskopu do horních partií močových cest, zlepšuje irigaci, snižuje intrarenální tlak, snižuje riziko termického poškození a potenciálně zkracuje operační čas [54, 55].
U RIRS bylo dosaženo velkého technologického pokroku. Systematický přehled zaměřený na nefrolitiázu > 2 cm ukázal kumulativní SFR 91 % při 1,45 výkonu na pacienta; 4,5 % komplikací bylo > Clavien 3 [42]. Obtížná anatomie dolního pólu, jako je strmý infundibulopelvický úhel, predisponuje k selhání během RIRS [56] Jednorázové ureteroskopy poskytují podobnou bezpečnost a klinickou účinnost jako opakovaně použitelné. Strategie dust and go by se měly omezit na léčbu velkých konkrementů [57].
Nejúčinnějším a nejrozšířenějším systémem litotrypse je holmium : yttrium-aluminium-granátový laser (Ho:YAG), který je v současnosti optimálním standardem pro RIRS a ureteroskopii. Ve srovnání s lasery s nízkým výkonem zkracuje vysokovýkonný laser dobu výkonu [58]. Thuliový vláknový laser (TFL) nabízí rovněž dobré klinické výsledky, které se zdají být srovnatelné s Ho:YAG [59].
Randomizované prospektivní studie zjistily, že rutinní stentování po nekomplikovaném RIRS není nutné. Stentování může být spojené s vyšší pooperační morbiditou a náklady [60]. Stenty by měly být zavedeny u pacientů, u kterých je zvýšené riziko komplikací (např. ureterální trauma, reziduální fragmenty, krvácení, perforace, infekce močových cest). Ideální délka stentování není známa. Většina urologů upřednostňuje 1–2 týdny po RIRS.
Provedení PCNL
Perkutánní nefrolitotomie zůstává standardním postupem u velkých ledvinových konkrementů. Pronační či modifikovaná supinační poloha jsou stejně bezpečné, záleží hlavně na zvyklosti pracoviště [61]. Kombinace perkutánního přístupu a RIRS může být vhodnou alternativou pro léčbu nefrolitiázy ve srovnání se standardní PCNL [62]. Výkon začíná punkci dutého systému nejčastěji pod UZ kontrolou. Předoperační CT nebo intraoperační UZ umožňuje identifikaci tkáně mezi kůží a ledvinou a snižuje výskyt viscerálního poranění [63].
K dispozici je několik metod intrakorporální litotrypse během PCNL. Ultrazvukové, pneumatické a kombinované systémy se nejčastěji používají pro rigidní nefroskopii, zatímco laser se stále více využívá pro miniaturizované a flexibilní nástroje [64]. Dilatace punkčního kanálu (přístupového traktu) lze dosáhnout pomocí kovového teleskopického jednorázového (jednorázového či sériového) dilatátoru nebo balonkového dilatátoru, přičemž bezpečnost a účinnost jsou obdobné [65]. Několik metaanalýz mini-PCNL (12–22 F) vs. standardní PCNL (> 22 F) zjistilo, že obě techniky vykazují podobnou SFR. Pacienti léčení mini-PCNL měli menší krevní ztráty, nižší četnost transfuzí a také kratší dobu hospitalizace, bez významného rozdílu v celkovém počtu komplikací [66, 67]. Rozhodnutí, zda ponechat po výkonu nefrotomii, či ureterální stent, závisí na:
- přítomnosti reziduální litiázy;
- krvácení z punkčního kanálu;
- roztržení dutého systému s možným urinózním únikem;
- obstrukcí močovodu;
- potenciální perzistentní bakteriurii v důsledku infikovaných konkrementů;
- solitární ledvině;
- možné koagulopatii.
Oproti výše uvedenému tubeless PCNL (není ponechána nefrotomie či uretrální stent) po nekomplikovaném výkonu snižuje pooperační bolest a zkracuje čas hospitalizace [68]. Při odlitkové litiáze je možné během jednoho výkonu zvážit vícetraktový přístup (je provedeno několik punkcí), a i když se jedná o obecně přijímanou praxi, je třeba zdůraznit zvýšené riziko pooperačních komplikací. U těchto pacientů je možné zvážit RIRS v kombinaci s PCNL a vyhnout se vícenásobné punkci ledviny [69]. Pooperační krvácení z punkčního kanálu lze omezit klampováním nefrotomie, při závažném krvácení je pak indikovaný angiografický výkon se selektivní embolizací zdroje krvácení.
Chirurgická léčba ureterolitiázy
Indikacemi pro odstranění ureterolitiázy jsou:
- konkrementy s nízkou pravděpodobností spontánního průchodu;
- přetrvávající bolest navzdory adekvátní analgetické medikaci;
- přetrvávající obstrukce;
- renální insuficience (selhání ledvin, bilaterální obstrukce nebo jedna ledvina).
Výběr postupu závisí na mnoha faktorech, mj. souvisejících s velikostí, umístěním a hustotou litiázy, ale též se samotným pacientem (tělesný habitus, anatomie močových cest, krvácivé poruchy a další potenciální komorbidity). Jak již bylo zmíněno, CT zobrazení může poskytnout informace, jež mohou ovlivnit volbu léčby. Metaanalýza ukazuje, že rostoucí hustota konkrementů, vzdálenost mezi konkrementem a povrchem těla a hydronefróza mohou negativně ovlivnit úspěch SWL [70]. Uretroskopie (URS) je efektivnější metodou a dosahuje vyšší SFR po jednom výkonu [71]. Rovněž počet výkonů nutných ke kompletnímu odstranění ureterolitiázy je nižší [72]. Jedná se navíc o bezpečnou metodu u obézních a morbidně obézních [73]. Primární nebo urgentní ureteroskopie se jeví jako bezpečný a proveditelný postup pro pacienty s renální kolikou způsobenou obstrukčním ureterolitiázou [74]. U velkých konkrementů v proximálním ureteru může perkutánní antegrádní přístup poskytnout lepší výsledky SFR než retrográdní ureteroskopický přístup.
Obr. 2 Algoritmus rozhodování ohledně volby metody léčby ureterolitiázy (zdroj: EAU guidelines 2024)
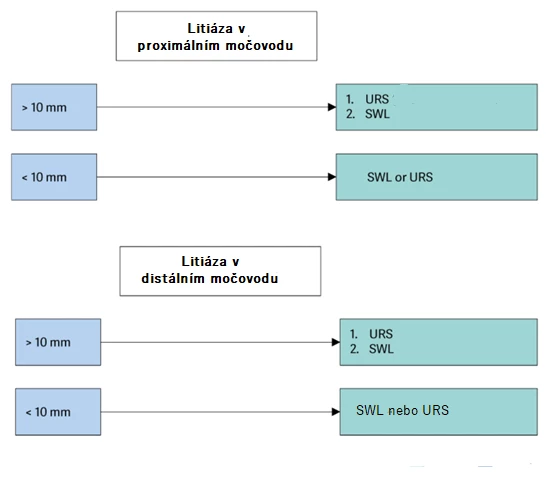
Další přístupy k léčbě urolitiázy
Pokrok v SWL a endourologických výkonech snížil indikace k otevřené či laparoskopické operaci litiázy. Objemné až odlitkové konkrementy se řeší primárně pomocí PCNL, případně kombinovaným přístupem PCNL a RIRS. Pokud by tento postup, který je možné využít i opakovaně, úspěšný nebyl, je možné zvážit otevřený, laparoskopický nebo roboticky asistovaný výkon. Vždy je však třeba postupovat individuálně. Otevřená operace by měla být považována za poslední možnost léčby [75–77].
Léčba pacientů s reziduální litiázou
Po počáteční léčbě SWL, URS, RIRS či PCNL mohou zůstat reziduální fragmenty. Ty mohou vyžadovat další intervenci. Kruciální v indikacích dalšího výkonu jsou zobrazovací metody. Nejvyšší senzitivitu má pochopitelně CT. Přínos jeho využití musí být vyvážen expozici ionizujícímu záření ve srovnání s KUB a UZ. Riziko recidivy litiázy u pacientů s reziduálními fragmenty je vyšší [78]. Falešně pozitivní výsledky dané fragmenty, u kterých může dojít ke spontánní expulzi, však mohou vést k nadměrné léčbě. Jako nejvhodnější se proto jeví kontrolní zobrazení po 4 týdnech po výkonu [79].
Chirurgická léčba urolitiázy v těhotenství
Léčba těhotné ženy s urolitiázou je složitá a vyžaduje úzkou spolupráci mezi pacientkou, radiologem, porodníkem a urologem. Preferovaným přístupem je konzervativní postup. U obstrukční litiázy je nutné zavedení ureterálního stentu nebo perkutánní nefrotomie [80]. Elektivní ureteroskopie je proveditelná ve II. trimestru těhotenství při výrazných LUTS způsobených stentem nebo po opakovaném selhání stentu. [81]. PCNL oproti zavedení ureterálního stentu nepřináší významný rozdíl v četnosti nežádoucích těhotenských příhod.[82]. Těhotenství je absolutní kontraindikací SWL.
Literatura:
- Sorokin I. et al. Epidemiology of stone disease across the world. World J Urol 2017; 35 : 1301–1320.
- Ürge T., Běhounek P., Janda V. et al. Renální kolika. Urologie pro praxi 2016; 17 (5): 210–213.
- Saussine C. Particularités de la colique néphrétique chez la femme enceinte. Prog Urol 2013; 23: F34–F39.
- Corrales M. et al. Classification of stones according to Michel Daudon: a narrative review. Eur Urol Focus 2021; 7 : 13.
- Halbritter J. Genetics of kidney stone disease – polygenic meets monogenic. Nephrol Ther 2021; 17S: S88.
- Ferraro, P.M. et al. Risk of recurrence of idiopathic calcium kidney stones: analysis of data from the literature. J Nephrol 2017; 30 : 227.
- Gambaro G. et al. The risk of chronic kidney disease associated with urolithiasis and its urological treatments: a review. J Urol 2017; 198 : 268.
- Kim S. C. et al. Cystine calculi: correlation of CT-visible structure, CT number, and stone morphology with fragmentation by shock wave lithotripsy. Urol Res 2007; 35 : 319.
- Ray A. A. et al. Limitations to ultrasound in the detection and measurement of urinary tract calculi. Urology 2010; 76 : 295.
- Smith-Bindman R. et al. Ultrasonography versus computed tomography for suspected nephrolithiasis. N Engl J Med 2014; 371 : 1100.
- Heidenreich A., Desgrandschamps F., Terrier F. Modern approach of diagnosis and management of acute flank pain: review of all imaging modalities. Eur Urol 2002; 41 (4): 351–362.
- Kennish S. J. et al. Is the KUB radiograph redundant for investigating acute ureteric colic in the non-contrast enhanced computed tomography era? Clin Radiol 2008; 63 : 1131.
- Xiang H. et al. Systematic review and meta-analysis of the diagnostic accuracy of low-dose computed tomography of the kidneys, ureters and bladder for urolithiasis. J Med Imaging Radiat Oncol 2017; 61 : 582.
- McGrath T. A. et al. Diagnostic accuracy of dual-energy computed tomography (DECT) to differentiate uric acid from non-uric acid calculi: systematic review and meta-analysis. Eur Radiol 2020; 30 : 2791.
- Barrett B. J., Parfrey P. S. Preventing nephropathy induced by contrast medium. N Engl J Med 2006; 354 : 379–386.
- Reitnerová J. Prevence nefropatie indukované kontrastními látkami u nemocných s chronickým onemocněním ledvin. Interní medicína 2009; 11 (7–8): 324–326
- Palmer L. S. Pediatric urologic imaging. Urol Clin North Am 2006; 33 : 409.
- Grivas N. et al. Imaging modalities and treatment of paediatric upper tract urolithiasis: a systematic review and update on behalf of the EAU urolithiasis guidelines panel. J Pediatr Urol 16 : 612.
- Kourambas J. et al. Role of stone analysis in metabolic evaluation and medical treatment of nephrolithiasis. J Endourol 2001; 15 : 181.
- Beniač P. et al. Renální kolika v ordinaci PL (diagnostika, léčba a následné možnosti specialisty). Practicus 2018; 6 : 8–12.
- Scales C. D. jr., Bergman J., Carter S. et al. Quality of acute care for patients with urinary stones in the United States. Urology 2015; 86 (5): 914–921.
- Pathan S. A. et al. A systematic review and meta-analysis comparing the efficacy of nonsteroidal anti-inflammatory drugs, opioids, and paracetamol in the treatment of acute renal colic. Eur Urol 2018; 73 : 583.
- Lee A., Cooper M. G., Craig J. C. et al. Effects of nonsteroidal anti-inflammatory drugs on postoperative renal function in adults with normal renal function. Cochrane Database Syst Rev 2007; 2: CD002765.
- Safaie A. et al. Intravenous morphine plus ibuprofen or ketorolac versus intravenous morphine alone in reducing renal colic pain intensity in emergency department: a randomized, double-blind clinical trial. Turk J Emerg Med 2022; 22 : 8.
- Guercio S. et al. Randomized prospective trial comparing immediate versus delayed ureteroscopy for patients with ureteral calculi and normal renal function who present to the emergency department. J Endourol 2011; 25 : 1137.
- Wang C. J. et al. Percutaneous nephrostomy versus ureteroscopic management of sepsis associated with ureteral stone impaction: a randomized controlled trial. Urolithiasis 2016; 44 : 415.
- Lee A., Cooper M. G., Craig J. C. et al. Effects of nonsteroidal anti-inflammatory drugs on postoperative renal function in adults with normal renal function. Cochrane Database Syst Rev 2007; 2: CD002765.
- Sun X., He L., Ge W., Lv J. Efficacy of selective alpha1D-blocker naftopidil as medical expulsive therapy for distal ureteral stones. J Urol 2009; 181 (4): 1716–1720.
- Sur R. L., Shore N., L'Esperance J. et al. Silodosin to facilitate passage of ureteral stones: a multi-institutional, randomized, double-blinded, placebo-controlled trial. Eur Urol 2015; 67 (5): 959–964.
- El-Gamal O. et al. Role of combined use of potassium citrate and tamsulosin in the management of uric acid distal ureteral calculi. Urol Res 2012; 40 : 219.
- Shah T. T. et al. Factors associated with spontaneous stone passage in a contemporary cohort of patients presenting with acute ureteric colic: results from the Multi-centre Cohort Study Evaluating the Role of Inflammatory Markers in Patients Presenting with Acute Ureteric Colic (MIMIC) study. BJU Int 2019; 124 : 504.
- Dasgupta R. et al. Shockwave lithotripsy versus ureteroscopic treatment as therapeutic interventions for stones of the ureter (TISU): a multicentre randomised controlled non-inferiority trial. Eur Urol 2021; 80 : 46.
- Dorantes-Carrillo L. A. et al. Retrograde intrarenal surgery versus miniaturized percutaneous nephrolithotomy for kidney stones >1 cm: a systematic review and meta-analysis of randomized trials. Eur Urol Focus 8 : 259.
- Fayad M. K. et al. Retrograde intrarenal surgery versus percutaneous nephrolithotomy for treatment of renal pelvic stone more than 2 centimeters: a prospective randomized controlled trial. Urolithiasis 2022; 50 (1): 113–117.
- Abdullatif V. A. et al. the safety and efficacy of endoscopic combined intrarenal surgery (ECIRS) versus percutaneous nephrolithotomy (PCNL): a systematic review and meta-analysis. Adv Urol 2022; 2022 : 1716554.
- Yamashita S. et al. Noncontrast computed tomography parameters for predicting shock wave lithotripsy outcome in upper urinary tract stone cases. Biomed Res Int 2018; 2018 : 9253952.
- Tzelves L. et al. Shockwave lithotripsy complications according to modified Clavien-Dindo grading system. a systematic review and meta-regression analysis in a sample of 115 randomized controlled trials. Eur Urol Focus 2022; 8 : 1452.
- Ohmori K. et al. Effects of shock waves on the mouse fetus. J Urol 1994; 151 : 255–258.
- Streem S. B. et al. Extracorporeal shock wave lithotripsy in patients with bleeding diatheses. J Urol 1990; 144 : 1347.
- Carey S. W. et al. Extracorporeal shock wave lithotripsy for patients with calcified ipsilateral renal arterial or abdominal aortic aneurysms. J Urol 1992; 148 : 18.
- Sharaf A. et al. Ureteroscopy in patients with bleeding diatheses, anticoagulated, and on anti-platelet agents: a systematic review and meta-analysis of the literature. J Endourol 2017; 31 : 1217.
- Aboumarzouk O. M. et al. Analgesia for patients undergoing shockwave lithotripsy for urinary stones – a systematic review and meta-analysis. Int Braz J Urol 2017; 43 : 394.
- Van Besien J. et al. Ultrasonography is not inferior to fluoroscopy to guide extracorporeal shock waves during treatment of renal and upper ureteric calculi: a randomized prospective study. Biomed Res Int 2017; 2017 : 7802672.
- Lopez-Acon J.D. et al. Analysis of the efficacy and safety of increasing the energy dose applied per session by increasing the number of shock waves in extracorporeal lithotripsy: a prospective and comparative study. J Endourol 2017; 31 : 1289.
- Connors B. A. et al. Extracorporeal shock wave lithotripsy at 60 shock waves/min reduces renal injury in a porcine model. BJU Int 2009; 104 : 1004.
- Kang D. H. et al. Comparison of high, intermediate, and low frequency shock wave lithotripsy for urinary tract stone disease: systematic review and network meta-analysis. PLoS One; 2016; 11: e0158661.
- Ng C. F. et al. Effect of stepwise voltage escalation on treatment outcomes following extracorporeal shock wave lithotripsy of renal calculi: a prospective randomized study. J Urol 2019; 202 : 986.
- Oestreich M. C. et al. Alpha-blockers after shock wave lithotripsy for renal or ureteral stones in adults. Cochrane Database Syst Rev 2020; 11: CD013393.
- Luo Z. et al. Comparison of retrograde intrarenal surgery under regional versus general anaesthesia: a systematic review and meta-analysis. Int J Surg 2020; 82 : 36.
- Ambani S. N. et al. Ureteral stents for impassable ureteroscopy. J Endourol 2013; 27 : 549.
- Law Y. X. T. et al. Role of pre-operative ureteral stent on outcomes of retrograde intra-renal surgery (RIRS): systematic review and meta-analysis of 3831 patients and comparison of Asian and non-Asian cohorts. World J Urol 2022; 40 : 1377.
- Pace K. T. et al. Same session bilateral ureteroscopy for multiple stones: results from the CROES URS Global Study. J Urol 2017; 198 : 130.
- Stern J. M. et al. Safety and efficacy of ureteral access sheaths. J Endourol 2007; 21 : 119.
- Traxer O. et al. Prospective evaluation and classification of ureteral wall injuries resulting from insertion of a ureteral access sheath during retrograde intrarenal surgery. J Urol 2013; 189 : 580.
- Traxer O. et al. Differences in renal stone treatment and outcomes for patients treated either with or without the support of a ureteral access sheath: The Clinical Research Office of the Endourological Society Ureteroscopy Global Study. World J Urol 2015; 33 : 2137.
- Karim S. S. et al. Role of pelvicalyceal anatomy in the outcomes of retrograde intrarenal surgery (RIRS) for lower pole stones: outcomes with a systematic review of literature. Urolithiasis 2020; 48 : 263.
- Santiago J. E. et al. To dust or not to dust: a systematic review of ureteroscopic laser lithotripsy techniques. Curr Urol Rep 2017; 18 : 32.
- Ventimiglia E. et al. High - and low-power laser lithotripsy achieves similar results: a systematic review and meta-analysis of available clinical series. J Endourol 2021; 35 : 1146.
- Haas C. R. et al. Pulse-modulated holmium:YAG laser vs the thulium fiber laser for renal and ureteral stones: a single-center prospective randomized clinical trial. J Urol 2023; 209 : 374.
- Allam C. L. et al. The role of routine ureteral stenting following uncomplicated ureteroscopic treatment for upper ureteral and renal stones: a randomized control trial. J Endourol 2023; 37 : 257.
- Abdullatif V. A. et al. The safety and efficacy of endoscopic combined intrarenal surgery (ECIRS) versus percutaneous nephrolithotomy (PCNL): a systematic review and meta-analysis. Adv Urol 2022; 2022 : 1716554.
- Cracco C. M. et al. Endoscopic combined intrarenal surgery (ECIRS) – tips and tricks to improve outcomes: a systematic review. Turk J Urol 2020; 46: S46.
- Davis N. F. et al. Comparison of treatment outcomes for fluoroscopic and fluoroscopy-free endourological procedures: a systematic review on behalf of the European Association of Urology Urolithiasis Guidelines Panel. Eur Urol Focus 2023; 9 : 938.
- Castellani D. et al. The impact of lasers in percutaneous nephrolithotomy outcomes: results from a systematic review and meta-analysis of randomized comparative trials. J Endourol 2022; 36 : 151.
- Srivastava A. et al. A prospective randomized study comparing the four tract dilation methods of percutaneous nephrolithotomy. World J Urol 2017; 35 : 803.
- Deng J. et al. Standard versus mini-percutaneous nephrolithotomy for renal stones: a meta-analysis. Scand J Surg 2021; 110 : 301.
- Ruhayel Y. et al. Tract sizes in miniaturized percutaneous nephrolithotomy: a systematic review from the European Association of Urology Urolithiasis Guidelines Panel. Eur Urol 2017; 72 : 220.
- Chen Z. J. et al. Comparison of tubeless percutaneous nephrolithotomy and standard percutaneous nephrolithotomy for kidney stones: a meta-analysis of randomized trials. Asian J Surg 2020; 43 : 60.
- Wang Z. et al. Comparison of safety and efficacy between single-tract and multiple-tract percutaneous nephrolithotomy treatment of complex renal calculi: a systematic review and meta-analysis. Minerva Urol Nephrol 2021; 73 : 731.
- Guler Y. Non-contrast computed tomography-based factors in predicting ESWL success: a systematic review and meta-analysis. Prog Urol 2023; 33 : 27.
- Drake T. et al. What are the benefits and harms of ureteroscopy compared with shock-wave lithotripsy in the treatment of upper ureteral stones? A systematic review. Eur Urol 2017; 72 : 772.
- Dasgupta R. et al. Shockwave lithotripsy versus ureteroscopic treatment as therapeutic interventions for stones of the ureter (TISU): a multicentre randomised controlled non-inferiority trial. Eur Urol 2021; 80 : 46.
- Wang W. et al. Ureteroscopy is equally efficient and safe in obese and morbidly obese patients: a systematic review and meta-analysis. Front Surg 2022; 9 : 736641.
- Alsawi M. et al. Primary versus delayed ureteroscopy for ureteric stones: a systematic review and meta-analysis. J Clin Urol 2022; 2022 : 20514158221088687.
- Mao T. et al. Efficacy and safety of laparoscopic pyelolithotomy versus percutaneous nephrolithotomy for treatment of large renal stones: a meta-analysis. J Int Med Res 2021; 49 : 300060520983136.
- Muller P. F. et al. Robotic stone surgery – current state and future prospects: a systematic review. Arab J Urol 2018; 16 : 357.
- Torricelli F. C. et al. Semi-rigid ureteroscopic lithotripsy versus laparoscopic ureterolithotomy for large upper ureteral stones: a meta-analysis of randomized controlled trials. Int Braz J Urol 2016; 42 : 645.
- Rippel C. A. et al. Residual fragments following ureteroscopic lithotripsy: incidence and predictors on postoperative computerized tomography. J Urol 2012; 188 : 2246.
- Tzelves L. et al. Duration of follow-up and timing of discharge from imaging follow-up, in adult patients with urolithiasis after surgical or medical intervention: a systematic review and meta-analysis from the European Association of Urology Guideline Panel on Urolithiasis. Eur Urol Focus 2023; 9 : 188.
- Mason M. M. et al. A comparison of adverse pregnancy events between ureteral stents and percutaneous nephrostomy tubes in the treatment of nephrolithiasis during pregnancy: a propensity score-matched analysis of a large multi-institutional research network. World J Urol 2023; 41 : 1721.
- Johnson E. B. et al. Obstetric complications of ureteroscopy during pregnancy. J Urol 2012; 188 : 151.
- Ramachandra M. et al. Safety and feasibility of percutaneous nephrolithotomy (PCNL) during pregnancy: a review of literature. Turk J Urol 2020; 46 : 89.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



