-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAktuální možnosti diagnostiky a léčby AML a MDS nízkého rizika
Datum publikace: 7. 10. 2024
Akutní myeloidní leukémie
Úvod
Akutní myeloidní leukémie (AML) je nádorové onemocnění krvetvorby charakteristické zmnožením abnormálních nezralých buněk myeloidní linie (blastů) v kostní dřeni, což vede k útlaku fyziologické tvorby krevních elementů. Dominantně postihuje starší nemocné, jeho incidence narůstá s věkem (1).
Základem současné klasifikace je rozdělení na základě molekulárně genetických a cytogenetických abnormalit, jež se mezi sebou liší především prognózou a klinickým průběhem. AML obecně představuje vysoce agresivní a rychle progredující onemocnění, které může být bez specifické léčby v krátké době pro pacienta fatální.
Terapeutická strategie bere v potaz kromě charakteristiky samotného onemocnění také celkový stav a komorbidity nemocného. Základem kurativní léčby nadále zůstává intenzivní indukční chemoterapie následovaná 2–3 cykly konsolidační chemoterapie a/nebo alogenní transplantací krvetvorných buněk (alo-HSCT) (2). I přes výrazné zlepšení podpůrné péče v posledních desetiletích však stále zůstává jedním z hlavních problémů vysoké riziko život ohrožujících komplikací v průběhu terapie, dominantně u starších a polymorbidních pacientů, a dále neméně vysoké riziko relapsů spojených s výrazně nepříznivou prognózou onemocnění.
Etiologie
Na rozdíl od akutní lymfoblastové leukémie (ALL) představuje AML onemocnění typicky se vyskytující ve vyšším věku – medián věku pacientů v době stanovení diagnózy činí 69 let (1).
Etiologie AML doposud nebyla plně objasněna, nicméně známe již několik jasných rizikových faktorů přispívajících ke vzniku akutních leukémií. Patří k nim především předchozí cytostatická léčba a radioterapie a taktéž může být asociovaná s některými vrozenými chromosomovými syndromy a syndromy s genetickou nestabilitou (Downův syndrom, Fanconiho anémie) (3).
Klinický obraz
Klinické příznaky bývají často nespecifické, vznikají náhle a v důsledku útlaku fyziologické krvetvorby. V krevním obrazu může být přítomná jak leukocytóza s vyplavováním velkého počtu blastů, tak také naopak leukopenie, zpravidla bývá přítomná souběžně anémie a trombocytopenie.
V důsledku poruchy nespecifické imunity při granulocytopenii je jedním z nejčastějších průvodních příznaků AML zvýšený výskyt recidivujících infekcí, které nedostatečně odpovídají na konvenční antibiotickou terapii. Trombocytopenie vede nejčastěji ke slizničnímu a kožnímu krvácení (epistaxe, hematomy, petechie). Klinický obraz dále dotváří anemický syndrom vyjádřený dušností, únavou a fyzickou nevýkonností. Nezřídka se můžeme setkat i s extramedulárním postižením, nejčastěji infiltrací kůže a dásní – dominantně u AML s monocytovou složkou.
Urgentní stav představuje syndrom leukostázy vyskytující se u AML s leukocytózou obvykle > 100 × 109/l, který obvykle provázejí symptomy respirační insuficience až respiračního selhání a poruchy centrálního nervového systému.
Diagnostika a klasifikace
Rozvoj molekulárně genetické podstaty AML a větší dostupnost vyšetřovacích metod v běžné klinické praxi v posledních letech výrazně ovlivnily diagnostiku i klasifikaci nemocných s AML. Důraz v hierarchii je kladen na molekulárně biologickou a cytogenetickou charakteristiku, která také odráží prognostickou stratifikaci onemocnění.
Nejnovější doporučení z roku 2022 týkající se klasifikace AML se v pojetí European LeukemiaNet (ELN) a Světové zdravotnické organizace (WHO) nepatrně liší. Základní podmínkou stanovující diagnózu AML dle ELN zůstává přítomnost minimálně 20 % blastů v periferní krvi (PK) nebo kostní dřeni (KD). Jedinou výjimku tvoří nově podjednotka AML s rekurentními genetickými aberacemi, u níž pro stanovení diagnózy stačí již přítomnost 10 % blastů v KD či PK při přítomnosti typické genetické mutace (viz tab. 1) (4). WHO dokonce v případě přítomnosti těchto genetických abnormalit procentuální kritérium zcela eliminovala (5). Tato změna tak jasně odráží důležitost komplexního molekulárně biologického vyšetření při vstupní sternální punkci u nemocných s AML.
ELN dále nově zavedla v případě nálezu 10–19 % blastů v PK či KD jednotku MDS/AML, která je, jak vyplývá z jejího názvu, prognosticky i biologicky na pomezí diagnózy myelodysplastického syndromu (MDS) a AML, a tedy i její terapie vychází ze stejných principů jako léčba AML. Kompletní klasifikaci dle doporučení ELN 2022 prezentuje tab. 1. Diagnostické přívlastky (související s předchozí terapií, progredující z MDS nebo MDS/MPN, s germinální predispozicí) již netvoří samostatné podskupiny AML, ale uvádějí se jako přívlastek za samotnou jednotku AML (4).
Doporučená vstupní vyšetření nutná ke stanovení diagnózy, zhodnocení rizikového skóre a posléze ovlivňující volbu léčebné strategie ukazuje tab. 2 (4).
Tab. 1 Klasifikace AML dle ELN 2022 (4)
AML s rekurentní genetickou abnormalitou (≥ 10 % blastů v PK či KD)
akutní promyelocytová leukémie s t(15;17)(q24.1;q21.2)/PML::RARA
AML s t(8;21)(q22;q22.1)/RUNX1::RUNX1T1
AML s inv(16)(p13.1q22) nebo t(16;16)(p13.1;q22)/CBFB::MYH11
AML s t(9;11)(p21.3;q23.3)/MLLT3::KMT2A
AML s t(6;9)(p23;q34.1)/DEK::NUP214
AML s inv(3)(q21.3q26.2) nebo t(3;3)(q21.3;q26.2)/GATA2, MECOM (EVI1)
AML s mutací NPM1
AML s in-frame bZIP mutací CEBPA
AML s t(9;22)(q34.1;q11.2)/BCR::ABL
AML s jinou vzácnou rekurentní translokací
AML (≥ 20 % blastů v PK nebo KD) nebo MDS/AML (10–19 % blastů v PK či KD)
s mutací TP53
s myelodysplastickou mutací (ASXL1, EZH2, BCOR, RUNX1, SF3B1, SRSF2, STAG2, U2AF1 a/nebo ZRSR2)
s myelodysplastickou cytogenetickou abnormalitou
jinak nespecifikovaná
Diagnostický přívlastek AML
související s předchozí terapií (chemoterapie, radioterapie, imunoterapie)
progredující z MDS nebo MDS/MPN
s germinální predispozicí
Tab. 2 Vstupní vyšetření u pacientů s AML (4)
Iniciální vyšetření pro stanovení diagnózy AML
mikroskopický diferenciální krevní obraz
vyšetření aspirátu kostní dřeně, eventuálně trepanobiopsie KD (v případě suché punkce)
- myelogram
- vyšetření průtokovou cytometrií (i PK)
- cytogenetické vyšetření (karyotyp, FISH)
- molekulárně biologické vyšetření (i PK)
Další vyšetření nezbytná/vhodná pro volbu léčebné strategie
demografické údaje
osobní anamnéza, komorbidity
rodinná anamnéza
anamnéza krvácení
kompletní fyzikální vyšetření
stanovení výkonnostního stavu (PS ECOG/WHO)
hodnocení geriatrických syndromů (volitelně)
biochemické a koagulační vyšetření
vyšetření hepatitid (A, B, C), HIV1, CMV, EBV, HSV, VZV
těhotenský test (u pacientek v reprodukčním věku)
zhodnocení případného provedení alogenní transplantace krvetvorných buněk, typizace HLA
rtg hrudníku, 12svodové EKG, echokardiografie
CT hrudníku (při podezření na pneumonii)
lumbální punkce (při podezření na infiltraci CNS)
kryokonzervace oocytů a spermatu (na přání pacienta)
biobanking
Stanovení rizika
Aktuální doporučení ELN z roku 2022 na základě kombinace cytogenetického a molekulárně biologického vyšetření rozdělují pacienty s AML do 3 prognostických skupin predikujících pravděpodobnost dosažení kompletní remise, ale také dlouhodobého přežití. Riziková stratifikace je základem určení léčebné strategie v kombinaci s posouzením rizikových faktorů na straně pacienta. Rozdělení rizikových skupin na základě ELN 2022 shrnuje tab. 3 (4).
Tab. 3 Rozdělení AML z hlediska rizikovosti dle ELN 2022 (4)
Riziková skupina
Cytogenetické/molekulárně genetické nálezy
Příznivá
t(8;21)(q22;q22.1)/RUNX1::RUNX1T1
inv(16)(p13.1q22) nebo t(16;16)(p13.1;q22)/CBFB::MYH11
mutovaný NPM1 bez přítomnosti FLT3-ITD
bZIP in-frame mutace CEBPA
Střední
mutovaný NPM1 s mutací FLT3-ITD
nemutovaný (wild type) NPM1 s FLT3-ITD (bez nepříznivých genetických abnormalit)
t(9;11)(p21.3;q23.3)/MLLT3::KMT2A
cytogenetické a/nebo molekulární abnormality neklasifikované jako příznivé či nepříznivé
Nepříznivá
AML s t(6;9)(p23;q34.1)/DEK::NUP214
t(v;11q23.3)/přestavba KMT2A
t(9;22)(q34.1;q11.2)/BCR::ABL
t(8;16)(p11.2;p13.3)/KAT6A::CREBBP
inv(3)(q21q26.2) nebo t(3;3)(q21;q26.2)/GATA2, MECOM (EVI1)
t(3q26.2;v)/přestavba MECOM (EVI1)
-5 nebo del(5q); -7; -17/abn(17p)
komplexní karyotyp, monosomový karyotyp
mutace TP53
mutace ASXL1, EZH2, BCOR, RUNX1, SF3B1, SRSF2, STAG2, U2AF1 a/nebo ZRSR2
Možnosti terapie AML
AML je potenciálně vyléčitelné onemocnění. Terapie s kurativním cílem je však především u starších a polymorbidních nemocných zatížena řadou často až život ohrožujících komplikací. Výběru samotné terapie tedy musí vždy předcházet jednak zhodnocení samotné nemoci na základě kombinace molekulárně biologického a cytogenetického vyšetření a dále komplexní posouzení důležitých faktorů na straně pacienta (věk, celkový stav, komorbidity).
Na obecně výrazně horších výsledcích terapie u starších pacientů s AML se kromě četných komorbidit limitujících použití intenzivní terapie podílí také odlišná biologie nemoci spočívající ve vyšší frekvenci výskytu nepříznivých cytogenetických abnormalit (6).
Léčba AML zůstává i přes neustále se zlepšující výzkum a vývoj nových molekul svízelná, jelikož musí brát v potaz především dva – často velmi obtížně slučitelné – úkoly. Na jedné straně musí být dostatečně intenzivní, aby vedla k eradikaci patologické nádorové populace, na druhé straně ovšem nesmí vést k výraznému poškození, či dokonce až úmrtí nemocného v důsledku toxicity samotné terapie.
Intenzivní terapie
Základem intenzivní léčby je podání indukční chemoterapie s cílem navodit hematologickou remisi onemocnění, následně pokračuje aplikace několika cyklů konsolidační chemoterapie a/nebo transplantace krvetvorných buněk. Zlatým standardem indukční chemoterapie je již několik dekád tzv. režim „3+7“ (3denní antracyklin a 7denní cytarabin), i když v posledních letech se na trh dostávají nové preparáty pro cílenou léčbu, které u vybraných podskupin nemocných mohou zvýšit efektivitu při kombinaci se samotnou indukční terapií.
Gemtuzumab-ozogamicin (GO) je humanizovaná anti-CD33 protilátka s navázaným kalicheamicinem s cytotoxickým efektem, která se kombinuje s indukční a následně konsolidační chemoterapií u pacientů s CD33-pozitivní AML. Efektivita GO oproti samotné chemoterapii ve smyslu signifikantního prodloužení přežití bez příhody (EFS) byla prokázaná pouze ve skupině nemocných se středním či nízkým cytogenetickým rizikem (7). Jeho přidání k chemoterapii obvykle prodlužuje dobu do restituce krevního obrazu a je spojené se zvýšeným rizikem vzniku sinusoidálního obstrukčního syndromu a taktéž krvácení. Opatrnost při jeho podávání je tedy nutná především u pacientů s preexistující hepatopatií.
Perorální inhibitor FLT3 midostaurin prokázal zlepšení celkového přežití (OS) u pacientů s AML s mutací FLT3 při přidání ke konvenční indukční i konsolidační chemoterapii (8). Z nežádoucích účinků se nejčastěji vyskytuje gastrointestinální toxicita (nauzea, zvracení) a je třeba myslet také na možnou kardiotoxicitu a prodloužení intervalu QT.
CPX-351 je nově dostupný kombinovaný preparát obsahující cytarabin a daunorubicin v liposomální formě. Je indikovaný u pacientů starších 60 let s AML spojenou s předchozí léčbou nebo změnami souvisejícími s myelodysplazií. Ve skupině nemocných ve věku 60–75 let prokázal potenciál dosažení dlouhotrvající remise a zlepšení OS ve srovnání s konvenční terapií „3+7“ (9). Podává se v indukční (1–2 cykly) i konsolidační léčbě.
Po prvotním dosažení hematologické remise indukční terapií (1 nebo 2 cykly) následuje konsolidační chemoterapie, jejímž cílem je eradikace i zbytkové nemoci (MRD), a tím v konečném důsledku navození dlouhodobé remise onemocnění. Základem konsolidační chemoterapie je několik cyklů vysokodávkovaného cytosinarabinosidu (3–4), s přidáním GO či midostaurinu, v případě, že byly přidány i k indukční terapii. U pacientů s AML střední a nepříznivé prognostické skupiny po podání 1–2 cyklů konsolidační chemoterapie následuje alogenní transplantace krvetvorných buněk. Tento proces je však i přes výrazné zlepšení podpůrné péče stále zatížen vysokou transplantační mortalitou, proto musí být indikace k transplantaci u každého pacienta individuálně pečlivě posouzena.
Udržovací terapie
Nezanedbatelným problémem zůstává u pacientů s AML i po dosažení hematologické remise vysoká četnost relapsů, dominantně u těch, kteří nepodstoupili alo-HSCT. Přítomnost pozitivní MRD v remisi je významným prediktorem časného relapsu a horšího OS. Do popředí se proto dostává otázka udržovací terapie, která by dokázala riziko relapsu signifikantně snížit, a tím prodloužit OS, samozřejmě za přijatelné toxicity.
Přítomnost mutace FLT3-ITD je asociovaná s nepříznivou prognózou a vysokým rizikem relapsu onemocnění, a to i po alogenní transplantaci krvetvorby. Inhibitor FLT3 midostaurin, který je používán v indukční a konsolidační chemoterapii, nemá v rámci udržovací léčby úhradu vzhledem k nejednoznačným výsledkům při jeho užití v této indikaci. Velkým problémem FLT3 inhibitorů je především vznik sekundární rezistence, postupně vedoucí ke ztrátě odpovědi.
Sorafenib jakožto multikinázový inhibitor (včetně FLT3) prokázal efekt na prodloužení OS při udržovací terapii u FLT3-ITD-pozitivních pacientů po transplantaci krvetvorby.
Novým preparátem na poli udržovací terapie je perorální forma azacitidinu (AZA), který jako první z preparátů v této indikaci prokázal signifikantní přínos pro pacienty s AML ve smyslu prodloužení OS. V randomizované placebem kontrolované studii QUAZAR AML-001 bylo zaznamenáno významné prodloužení OS (o 9,9 měsíce) a doby přežití bez relapsu (RFS; o 5,3 měsíce) ve srovnání s placebem u nemocných s AML v první remisi po intenzivní chemoterapii, kteří nebyli indikovaní k alo-HSCT. Prodloužení OS a RFS bylo zaznamenáno ve všech skupinách pacientů bez ohledu na počet podaných konsolidačních chemoterapií, a dokonce i ve skupině, které po indukci nebyla podaná žádná konsolidační chemoterapie. Medián OS i RFS byl navíc vyšší i ve skupině pacientů, kteří užívali p.o. AZA, ale nedostali konsolidační chemoterapii, oproti skupině, která absolvovala konsolidační chemoterapii, ale následně nedostávala p.o. AZA. Neméně důležitým poznatkem je, že tato terapie vedla k negativitě MRD u 37 % pacientů oproti 19 % v rameni s placebem (10).
Do studie QUAZAR AML-001 byli zařazeni nemocní starší 55 let, ve středním či vysokém cytogenetickém riziku. Během užívání léčby byly nejčastěji zaznamenány gastrointestinální nežádoucí účinky, zpravidla však nezávažných stupňů; z tohoto důvodu je v průběhu terapie doporučena profylaxe setronovými antiemetiky. Z hematologických nežádoucích účinků stupně 3 a 4 dle Common Terminology Criteria for Adverse Events (CTCAE) se ve studii vyskytovala trombocytopenie u 22 % pacientů, neutropenie u 41 % a anémie u 14 %. Toxicita léčby vedla k jejímu trvalému ukončení pouze u 13 % pacientů.
Perorální azacitidin se podává v dávce 300 mg 1× denně po dobu 14 dní ve 28denních cyklech až do progrese onemocnění. V současně době má v Česku úhradu v indikaci u pacientů s AML středního nebo nepříznivého cytogenetického rizika, u kterých bylo prvoliniovou terapií dosaženo kompletní remise a nejsou způsobilí k provedení alo-HSCT nebo se ji rozhodli nepodstoupit.
Ve studii QUAZAR AML-001 po ukončení studijní terapie 48 pacientů podstoupilo alo-HSCT; i v této skupině bylo zaznamenáno prodloužení OS v rameni užívajícím před transplantací p.o. AZA (11). Udržovací léčba p.o. AZA tedy může být využita i jako premosťovací do doby provedení alo-HSCT u pacientů ve špatném klinickém stavu spojeném s komplikacemi intenzivní terapie.
Neintenzivní terapie
AML je onemocnění vyskytující se dominantně u pacientů pokročilého věku, u kterých jsou možnosti léčby limitované převážně kvůli horšímu výkonnostnímu stavu (PS) a nezřídka i množství přidružených komorbidit. U této skupiny nemocných, kteří nejsou schopni podstoupit intenzivní chemoterapii spojenou s vysokým rizikem závažných komplikací, se v posledních letech stala zlatým standardem léčby kombinace hypomethylační látky a venetoklaxu. Tato terapie prokazatelně vede k signifikantnímu prodloužení doby do progrese onemocnění (PFS) a OS ve srovnání se samotným azacitidinem (14,7 vs. 9,6 měsíce) (12). Injekční AZA je hypomethylační látka, která se podává v subkutánně po dobu 7 dní v 28denních cyklech. Venetoklax je inhibitor bcl2, který je při kombinaci s azacitidinem podáván denně po dobu 28 dní. Tato terapie je spojená s nemalou hematologickou toxicitou, která vede u většiny pacientů k nutnosti redukce dávky. Při léčbě venetoklaxem je dále nutno zohlednit lékové interakce, zejména se silnými inhibitory CYP3A4. Tato modalita může být využita také u části pacientů v dobrém klinickém stavu jako premosťovací terapie před provedením alogenní transplantace krvetvorných buněk.
Ve specifické skupině pacientů s AML s mutací IDH1, kteří nejsou způsobilí k intenzivní terapii, je k dispozici perorální inhibitor IDH1 ivosidenib, který prokázal v kombinaci s s.c. AZA zlepšení OS i EFS oproti monoterapii s.c. AZA (13).
U části pacientů, kteří nejsou v době diagnózy schopni vzhledem k věku, celkovému stavu či komorbiditám podstoupit i tuto méně intenzivní terapii, jsou možnosti výrazně limitované a omezují se na podání podkožních injekcí nízkodávkovaného cytarabinu nebo pouze cytoredukční terapii hydroxyureou v kombinaci s transfuzní léčbou. Cílem této podpůrné terapie je prodloužení života při zachování jeho přijatelné kvality.
Závěr
I přes pokrok v pochopení biologie a lepší poznání molekulárně biologické podstaty AML je prognóza většiny nemocných nepříznivá. Největším problémem zůstává skupina starších a polymorbidních pacientů, kteří nejsou schopni podstoupit intenzivní chemoterapii a následnou alogenní transplantaci krvetvorných buněk, tím pádem je u nich nemalé riziko relapsu s extrémně nepříznivou prognózou. Vývoj nových léčivých přípravků spojených s menší toxicitou včetně nových možností udržovací terapie pro pacienty, kteří nejsou kandidáty alogenní transplantace, tak představuje novou naději pro zlepšení prognózy a dlouhodobých výsledků terapie AML.
Myelodysplastický syndrom nízkého rizika
Pojem myelodysplastický syndrom (MDS) byl nahrazen myelodysplastickou neoplazií, aby byl zdůrazněn nádorový charakter onemocnění a byla harmonizovaná nomenklatura s myeloproliferativními onemocněními.
Incidence a etiopatogeneze
MDS se vyskytuje převážně ve vyšším věku (mezi 65 a 70 lety) a jeho incidence činí 5 nových případů na 100 000 obyvatel ročně (14). Počet nových případů MDS narůstá s věkem, v populaci starší 70 let se tak vyskytuje až 20–40 nových případů na 100 000 obyvatel. Onemocnění může však postihnout i mladší nemocné, vzácně děti.
Ve většině případů onemocnění vzniká z nejasných příčin (primárně). Cca 10–20 % případů MDS se rozvine jako sekundární forma způsobená předchozími rizikovými faktory, ke kterým řadíme léčbu cytostatiky, ozařování nebo opakovaný kontakt s některými chemikáliemi (organická rozpouštědla, benzen, pesticidy). U MDS nebyla prokázána infekční etiologie a onemocnění není ani dědičné. Dosud však nebyly zcela objasněny všechny mechanismy, které vedou k nastartování vzniku choroby.
V kostní dřeni zdravého člověka jsou produkovány 3 druhy krevních buněk, které vycházejí ze společné zárodečné (kmenové) buňky: červené krvinky (erytrocyty), bílé krvinky (leukocyty) a krevní destičky (trombocyty). Poškozením této kmenové buňky dochází k rozvoji MDS. Zdravá kostní dřeň tvoří také nezralé krvinky (blasty), jež za normálních okolností vyzrávají v normálně funkční červené a bílé krvinky, krevní destičky. U pacientů s MDS nacházíme v bohaté kostní dřeni zvýšený počet blastů a určitá část ostatních krvinek má vzhledové abnormality (tzv. dysplastické změny). Uvedené nálezy jsou pro diagnózu MDS typické.
Naopak v krevním oběhu je málo normálních a zdravých krvinek. Jedná-li se o snížení počtu červených krvinek, hovoříme o chudokrevnosti (anémii). Dále může být zjištěno snížení počtu bílých krvinek (leukopenie a neutropenie) či krevních destiček (trombocytopenie). V případě, kdy jsou v krevním obrazu snížené všechny tři tyto elementy, hovoříme o pancytopenii.
Klinické projevy MDS
Klinický obraz nemoci je velmi různorodý, což je dáno její výraznou heterogenitou. U části pacientů může být přítomná pouze mírná chudokrevnost a onemocnění může být dlouhodobě stabilní, pouze s minimálními projevy bez nutnosti léčby. Na druhé straně se vyskytují nepříznivé varianty, u nichž je vysoké riziko progrese do vážnější choroby – akutní leukémie (AL).
Chudokrevnost (anémie)
Nejčastějším projevem této choroby je snížení hladiny červeného krevního barviva (hemoglobinu) pod normální hodnoty v krevním obrazu. Mluvíme pak o chudokrevnosti (anémii). Ke klinickým projevům anémie patří únava, snížení fyzické výkonnosti, dušnost (hlavně při námaze), hučení v uších a bledost pacienta. Na zhoršení projevů anémie se dále podílí vyšší věk nemocných a přidružené choroby – především kardiovaskulární.
Snížení počtu bílých krvinek (leukopenie) a snížení neutrofilních segmentů (neutropenie)
Snížení počtu a zhoršení funkce bílých krvinek se klinicky manifestuje různými bakteriálními či virovými infekcemi (zápal plic, močové infekty ad.). Infekční choroby u pacienta s MDS mohou mít těžší průběh a častěji recidivují oproti výskytu u zdravého člověka, současně se objevují infekce méně obvyklé. U nemocných s MDS klesá převážně počet určitého druhu bílých krvinek, tzv. neutrofilních leukocytů, které jsou určeny k obraně proti bakteriím.
Snížení počtu krevních destiček (trombocytopenie)
Snížení počtu a zhoršení funkce krevních destiček se klinicky projeví zhoršenou krevní srážlivostí a následně krvácivými projevy. Ty mohou být spontánní nebo následovat po běžných výkonech či drobném poranění (trhání zubů, říznutí). Krvácivé projevy často postihují i kůži ve formě krevních podlitin nebo tzv. petechií. Může se objevit rovněž krvácení z pohlavních orgánů, zažívacího traktu nebo vzácně i krvácení do mozku.
Diagnostický postup u pacientů s MDS
Krevní testy
Základním vyšetřením při podezření na MDS je stanovení krevního obrazu (KO) s manuálním diferenciálním rozpočtem hodnotícím jednotlivé podtypy bílých krvinek.
V rámci vyšetření krve jsou zpravidla doplněny biochemické testy, jež informují o celkovém stavu pacienta – o funkci jater, ledvin, orgánů s vnitřní sekrecí (štítná žláza) atd. Dále se provádí stanovení hladiny železa, včetně zásobního železa (ferritinu), hormonu erytropoetinu, vitaminu B12 a kyseliny listové (15).
Vyšetření kostní dřeně
V případě, že základní vyšetření krevního obrazu prokazuje chudokrevnost nebo jiné abnormality krevních elementů, je nutné doplnit vyšetření kostní dřeně (KD). Vzorky kostní dřeně mohou být získány na základě dvou odlišných procedur – sternální punkce nebo biopsie KD (trepanobiopsie).
Získání kostní dřeně nasátím dřeňové krve probíhá z hrudní kosti (sterna) nebo z lopaty kosti kyčelní. Z odebraných vzorků se provedou nátěry na sklíčko, které se po nabarvení hodnotí pod mikroskopem. To lékaři přinese základní informace o vývoji krevních elementů ve dřeni – o jejich počtu a tvaru či dalších rozpočtových abnormalitách ve dřeni. Dále se odebírají vzorky k imunofenotypizačnímu vyšetření, kdy jsou ve speciálním přístroji krvinky hodnoceny podle určitých znaků na svém povrchu (označovaných jako CD + příslušné číslo). Cytogenetické vyšetření z KD umožní určit chromosomové abnormality (16). Biopsie kostní dřeně představuje odběr malého vzorku dřeně z hřebene kyčelní kosti a poskytuje možnost podrobnějšího histologického vyšetření stavby kostní dřeně.
K rizikům patří možný hematom (modřina) v místě výkonu, mírná bolest v průběhu nebo vzácně rozvoj infekce. Oba výkony se provádějí v lokálním znecitlivení za sterilních podmínek a můžeme je přirovnat k trhání zubů. Před biopsií dřeně jsou pacientům podávány léky tlumící bolest. Pacienti se těchto vyšetření často obávají, ale vysvětlení rizik, průběhu výkonu a na druhé straně přínosu výsledků se stanovením správné diagnózy a léčebného postupu tyto obavy může pomoci rozptýlit.
Doplňující testy
V rámci pátrání po příčině abnormalit v krevním obrazu jsou u pacientů často prováděny další odběry a testy, jež mohou přispět ke stanovení správné diagnózy. Jedná se například o virologické vyšetření (testy na žloutenky či HIV), koagulační vyšetření (stanovení krevní srážlivosti), imunohematologické vyšetření (stanovení protilátek proti erytrocytům a trombocytům) a řadu dalších.
Stanovení diagnózy MDS a klasifikace onemocnění
Variabilita MDS způsobuje, že průběh toho onemocnění se u jednotlivých pacientů značně liší jak v klinickém obrazu, tak v prognóze onemocnění, respektive riziku progrese do akutní leukémie.
Lékař po stanovení diagnózy MDS u každého pacienta provede přesné zařazení do podtypu MDS podle zvolené klasifikace. Často se užívá starší Francouzsko-americko-britská klasifikace (FAB) nebo novější klasifikace dle Světové zdravotnické organizace (WHO). Ta byla poprvé zveřejněna v roce 2002 a následně několikrát upravena. Základem pro klasifikaci MDS dle WHO je dysplazie ve dřeni (dysplastické změny ≥ 10 % buněk dané řady) a počet blastů. K aktualizaci klasifikace přispěly i některé molekulární nálezy. Pro zjednodušení a lepší pochopení zveřejňujeme pouze poslední verzi klasifikace WHO z roku 2022 (17).
Nutno zdůraznit, že počet a tíže cytopenie v krevním obrazu nemusí vždy odpovídat nálezu ve dřeni. U každého nemocného je nutné individuálně stanovit rizikovost choroby a z toho vyplývá i následující léčebný postup. K tomu nám slouží Mezinárodní prognostický skórovací systém (IPSS) (18). Snaha stále zpřesňovat riziko choroby vedla v roce 2012 k vzniku nejnovějšího revidovaného Mezinárodního prognostického skórovacího systému (IPSS-R) (19). Zahrnutí metod molekulární biologie pak znamenalo vytvoření molekulárního Mezinárodního prognostického skórovacího systému (IPSS-M) (20–22).
V rámci klasifikace byla nově definována onemocnění zahrnující klonální hematopoézu, jež zahrnuje populaci buněk odvozených od mutované kmenové buňky bez cytopenie. Klonální hematopoéza neznámého potenciálu (CHIP) je definovaná jako klonální populace nesoucí somatickou mutaci pro myeloidní malignity o velikosti variantní alelové frakce ≥ 2 %. Klonální cytopenie neznámého významu (CCUS) je definovaná jako CHIP a ≥ 1 perzistentní cytopenie. Definice cytopenie jsou harmonizovány pro CCUS, MDS a MDS/MPN jako hemoglobin < 130 g/l pro muže, < 120 g / l pro ženy, absolutní hladina neutrofilů < 1,8 × 10/9 /l a hladina trombocytů < 150 × 109/l.
Klasifikace MDS dle WHO
Obecně bylo onemocnění rozděleno na 2 skupiny, a to MDS s definovanou genetickou abnormalitou a MDS definované morfologicky (viz tab. 4) (17).
Tab. 4 Klasifikace MDS dle WHO z roku 2022 (17)
Kategorie MDS
Blasty
Cytogenetika
Mutace
MDS s geneticky definovanou abnormalitou
MDS s nízkým počtem blastů a izolovanou delecí 5q (MDS-5q)
KD < 5 %, PK < 2 %
del(5q) izolovaně ± 1 další mimo del(7q) a monosomie 7
MDS s nízkým počten blastů a mutaci SF3B1 (MDS-SF3B1)
KD < 5 %, PK < 1 %
absence del(5q), monosomie 7 nebo komplexní karyotyp
SF3B1
MDS s bialelickou inaktivací TP53 (MDS-biTP53)
KD a PK < 20 %
komplexní změna karyotypu
≥ 2 mutací TP53 mutací nebo 1 mutace s průkazem ztráty počtu kopií TP53 nebo ztráta heterozygozity bez změny počtu kopií (cnLOH)
MDS definované morfologicky
MDS s nízkým počtem blastů (MDS-LB)
KD < 5 %, PK < 2 %
hypoplastický MDS (MDS-h)
snížená celularita KD (≤ 25 %)
MDS s vzestupem blastů (MDS-IB1)
KD 5–9 % nebo PK 2–4 %
MDS s vzestupem blastů (MDS-IB2)
KD 10–19 % nebo PK 5–19 % nebo Auerovy tyče
MDS s fibrózou (MDS-f)
KD 5–19 %, PK 2–19 %
1. MDS s definovanou genetickou abnormalitou
MDS s nízkým počtem blastů a izolovanou delecí 5q
Název tohoto podtypu je odvozen od chromosomu 5, kdy dojde k deleci (chybění) jeho dlouhého raménka (označeného q). Tato delece může být jedinou chromosomovou abnormalitou u pacienta nebo se může kombinovat s dalšími chromosomovými změnami. Pro zařazení pacienta do tohoto podtypu MDS je přípustná ještě jedna cytogenetická abnormalita, ale nesmí se jednat o postižení 7. chromosomu.
Pacienti s 5q - syndromem trpí především refrakterní anémií, která vyžaduje podpůrnou péči. V KO často nalézáme zvýšené hodnoty krevních destiček. Tento syndrom typicky postihuje ženy středního a staršího věku. V současné době pro terapii tohoto typu MDS využíváme lenalidomid.
MDS s nízkým počtem blastů a mutací SF3B1
U tohoto podtypu je ve dřeni přítomné dysplastické postižení jedné řady – nejčastěji se jedná o červenou řadu s následnou anémií. Další podmínkou je přítomnost prstenčitých sideroblastů (typů červených krvinek), jež obsahují granula železa kolem jádra a jsou viditelné v nátěru dřeně při speciálním barvení. V případě pozitivity molekulárního znaku SF3B1 je pro stanovení diagnózy dostačující počet ≥ 5 %, v ostatních případech musíme prokázat ≥ 15 % prstenčitých sideroblastů ve dřeni.
Tento podtyp choroby patří mezi méně agresivní formy MDS. Ke zlepšení anémie opět mohou přispět vitaminy, léčba erytropoetinem, případně je nutné podávání transfuzí. Nově se transfuzně-dependentní pacienti s tímto onemocnění léčí luspaterceptem.
MDS s bialelickou inaktivací TP53
Jedná se o nově definovanou kategorii MDS, u které prokazujeme mnohočetné mutace TP53, a to jak na úrovni genetické, tak i cytogenetické. Tato forma onemocnění je často spojená s komplexními změnami karyotypu a představuje prognosticky nepříznivou variantu myelodysplastického syndromu.
2. MDS definované morfologicky
MDS s nízkým počtem blastů (MDS-LB)
Do této skupiny patří pacienti, u nichž je v krevním obrazu různě vyjádřena cytopenie (od jedné cytopenie po pancytopenii), ale ve dřeni je vyjádřena dysplazie. Podmínkou je dále, že v kostní dřeni je přítomno < 5 % blastů a v periferní krvi (PK) < 2 % blastů.
Tyto typy jsou opět léčeny podle převažujících změn v krevním obrazu a potíží nemocného pomocí podpůrné terapie.
Hypoplastický MDS
Toto onemocnění je definováno na základě snížené celularity kostní dřeně (≤ 25 %), s přihlédnutím k věku nemocného.
MDS s vzestupem blastů (MDS-IB-1 a MDS-IB-2)
U pacientů s podtypem MDS-IB-1 nalezneme 5–9 % blastů v kostní dřeni a 2–4 % v periferním nátěru, dále nesmí být v dřeni nalezena Auerova tyč. Pacienti s MDS-IB-2 mají hodnoty blastů v kostní dřeni 10–19 % a v periferní krvi 5–19 %. V případě hodnot blastů v dřeni a periferní krvi ≥ 20 % jsou již splněna kritéria pro diagnózu AL.
Chování a rizikovost těchto podtypů MDS záleží ještě na dalších faktorech, jaké představují cytogenetické změny. K oběma podtypům ale musíme přistupovat jako k rizikovější formě MDS, a proto by měla být léčena podle dalších okolností (věk a celkový stav pacienta) agresivněji. U mladších pacientů by měla být vždy zvážena indikace alogenní transplantace. Z dalších modalit se nabízí léčba azacitidinem nebo chemoterapie.
MDS s fibrózou
Onemocnění je charakterizované přítomností retikulinové či kolagenní fibrózy. K přesné diagnostice této formy onemocnění je nutné trepanobioptické vyšetření.
Chronická myelomonocytová leukémie (CMML)
CMML je dnes řazena do skupiny smíšených myelodysplastických/myeloproliferativních (MDS/MPS) onemocnění. Můžeme ji rozdělit na CMML-1 (blasty 2–4 % v krvi, 5–9 % ve dřeni) a CMML-2 (blasty 5–19 % v krvi, 10–19 % ve dřeni). Podmínkou ke stanovení této diagnózy je absolutní počet monocytů v krevním obrazu > 1 × 109/l, který přetrvává po delší dobu (> 3 měsíce), a průkaz dysplazie minimálně jedné řady ve dřeni.
Nově se u pacientů s přítomností cytogenetické či molekulárně genetické abnormality pro potvrzení diagnózy vyžaduje počet monocytů > 0,5 × 109/l a relativní počet monocytů > 10 % v periferní krvi. Zůstává praktické rozdělení na myelodysplastický typ nemoci s leukocyty ≤ 13 × 109/l a myeloproliferativní typ s leukocyty > 13 × 109/l.
Mezinárodní prognostický skórovací systém (IPSS)
V roce 1997 byl na základě analýzy velkého souboru pacientů s MDS vypracován mezinárodní prognostický skórovací systém, který umožňuje blíže posoudit onemocnění a předpovědět jeho agresivitu i prognózu pacienta. U každého nemocného je skóre IPSS určeno na základě: počet nezralých buněk (blastů) v kostní dřeni, cytogenetický nález a počet cytopenií. Celkové skóre IPSS, které pacient dosáhne, zařadí nemocného do prognostické rizikové skupiny. Od IPSS se následně odvíjí předpoklad délky trvání onemocnění, míra rizika přechodu do akutní leukémie a léčba pacienta.
Zjištěné skóre IPSS stanoví, do které z následujících rizikových skupin pacient patří:
• nízce riziková skupina: skóre IPSS 0
• středně riziková skupina 1: skóre IPSS 0,5–1,0.
• středně riziková skupina 2: skóre IPSS 1,5–2,0.
• vysoce riziková skupina: skóre IPSS > 2,0.
Tab. 5 Skóre IPSS (18)
Prognostická hodnota
0
0,5
1,0
1,5
2,0
Blasty v kostní dřeni
< 5 %
5–10 %
–
11–20 %
21–30 %
Karyotyp
příznivý*
intermediární†
nepříznivý‡
–
–
Cytopenie
0/1
2/3
–
–
–
Pozn.:
*příznivý: normální, -Y, del(5q), del(20q)
†intermediární: ostatní abnormality zahrnuté v příznivých a nepříznivých změnách
‡nepříznivý: komplexní (≥ 3 abnormality) nebo abnormality chromosomu 7
• Nízké riziko: 0 bodů
• Intermediární 1 : 0,5–1,0 bod
• Intermediární 2 : 1,5–2,0 body
• Vysoké riziko: ≥ 2,5 bodu
Revidovaný Mezinárodní prognostický skórovací systém (IPSS-R)
Zatím nejnovější skórovací systém byl vytvořen a publikován v roce 2012. Je zde podrobněji zohledněno cytogenetické vyšetření pacienta, nižší počet blastů ve dřeni (< 5 %) je rozdělen do dvou skupin (≤ 2 % a 2–5 %) a z KO se přesněji posuzuje hodnota hemoglobinu, hodnota destiček a absolutní počet neutrofilů.
Tab. 6 Skóre IPSS-R (19)
Prognostická hodnota
0
0,5
1
1,5
2
3
4
Karyotyp
velmi dobrý
dobrý
střední
špatný
velmi špatný
Blasty v kostní dřeni
≤ 2 %
2–5 %
5–10 %
> 10 %
Hemoglobin (g/l)
≥ 100
80–100
< 80
Destičky (109/l)
≥ 100
50–100
Absolutní počet neutrofilů (109/l)
≥ 0,8
< 0,8
Cytogenetické prognostické skupiny:
- velmi dobrá: -Y, del(11q)
- dobrá: normální, del(5q), del(12p), del(20q), dvojitá změna zahrnující del(5q)
- střední: del(7q), +8, +19, i(17q), jiné jedna či dvě nezávislé změny v karyotypu
- špatná: -7, inv(3)/t(3q)/del(3q), dvojitá změna zahrnující -7/del(7q), komplexní změny se 3 změnami
- velmi špatná: komplexní změny karyotypu, > 3 abnormality karyotypu
Na základě stanovení parametrů u pacienta určujeme 5 kategorií v rámci IPSS-R:
• velmi nízce riziková skupina: skóre ≤ 1,5 bodu
• nízce riziková skupina: skóre > 1,5 až 3 body
• středně riziková skupina: skóre > 3 až 4,5 bodu
• vysoce riziková skupina: skóre > 4,5 až 6 bodů
• velmi vysoce riziková skupina: skóre > 6 bodů
Molekulární Mezinárodní prognostický skórovací systém (IPSS-M)
V roce 2022 byla publikována práce, v níž k dosud zadávaným proměnným v IPSS-R přibylo zohlednění molekulárně geneticky zjištěných mutací. Tento systém na základě přítomnosti mutací dále stratifikuje pacienty do 6 skupin. K zadání všech informací můžeme použít internetové kalkulátory – viz příklad kalkulátoru na stránkách MDS Foundation.
Obr. Příklad internetového kalkulátoru MDS Foundation
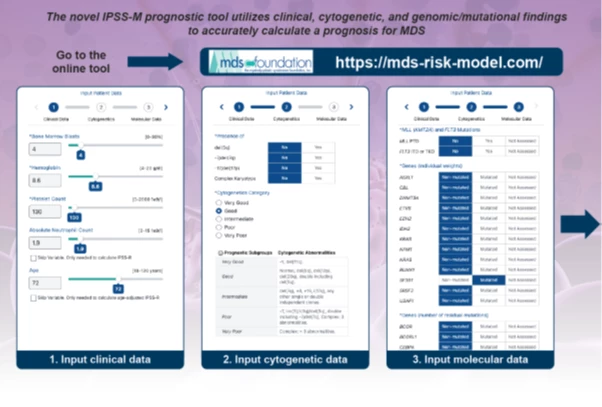
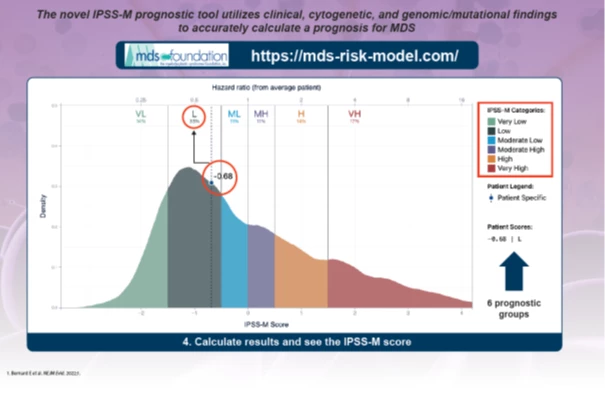
Terapeutické možnosti
Léčbu pacientů s MDS je nutné vždy přísně individualizovat v závislosti na konkrétních potížích nemocného, stadiu onemocnění, věku nemocného, přidružených chorobách a rizikovosti onemocnění stanovené podle IPSS. Je třeba zdůraznit, že konečné slovo při rozhodnutí o typu léčby má vždy pacient, jemuž musejí být poskytnuty všechny dostupné informace a současně dán prostor ke zvážení nabídnutých možností.
Pacienti s nízkým a středním rizikem 1 (IPSS 0–1)
Observace
Jedná se o pojem pro sledování pacienta bez terapie. Toto je možné pouze v případě mírných změn v krevním obrazu, zpravidla na počátku choroby, kdy není nutný žádný léčebný přístup. Je ovšem nutné sledovat všechny zatím neléčené pacienty s MDS, aby se včas odhalila progrese onemocnění do vyšších stadií. Frekvenci kontrol stanovuje ošetřující lékař na základě aktuálních hodnot v krevním obrazu a jejich vývoje.
Podpůrná léčba
Úkolem podpůrné léčby je především zredukovat či potlačit odstranit příznaky vyplývající z nemoci, a zlepšit tak kvalitu života pacienta. Nedokáže však onemocnění definitivně vyléčit. Součástí podpůrné terapie jsou převody červených krvinek a destiček, protiinfekční a chelatační léčba.
Transfuze červených krvinek
Jedná se o substituční terapii, která zmírňuje projevy chudokrevnosti, dušnost, únavu a ovlivňuje riziko nedokrevnosti (ischémie) v kardiovaskulárním systému (srdce, mozek). Podávání transfuzí se neřídí konkrétní hodnotou hladiny hemoglobinu, ale vždy klinickým stavem, věkem pacienta a přítomností přidružených chorob. Hladiny hemoglobinu, při kterých lékař indikuje podání transfuzí, se proto mohou u různých pacientů značně lišit. Zpravidla jsou však transfuze podávány již při hodnotách Hb < 80 g/l.
Skupinově shodná erytrocytová masa je připravena na transfuzním oddělení a další kontrola krevní skupiny se provádí bezprostředně před podáním u pacientova lůžka. Transfuze je podávána nitrožilně během 60–90 minut. Podání transfuzí je v našich podmínkách ohledně rizika přenosu dalších onemocnění zcela bezpečné a jen velmi vzácně se u pacientů objeví nežádoucí projevy (nejčastěji febrilní reakce).
Transfuze krevních destiček
Podávání krevních destiček je indikované při krvácivých projevech pacienta s těžkou trombocytopenií. Opět ani zde není stanovena hodnota trombocytů, kdy je již převod dárcovských destiček indikován. Vždy záleží na přítomných krvácivých projevech. Za velmi nízké a rizikové pro spontánní krvácení se však považují hodnoty trombocytů < 10 × 109/l. V některých případech jsou podávány krevní destičky podpůrně před plánovanými chirurgickými či stomatologickými výkony.
Protiinfekční léčba (antibiotická a antimykotická)
U pacientů, kteří mají snížené hodnoty leukocytů a neutrofilů, často dlouhodobě preventivně podáváme antibiotika a antimykotika. V případě rozvoje infekce je zapotřebí razantní protiinfekční terapie. U pacientů s MDS je vždy nutno pomýšlet i na méně obvyklé původce infekcí a tímto směrem přizpůsobit antiinfekční léčbu.
Chelatační léčba
Nemocní, kteří jsou dlouhodobě závislí na transfuzní léčbě, mohou být ohroženi rozvojem přetížení železem. Ve studiích bylo zjištěno, že zahájení chelatační léčby u pacientů s MDS nízkého rizika zlepší přežití a zřejmě i oddálí riziko progrese choroby. Chelatační léčbu je doporučeno zahájit u pacientů s hladinou ferritinu v krvi > 1000 µg/l a minimálně 20 podanými transfuzními jednotkami, kdy nadále trvá transfuzní závislost (23).
Růstové faktory krvetvorby
Erytropoézu stimulující proteiny (erytropoetin)
K léčbě chudokrevnosti můžeme použít i rekombinantně vyrobenou „napodobeninu“ přirozeného růstového faktoru erytrocytů – erytropoetin (EPO). Tato látka povzbuzuje kostní dřeň k tvorbě červených krvinek. Terapie je ovšem účinná pouze u určité části nemocných. Jedná se především o ty, kteří mají nízkou hladinu svého vlastního EPO v krvi a zároveň dosud nepotřebovali mnoho transfuzí. Léčebná odpověď se může zvýšit, pokud nemocní dostanou EPO v kombinaci s růstovými faktory, které stimulují kostní dřeň k tvorbě bílých krvinek (G-CSF). Aplikace obou preparátů je formou podkožní injekce.
Granulocyty stimulující faktor (filgrastim)
Pokud má pacient nízký počet bílých krvinek a trpí infekcí, je v některých případech vhodné podání faktoru stimulujícího kolonie granulocytů (G-CSF), tj. růstového faktoru bílých krvinek.
Imunosupresivní léčba
Imunosupresivní preparáty tlumí různými mechanismy imunitní systém člověka a jsou v medicíně používány v různých indikacích. Z pacientů s MDS jsou k imunosupresivní léčbě vhodní pacienti s cytopenií, kteří nejsou indikovaní k podávání růstových faktorů nebo u nich tato terapie byla neúspěšná. Lékař se může orientovat podle určitých faktorů, které by mohly předvídat úspěšnost léčby (například hypoplastická forma MDS – buněčně chudá dřeň, přítomnost přídatného chromosomu 8 atd.). Terapie bývá úspěšnější u pacientů mladších 65 let a s kratší dobou závislosti na transfuzích. K dispozici máme několik preparátů – např. antithymocytový globulin (ATG) či cyklosporin samostatně/v kombinaci s kortikoidy (24).
Imunomodulační terapie
U pacientů s MDS s izolovanou delecí 5q se prokázal jako velmi účinný lenalidomid. Jeho léčebný efekt je komplexní – zahrnuje antiangiogenní, protizánětlivý, imunomodulační a antineoplastické působení. Preparát se podává v dávce 10 mg/den perorálně po dobu 21 dnů v měsíci, po týdenní pauze se cyklus opět opakuje. Je určen pro pacienty s MDS a izolovanou delecí 5q a závislostí na transfuzích.
Zpravidla v prvním léčebném cyklu mohou být pozorovány výraznější poklesy parametrů krevního obrazu, které se od dalšího cyklu většinou upraví. Účinnost této terapie je velmi vysoká (75–80 %), rovněž velmi dobrá je její tolerance. Z nežádoucích účinků se mohou objevit svědění kůže, vyrážka, zažívací potíže, únava a zvýšené je i riziko trombózy.
Při dosažení dlouhodobé hematologické a cytogenetické remise onemocnění může lékař tuto terapii i vysadit. U většiny pacientů pak ještě delší dobu po vysazení léčby přetrvávají normální parametry v krevním obrazu a nové nasazení lenalidomidu opět navodí léčebnou odpověď (25, 26).
Luspatercept
Luspatercept je rekombinantní fúzní protein, který se váže na vybrané ligandy superrodiny transformujícího růstového faktoru beta (TGF-β). Vazbou na specifické endogenní ligandy (např. GDF-11, aktivin B) luspatercept inhibuje signalizaci Smad2/3, což vede k maturaci erytroidních buněk prostřednictvím diferenciace erytroidních prekurzorů v kostní dřeni. Signalizace Smad2/3 je abnormálně vysoká v modelech onemocnění charakterizovaných neúčinnou erytropoézou (tj. MDS a β-talasémie).
K léčbě luspaterceptem jsou indikovaní transfuzně dependentní pacienti s myelodysplastickým syndromem velmi nízkého, nízkého a středního rizika (27–29).
Alogenní transplantace krvetvorných buněk
U pacientů s MDS nízkého a středního rizika 1 není alogenní transplantace krvetvorných buněk standardně indikovaná. Lze ji zvážit u mladších osob (do 60–65 let) s těžkou a zhoršující se cytopenií, výrazně sníženou buněčností kostní dřeně (hypoplazií) nebo přítomností vazivových vláken (fibrózou) v dřeni. Provedení transplantace by se mělo zvažovat rovněž u sekundární formy MDS po předchozí léčbě chemoterapií či radioterapií, protože se jedná o prognosticky velmi nepříznivou formu MDS. U pacientů se středním rizikem 1 je alogenní transplantace indikovaná při výskytu > 5 % blastů v kostní dřeni nebo při průkazu nepříznivého karyotypu (30–32).
MUDr. Natália Podstavková, MUDr. Libor Červinek, Ph.D.
Interní hematologická a onkologická klinika LF MU a FN BrnoLiteratura:
1. Kouchkovsky ID, Abdul-Hay M. Acute myeloid leukemia: a comprehensive review and 2016 update. Blood Cancer J 2016; 6 (7): e441.
2. Döhner H, Wei AH, Appelbaum FR et al. Diagnosis and management of AML in adults: 2022 recommendations from an international expert panel on behalf of the ELN. Blood 2022; 140 (12): 1345–1377.
3. Deschler B, Lübbert M. Acute myeloid leukemia: epidemiology and etiology. Cancer 2006; 107 (9): 2099–2107.
4. Döhner H, Wei AH, Appelbaum FR et al. Diagnosis and management of AML in adults: 2022 recommendations from an international expert panel on behalf of the ELN. Blood 2022; 140 (12): 1345–1377.
5. Khoury JD, Solary E, Abla O et al. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Myeloid and Histiocytic/Dendritic Neoplasms. Leukemia 2022; 36 (7): 1703–1719.
6. Appelbaum FR, Gundacker H, Head DR. Age and acute myeloid leukemia. Blood 2006; 107 : 3481–3485.
7. Lambert J, Pautas C, Terré C et al. Gemtuzumab ozogamicin for de novo acute myeloid leukemia: final efficacy and safety updates from the open-label, phase III ALFA-0701 trial. Haematologica 2019; 104 (1): 113–119.
8. Stone RM, Mandrekar SJ, Sanford BL et al. Midostaurin plus chemotherapy for acute myeloid leukemia with a FLT3 mutation. N Engl J Med 2017; 377 (5): 454–464.
9. Lancet JE, Uy GL, Newell LF et al. CPX-351 versus 7+3 cytarabine and daunorubicin chemotherapy in older adults with newly diagnosed high-risk or secondary acute myeloid leukaemia: 5-year results of a randomised, open-label, multicentre, phase 3 trial. Lancet Haematol 2021; 8 (7): e481–e491.
10. Wei AH, Roboz GJ, Dombret H et al. Survival outcomes with oral azacitidine maintenance in patients with acute myeloid leukemia in remission by receipt of initial chemotherapy: subgroup analyses from the phase III QUAZAR AML-001 trial. Haematologica 2023; 108 (10): 2820–2825.
11. Ravandi F, Döhner H, Wei AH et al. Survival outcomes in patients with acute myeloid leukaemia who received subsequent therapy for relapse in QUAZAR AML-001. Br J Haematol 2024; 204 (3): 877–886.
12. DiNardo CD, Jonas BA, Pullarkat V et al. Azacitidine and venetoclax in previously untreated acute myeloid leukemia. N Engl J Med 2020; 383 (7): 617–629.
13. Montesinos P, Recher C, Vives S et al. Ivosidenib and azacitidine in IDH1-mutated acute myeloid leukemia. N Engl J Med 2022; 386 (16): 1519–1531.
14. Malcovati L, Hellström-Lindberg E, Bowen D et al.; European Leukemia Net. Diagnosis and treatment of primary myelodysplastic syndromes in adults: recommendations from the European LeukemiaNet. Blood 2013; 122 (17): 2943–2964.
15. Kilick S. B., Carter C., Culligan D. at al. Guidelines for the diagnosis and management of adult myelodysplastic syndromes. Br J Haematol 2014; 164 (4): 503–525.
16. Schanz J., Tüchler H., Solé F. et al. New comprehensive cytogenetic scoring system for primary myelodysplastic syndromes (MDS) and oligoblastic acute myeloid leukemia after MDS derived from an international database merge. J Clin Oncol 2012; 30 (8): 820–829.
17. Khoury J. D., Solary E., Abla O. et al. The 5th edition of the World Health Organization classification of haematolymphoid tumours: myeloid and histiocytic/dendritic neoplasms. Leukemia 2022; 36 (7): 1703–1719.
18. Greenberg P., Cox C., LeBeau M. M. et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997; 89 : 2079–2088.
19. Greenberg P, Revised International Prognostic Scoring System for Myelodysplastic Syndromes. Blood 2012; 120 : 2454–2465
20. Bernard E, Tuechler H, Greenberg P. L. et al. Molecular international prognostic scoring system for myelodysplastic syndroms. NEJM Evid 2022; 1 (7): EVIDoa2200008.
21. Sauta E., Robin M., Bersanelli M. et al. Real-world validation of molecular international prognostic scoring system for myelodysplastic syndromes. J Clin Oncol 2023; 41 (15): 2827–2842.
22. Lindsley R. C., Saber W., Mar B. G. et al. Prognostic mutations in myelodysplastic syndrome after stem-cell transplantation. N Engl J Med 2017; 376 (6): 536–547.
23. Angelucci E., Li J., Greenberg P. et al. Iron chelation in transfusion-dependent patients with low - to intermediate-1-risk myelodysplastic syndromes: a randomized trial. Ann Intern Med 2020; 172 (8): 513–522.
24. Stahl M., Bewersdorf J. P., Giri S. et al. Use of immunosuppressive therapy for management of myelodysplastic syndromes: a systematic review and meta-analysis. Haematologica 2020; 105 (1): 102–111.
25. List A., Kurtin S., Roe D. J. et al. Efficacy of lenalidomide in myelodysplastic syndromes N Engl J Med 2005; 352 : 549–557.
26. Fenaux P., Giagounidis A., Selleslag D. et al. A randomized phase 3 study of lenalidomide versus placebo in RBC transfusion-dependent patients with low-/intermediate-1-risk myelodysplastic syndromes with del5q. Blood 2011; 118 (14): 3765–3776.
27. Platzbecker U., Germing U., Gotze K. S. et al. Luspatercept for the treatment of anaemia in patients with lower-risk myelodysplastic syndromes (PACE-MDS): a multicentre, open-label phase 2 dose-finding study with long-term extension study. Lancet Oncol 2017; 18 (10): 1338–1347.
28. Platzbecker U., Gotze K. S., Kiewe P. et al. Long-term efficacy and safety of luspatercept for anemia treatment in patients with lower-risk myelodysplastic syndromes: the phase II PACE-MDS study. J Clin Oncol 2022; 40 (33): 3800–3807.
29. Platzbecker U., Della Porta M. G., Santini V. et al. Efficacy and safety of luspatercept versus epoetin alfa in erythropoiesis-stimulating agent-naive, transfusion-dependent, lower-risk myelodysplastic syndromes (COMMANDS): interim analysis of a phase 3, open-label, randomised controlled trial. Lancet 2023; 402 (10399): 373–385.
30. Alessandrino E. P., Porta M. G., Malcovati L. et al. Optimal timing of allogeneic hematopoietic stem cell transplantation in patients with myelodysplastic syndrome. Am J Hematol 2013; 88 (7): 581–588.
31. Robin M., Porcher R., Zinke-Cerwenka W. et al. Allogeneic haematopoietic stem cell transplant in patients with lower risk myelodysplastic syndrome: a retrospective analysis on behalf of the Chronic Malignancy Working Party of the EBMT. Bone Marrow Transplant 2017; 52 (2): 209–215.
32. de Witte T., Bowen D., Robin M. et al. Allogeneic hematopoietic stem cell transplantation for MDS and CMML: recommendations from an international expert panel. Blood 2017; 129 (13): 1753–1762.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



